乙醛脱氢酶在乳酸乳球菌中的表达与纯化
张丹雨,陈洋洋,刘晓阳,王佳星,张惟材,卜宁,熊向华
1.沈阳师范大学 生命科学学院,辽宁 沈阳 110034;2.军事医学研究院 生物工程研究所,北京100071;3.沈阳药科大学,辽宁 沈阳 110016;4.哈尔滨商业大学,黑龙江 哈尔滨 150076
乙醛会刺激人眼和上呼吸道,可致癌且具有生殖毒性。人体内乙醛来源有2 种,一种是外源性的,如通过呼吸将外源环境中的乙醛吸入体内;另一种是内源性的,如通过饮酒或含酒精饮料将乙醇(即酒精)带入人体,在体内经乙醇脱氢酶脱氢生成乙醛。人体内的乙醛可以被乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)进一步代谢。ALDH 是一种氧化还原酶,催化乙醛脱氢生成甲酸,除人体外广泛存在于动植物、微生物中[1]。据报道,目前已经从自然界中分离出500 多种ALDH[2],根据其蛋白结构、生物活性上的差异可大致分为 ALDH1~ALDH22 共 22 类。其中,主要分布在人体肝、胃、心脏等器官的有19 种,最常见的为 ALDH1~ALDH4[3-5]。在体内,ALDH 可催化乙醛转变为无害的乙酸,从而使乙醛无法进一步危害机体。但在大量饮酒的情况下,机体自身的ALDH 将无法完全将乙醇代谢产生的乙醛转化为乙酸,在这种情况下,补充外源ALDH 是一种很好的选择[6-7]。
目前主要通过机械或化学手段从动植物体内提取ALDH,或将ALDH 基因导入大肠杆菌或毕赤酵母表达系统中表达纯化获得ALDH[8-9]。提取法ALDH 产量受限,成本较高;而大肠杆菌重组表达安全系数低,胞内还原环境使二硫键形成受阻,重组蛋白无法正确折叠,易形成包涵体蛋白;毕赤酵母表达则需要甲醇诱导,但甲醇有毒且易燃易爆,对诱导产物的安全性会有一定的影响[10]。
乳酸乳球菌是公认的食品级安全微生物,宿主菌自身及表达系统的选择标记和诱导物均为食品级,乳酸乳球菌制品可直接口服,异源表达产物的安全性有保障[11]。我们通过乳酸乳球菌表达系统表达了毕赤酵母的ALDH,在低pH 条件下依然具有活性,可耐受人体胃酸环境,为研发口服解酒制剂奠定了基础。
1 材料与方法
1.1 材料
乳酸乳球菌NZ9000、质粒pNZ8048 由军事医学研究院生物工程研究所王艳春副研究员惠赠;大肠杆菌感受态细胞MC1061(按大肠杆菌超级感受态的制备试剂盒制备)购自上海生工公司;引物、ALDH 基因由北京擎科生物科技有限公司合成;重组试剂盒购自北京全式金生物技术有限公司;质粒提取试剂盒购自北京达科为生物科技有限公司;DNA 凝胶回收试剂盒购自ThermoFish⁃er Scientific 公 司 ;His 抗 体 购 自 AbMART 公 司 ;Western 印迹检测试剂盒购自北京全式金生物技术有限公司;Ni 柱购自GE 公司。
1.2 ALDH表达载体构建
由北京擎科生物科技有限公司合成ALDH 基因(GenBank 序列号 GQ397253.1),设计同源重组上下游引物(上游引物为5′-CATGGGTACTGCAG⁃GCATGCTTAGAACTGCAACTAGAACTACTTTC-3′,下游引物为5′-GAAAGCTTGAGCTCTCTAGATTA GTGGTGGTGGTGGTGGTGTTGTGGGCCATCGTTAA TGG-3′)进行PCR 扩增(预变性95℃ 5 min;变性95℃ 30 s,退火 55℃ 30 s,延伸 72℃ 30 s,30 个循环;终延伸 72℃ 10 min),PCR 产物与NcoⅠ/XbaⅠ双酶切的pNZ8048 质粒经琼脂糖凝胶电泳,回收产物经同源重组后转入大肠杆菌MC1061 感受态细胞,涂布于LB(含10 μg/mL 氯霉素)平板,37℃培养过夜,挑取单菌落至LB(含10 μg/mL 氯霉素)液体中,37℃、200 r/min 培养至对数期,经菌液PCR 和质粒NcoⅠ/XbaⅠ双酶切鉴定,阳性克隆送测序。
1.3 ALDH的诱导表达
将 1 μL 重组质粒 pNZ8048-ALDH 电转(20 V,25 μF,200 Ω)至 50 μL 乳酸乳球菌 NZ9000感态中,30℃孵育 1 h 后涂布于 GM17(含 10 μg/mL 氯霉素)平板,30℃培养过夜;挑取单菌落于GM17(含10 μg/mL 氯霉素)液体培养基中过夜培养;将过夜培养的菌液以1% 的体积比接种至GM17(含10 μg/mL 氯霉素)液体培养基,30℃静置培养至D600nm约为1.0,加入Nisin 诱导剂至终浓度为10 μg/mL,30℃静置诱导4 h;取诱导后的菌液 1 mL 于 EP 管中,12 000 r/min 离心 2 min,弃上清,加入500 μL TE 缓冲液,超声波破碎,取全菌裂解液、裂解液上清及裂解液沉淀,进行10%的SDS-PAGE,经凝胶扫描后分析蛋白表达水平及表达形式。
摸索不同浓度的诱导剂及不同诱导温度对蛋白表达量的影响。在30℃和37℃条件下分别设置4 种诱导剂浓度,即0.5、1、1.5、2.0 μg/mL,进行SDS-PAGE。在30℃条件下,待菌液D600nm约为1.0时加入Nisin 诱导剂至终浓度10 μg/mL,分别诱导 0、2、4、6、8 h,进行 SDS-PAGE。观察蛋白表达情况,找到最佳诱导条件。
1.4 ALDH活性检测
据文献[12-13]报道,ALDH 以 NAD+、NADH 为辅酶,还原性的NADH 在340 nm 处有最大吸收峰。酶、辅酶NAD+和底物在一定条件下可以反应,通过测定一定时间内D340nm值的变化,就可以得到NADH 生成量,从而计算酶活。取诱导后1 mL 菌液,离心收集菌体,加入500 μL TE 缓冲液,超声波破碎后获得粗酶液;以pNZ8048/NZ9000 为阴性对照。酶活测定体系见表1。配制反应体系后,在35℃金属浴中预热10 min,加入酶液,立即混匀,迅速倒入比色皿中,测定D340nm值。最适条件下,每分钟转化1 μmol 底物定义为1 个活力(U),反应体系里ALDH 的酶活计算公式为:
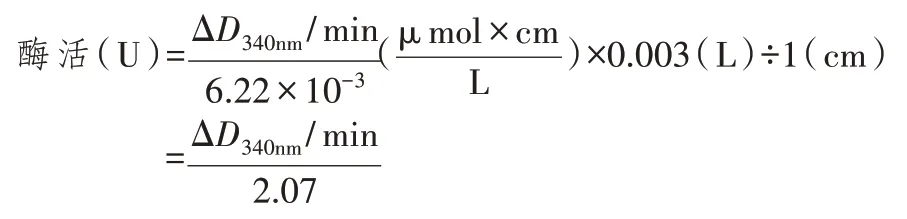
按照酶活测定体系测定菌裂解液的酶活,总反应体系3 mL,加入100 μL 酶液后迅速测定每分钟的D340nm值。取反应时间5~10 min 的变化值,计算每分钟内D340nm的变化值。
1.5 ALDH的纯化
将活化的菌液以1% 的接种量接种至200mL GM17 培养基中扩大培养,诱导后收集菌体,6000 r/min 离心 20 min,用 Tris-HCl(终浓度 50 mmol/L)重悬菌体,超声波破碎菌体;菌裂解液于4℃、8000 r/min 离心 10 min 沉降菌体,弃菌体,将上清过0.45 μm 滤膜,用预装Ni 柱纯化。经结合缓冲液(7.2 mmol/L Na2HPO4·12H2O,12.9 mmol/L NaH2PO4,500 mmol/L NaCl,20 mmol/L 咪唑 ,pH7.4)结合,收集穿过液;经洗脱液(7.2 mmol/L Na2HPO4·12H2O,12.9 mmol/L NaH2PO4,500 mmol/L NaCl,500 mmol/L 咪唑,pH7.4)梯度洗脱,收集洗脱液进行SDS-PAGE。
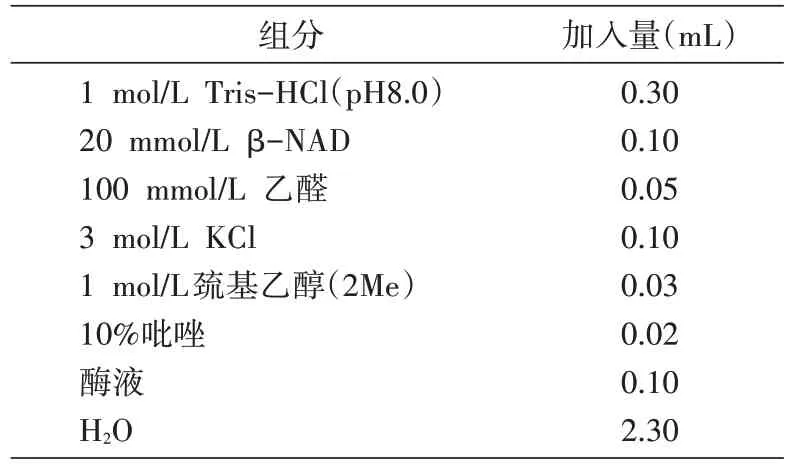
表1 酶活测定反应体系
2 结果
2.1 pNZ8048-ALDH表达载体构建
合成基因片段与pNZ8048 重组后转化大肠杆菌MC1061,挑取单克隆进行菌落PCR 鉴定,琼脂糖凝胶电泳鉴定目的条带与阳性对照相同(图1A)。将阳性克隆培养后提取质粒进行NcoⅠ/XbaⅠ双酶切鉴定,结果如图1B,目的片段大小与预期一致。将阳性克隆送北京擎科生物科技有限公司测序,测序结果与目的序列进行DNAMAN比对,显示基因序列一致(图2),说明pNZ8048-ALDH 质粒构建成功。
2.2 ALDH的诱导表达
将构建的pNZ8048-ALDH 质粒电转至乳酸乳球菌NZ9000,以最佳诱导条件诱导后收集菌体,超声波破碎后进行SDS-PAGE,结果显示有与预期目的蛋白大小相符的特异性表达条带,相对分子质量约为57×103,目的条带约占全菌蛋白的17.16%(图3A);取上清与沉淀分别进行SDSPAGE,结果表明目的蛋白为半可溶性表达半包涵体表达(图3B);以His 抗体为一抗,Western 印迹结果(图3C)表明目的蛋白与His 抗体有特异性结合。综上,ALDH 在乳酸乳球菌NZ9000 中获得表达。

图1 pNZ8048-ALDH 重组载体的菌液PCR(A)及双酶切鉴定(B)
诱导条件摸索结果如图4A 所示,在30℃和37℃培养条件下,随着诱导剂终浓度的提高,目的蛋白表达量逐渐增加,诱导剂终浓度为1 μg/mL时表达量最高,30℃时目的蛋白的表达量优于37℃。最终确定 30℃、1 μg/mL Nisin 诱导 4 h 为ALDH 的最佳表达条件(图4B)。
2.3 ALDH的纯化
菌裂解液通过亲和Ni 柱层析纯化,收集洗脱液进行SDS-PAGE,结果如图5,纯化样品与对照样品有相同大小的蛋白条带,相对分子质量约为57×103,与预期相符。
3 讨论

图2 pNZ8048-ALDH 重组载体的DNAMAN 比对结果

图3 pNZ8048-ALDH 全菌蛋白的SDS-PAGE(A)、表达形式(B)及Western 印迹(C)

图4 诱导剂浓度(A)及诱导时间(B)对ALDH 表达的影响

图5 His 纯化后的蛋白样品
获得ALDH 的主要方式有通过机械手段和化学手段从动物肝脏或植物组织中提取的提取法,以大肠杆菌和毕赤酵母作为宿主表达目的蛋白的表达法。提取法所得目的蛋白产量有限。黄娟等[13]采用大肠杆菌表达系统获得包涵体表达的ALDH,复性时不可避免地导致蛋白损失或结构改变。本研究将ALDH 通过重组整合到pNZ8048质粒上,以食品级乳酸乳球菌NZ9000 为宿主菌表达目的蛋白,表达量占全菌蛋白的17.163%,其中可溶性表达占53%,表明乳球菌表达较大肠杆菌包涵体表达有优势。另外,无论经IPTG 诱导的大肠杆菌表达系统还是经甲醇诱导的毕赤酵母表达系统,表达的ALDH 其安全性皆有待考证,而本研究经食品级Nisin 诱导剂诱导乳酸乳球菌表达的蛋白安全系数更高。在目前表达水平基础上,还可以通过优化诱导起始菌密度、诱导温度、诱导剂浓度及时间来进一步提高ALDH 的表达量和可溶性表达比例。
黄娟等利用大肠杆菌所表达的ALDH 活性为1.449 U/mL,本研究利用乳酸乳球菌表达系统所表达的ALDH 活性为0.638 U/mL,从酶活水平来看,乳酸乳球菌表达系统所获得的蛋白酶活相较于大肠杆菌表达系统略低,还须通过优化条件来提高酶的活性,从而获得高活性的蛋白。
目前ALDH 多用于乙醛代谢检测、降解石油烷烃,以及化妆品、化工、环境保护等方面。本研究以乳酸乳球菌表达系统表达ALDH,表达水平高,生产成本低,方法简易,具有较大的研究意义与实际应用价值。

