一株人血源猪链球菌的分子分型与耐药检测
吕燕宁 彭晓旻 赵佳琛 刘医萌 陈丽娟
猪链球菌(Streptococcus suis)是呈世界性分布的可以感染猪和人,而引起疾病的一种人兽共患病病原体。 根据其荚膜抗原的特异性,可分为35 个血清型,即1 ~34 型和1/2 型(同时含有1 型和2 型抗原),能感染人的致病血清型主要包括1、2、1/2、7、9 和14 型等6 种。 其中毒力最强的是1 型,而2 型分布最广泛,是引起我国猪链球菌病疫情的主要流行株,不仅能引起大规模的动物疫情,还可引起人偶发病例甚至造成人间疫情的暴发,严重者致人死亡,对公众健康尤其是高危人群的生命安全构成严重威胁。 20 世纪90 年代末和21 世纪初,江苏省和四川省曾发生过大规模人感染猪链球菌病疫情,导致多人死亡[1,2],近年人感染猪链球菌病散发病例在其他省份也时有发生[3-5]。 因此对该致病菌的快速鉴定分型以及耐药分析可以为患者的有效治疗和感染溯源以及突发疫情的迅速处置提供依据。 根据以往的监测数据,北京市既往无本地病例发生,本研究对北京市某医院就诊的1 例来自河北省人感染猪链球菌病例的血培养分离株,进行了分子分型与耐药分析,此病例为北京市首例实验室确诊的输入病例。 现将结果报道如下。
1 材料与方法
1.1 病例信息 患者,男,52 岁,来自河北省廊坊市,于2015 年12 月11 日发病,就诊于当地医院,病情加重后于13 日转至北京协和医院急诊科,主要症状有意识障碍、呼之不应、谵妄和躁动不安,伴有发热、恶心、呕吐及二便失禁。 患者在工作单位负责猪、牛、羊、驴、鸡和`鸭的饲养工作,其住所临近猪舍。 近年其工作场所均有病死猪情况发生,发病前一周,患者接触过1 只病死猪,对病死猪去毛时,手部有伤口。 临床诊断为人感染猪链球菌病、化脓性脑膜炎和急性脑梗死。
1.2 实验试剂 哥伦比亚血琼脂平板(英国OXOID公司),PCR 试剂为Invitrogen Platinum PCR SuperMix(美国Thermo 公司),革兰氏阳性菌药敏检测板K-1 型及配套试剂(上海星佰生物技术有限公司)。
1.3 实验仪器 iCycler PCR 仪(美国伯乐公司),毛细管核酸电泳仪QIAXCEL(德国QIAGEN 公司),全自动药敏试验菌液接种仪(美国Thermo 公司)。
1.4 细菌分离培养 将血培养物取200 μL 接种于哥伦比亚血琼脂平板划线培养,置37 ℃,5%二氧化碳培养箱培养24 h。 选取血平板上微小、圆形、边缘整齐、略带灰白色、露滴样、有明显的α 型或β 型溶血的单个菌落进行革兰氏染色,显微镜检查呈成对或短链状革兰氏阳性球菌。 挑取单菌落再接种到血琼脂平板上,置37 ℃温箱内培养24 ~48 h,获得分离菌的纯培养物。
1.5 细菌鉴定 染色镜检、血清分型试验、筛检生化试验参见文献[6]。
1.6 多位点序列分型(MLST)检测
1.6.1 菌株DNA 制备: 刮取1 ~2 接种环菌苔加入150 μL 三蒸水中,振荡混匀制成菌悬液,100 ℃煮沸10 min;14 500 r/min 离心10 min,取上清液于-20 ℃冰箱中保存备用。
1.6.2 目的片段扩增及序列分析: 根据MLST 数据库(https:/ /pubmlst.org/ssuis/)和文献报道[7,8],对猪链球菌7 个管家基因(aroA,dpr,cpn60,gki,mutS,recA,thrA)进行扩增,引物序列见表1。 反应体系为:21 μL Invitrogen Platinum PCR SuperMix, 上下游引物各1 μL,DNA 模板2 μL,共25 μL。 反应条件为预变性95℃ 4 min,变性95℃ 30 s,退火30 s,退火温度参见表1,延伸72℃ 30 s,30 个循环,后续延伸72 ℃7 min。 PCR 产物经毛细管电泳仪电泳分析后,送生工生物工程(上海)股份有限公司测序。 双向测序后经过组装分析确认的序列, 在线递交到猪链球菌MLST 网络服务器(https:/ /pubmlst. org/ssuis/)进行分析。
1.7 药敏试验(96 孔板微量稀释法)
1.7.1 菌液制备: 用灭菌拭子取适量在血平板培养18 ~24 h 的新鲜纯菌至灭菌生理盐水中制成菌悬液,用比浊仪测定菌悬液浓度,使其达到0.5 麦氏单位。 同时,用ATCC29212 作为试验质控菌株。
1.7.2 菌液稀释和加样: 取上述菌悬液 60 μL,加到12 mL 含 600 μL 无菌马血清营养肉汤培养液中,充分混匀。 取该肉汤培养液按照100 μL /孔量加入革兰氏阳性需氧菌药敏检测96 孔板各孔中(阴性对照孔除外)。 该药敏板中12 种抗生素(左氧沙星、青霉素、美罗培南、利奈唑胺、红霉素、克林霉素、氯霉素、氧氟沙星、万古霉素、四环素、头孢噻肟和头孢吡肟)以不同浓度梯度分布。 质控菌株操作同待测菌。
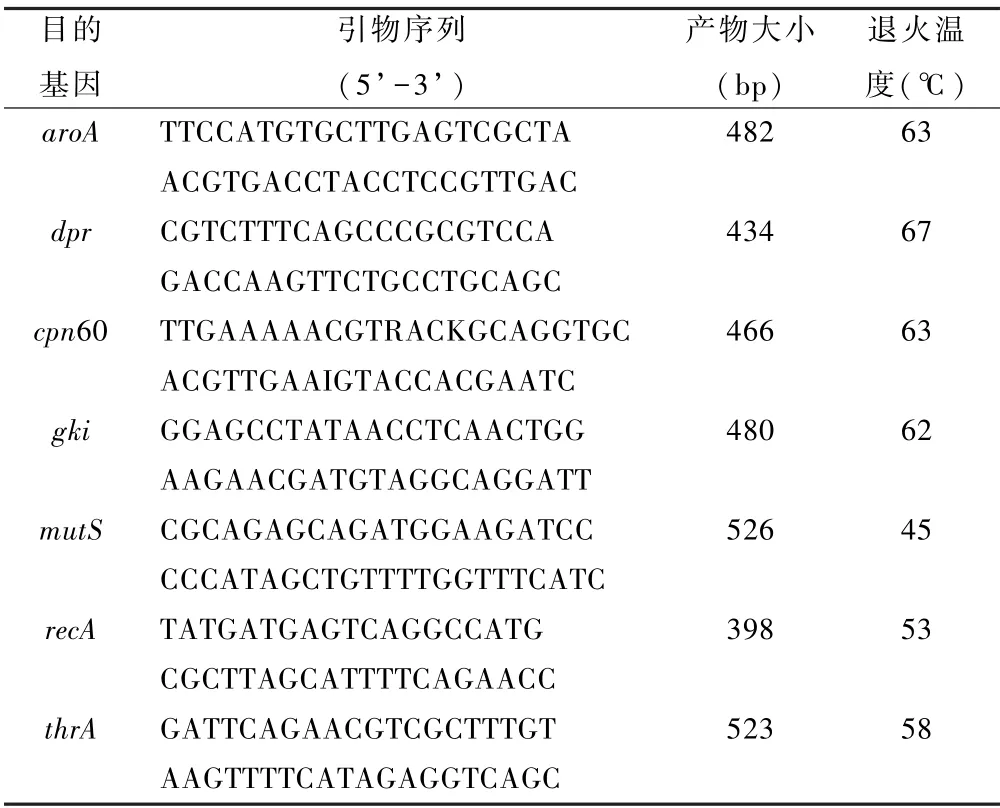
表1 猪链球菌7 个管家基因检测引物及其产物大小
1.7.3 药敏板培养和结果判读: 加入菌悬液的药敏板放37 ℃、5%CO2的温箱中孵育24 h。 用微生物鉴定药敏分析系统或肉眼判读的方法对药敏板条进行读数,经数据分析得到最低抑菌浓度(minium inhibitory concentration,MIC)值,根据美国临床实验室标准化委员会(CLSI)的M100ED29-2019 版的药物折点标准判定结果,获得相应的敏感(susceptible,S)、中介(intermediate,I)和耐药(resistant,R)结果。
2 结果
2.1 细菌鉴定结果 分离菌株为革兰氏阳性链球菌,触酶试验阳性,血清分型试验与猪链球菌2 型血清凝集。
2.2 MLST 分型结果 经PCR 反应分别扩增菌株基因组上的7 个管家基因位点aroA、dpr、cpn60、gki、mutS、recA 和thrA 的目标片段,均获得了清晰而又单一的目标条带(图1)。 各基因测序结果在线递交到猪链球菌MLST 网络服务器(https:/ /pubmlst. org/ssuis/)进行等位基因的比对分析,得到基因型为ST1型(1-1-1-1-1-1-1)。
2.3 药敏试验结果 在12 种抗生素中,该猪链球菌分离株仅对四环素和氯霉素耐药,对左氧沙星、青霉素、美罗培南、利奈唑胺、红霉素、克林霉素、万古霉素、头孢噻肟和头孢吡肟均敏感,而对氧氟沙星为中度敏感(表2)。
3 讨论
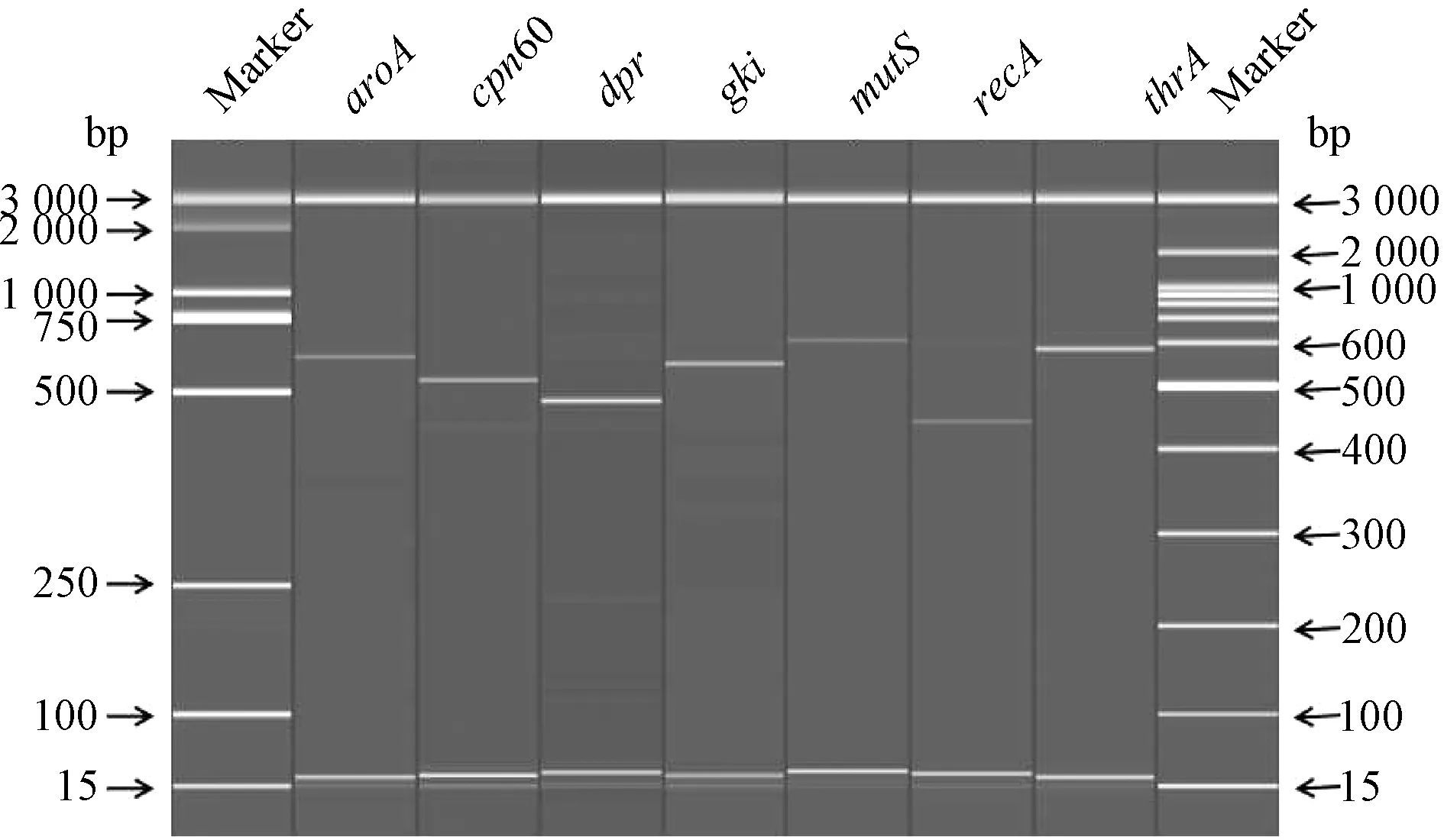
图1 分离菌株7 个管家基因片段PCR 扩增结果

表2 抗菌药物的判定折点与对分离菌株的最小抑菌浓度
3.1 猪链球菌具有复杂的遗传多样性,血清分型和分子分型是区别分离株和考查其致病性最重要的方法。 MLST 方法易于标准化,便于实验室间进行比对和分析,通过网络数据共享,进行全球范围的流行病学分析。 猪链球菌MLST 分型方法最初由King 等[8]于2002 年建立,并对294 株猪链球菌分离株进行分析,获得了92 个序列型(ST):其中ST1 克隆群(12 个ST 型)、ST27 克隆群(11 个ST 型)和ST87 克隆群(11个ST 型)是最主要的ST 分组,包含了绝大多数的高致病性分离株。 ST1 群多来自脑膜炎、关节炎和败血症的样本,ST27 和ST87 群则主要来自肺脏,与临床背景具有良好的相关性。 此后猪链球菌MLST 数据库不断丰富,到目前为止已发现了1 227 种ST 型。 本研究结果显示,此次引起人感染的猪链球菌血清2 型ST1型菌株,为高致病性世界流行株,欧洲(英国、法国、西班牙、荷兰、丹麦)、北美(美国、加拿大)、东南亚(泰国、越南)及中国(云南、四川、广东、江苏)均有报道[2,8-12]。 我国人感染猪链球菌分离株以ST1 和ST7型为主,ST1 与ST7 型同属ST1 克隆群,两者仅在thrA基因存在差异,而ST1 克隆群又被认为是毒力最强、最具致病性的克隆群。 我国辽宁、江苏、浙江、四川、湖南、云南、广东和广西等8 个省份有过ST1 型的报道,四川、浙江、江西、广东和贵州等5 个省份有过ST7型的报道。 其中,四川以ST7 型为主,广东和广西均有发现ST1 与ST7 型,ST1 型略多。 血清2 型ST7 型与1998 年江苏省和2005 年四川省的大规模暴发相关,但之后未见大面积扩散[13],ST1 型以散发为主。
3.2 猪链球菌耐药情况,呈逐年加重趋势[14]。 尤其是对四环素类药,耐药率可高达98.2%[15]。 针对人源分离株的耐药检测报道较少,此病例为河北省首例人感染猪链球菌病例[16,17],因此对分离株进行耐药检测不仅对该患者的临床治疗有重要意义,也可以在一定程度上反映该地区猪链球菌的耐药情况,为后续可能出现的续发病例能得到及时有效治疗提供一定的提示。 耐药检测显示此分离株仅对四环素和氯霉素耐药,这与全国大部分地区的检测结果一致[18-20],而与某些耐药监测结果不同的是[21],该分离株对其他9种常用抗生素仍是敏感的,可以做为临床治疗的备选药。
本病例来自河北廊坊,距离北京很近,既往河北省和北京市未有过人感染猪链球菌病的病例报道,因此该病例作为人感染猪链球菌病的首发病例具有指示作用,提示河北省与北京市应加强猪链球菌感染在猪间及人间流行病学与病原学的监测。

