一种新型ω-转氨酶的工业适应性选择
王继国,谢有余,王华磊,魏东芝
华东理工大学 生物工程学院,上海 200237
据FDA数据库分析,手性胺类化合物是小分子药物合成中重要的分子模块[1]。相比化学催化剂,合成手性胺的生物催化剂以光学纯度高、环境污染小等优势[2-3]一直被作为研究热点,如转氨酶类[4-10]、单胺氧化酶类[11]、亚胺还原酶类[12-13]及胺脱氢酶类[14-15]等。其中ω-转氨酶 (ω-TAs) 具有对映选择性和区域选择性高、底物谱较广以及无需额外添加昂贵的辅酶的优势,成为工业上用于生产手性胺的重要工业酶之一[3,16-24]。
目前报道的野生ω-TAs中能直接用于制药工业的为数不多,主要受限于酶的热不稳定及不利的反应平衡[4-10]。异丙胺 (IPA) 被认为是ω-TAs工业应用的理想氨基供体,其价格低廉利于供体过量,可以通过移除副产物丙酮来改变反应平衡[3-4]。但能接受IPA供体的野生ω-TAs数量极少,极大限制了其作为理想氨基供体的工业应用[25]。利用IPA供体有效地改变反应平衡对ω-TAs提出了严格的要求[26]:(1) 能接受IPA为供体;(2) 最适反应温度在40–60 ℃之间,且保持较高的热稳定性;(3) 最适pH值在7.0以上;(4) 能转化100–250 mmol/L以上的底物浓度[27]。
近年来基于新型氨基供体的高通量筛选方法被大量建立[5],但是这些氨基供体因成本高及产物纯化难等问题难以适应工业用途,而目前尚无基于IPA供体的高通量筛选方法。所以适当选择合适的高通量筛选方法,配合兼容IPA供体的转化率筛选流程有利于新型ω-TAs工业适应性选择。为了从土壤宏基因组中发现一种新型ω-TA,我们从目标底物筛选、序列来源筛选做了适应工业的选择;接着以邻亚二甲苯二胺显色法快速初筛酶活,再使用IPA供体的HPLC分析法进行转化率筛选,最后采用1-苯乙胺 (1-PEA) 动力学分析法进行酶学筛选,从而筛选出了一种来源于柄杆菌属的新型ω-转氨酶ATA-W12,并成功用于光学纯(S)-(+)-1-Boc-3-氨基哌啶的50 mL规模制备。
1 材料与方法
1.1 目标底物及氨基供体
1-Boc-3-哌啶酮 (98977-36-7)、1-Boc-3-吡咯烷酮 (101385-93-7) 作为目标底物,邻亚二甲苯二胺二盐酸盐 (21294-14-4)、IPA (75-31-0) 和(S)-(-)-α-甲基苄胺 (2627-86-3,1-PEA)作为氨基供体。其中邻亚二甲苯二胺二盐酸盐购自杰达维(上海) 医药科技发展有限公司,另外4种均购自上海百灵威化学技术有限公司。其余化学试剂均购自国药集团化学试剂有限公司。
1.2 土壤宏基因组DNA提取及测序
土壤样品按Fast DNA Spin Kit for Soil试剂盒(MP Biomedicals,USA) 提取土壤基因组DNA,交于上海派森诺生物科技股份有限公司用Hiseq 2000 (Illumina Inc,USA) 进行高通量测序。得到3.3 Gb的棉花地土壤宏基因组数据,由ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)及blastx(http://blast.ncbi.nlm.nih.gov/Blast.cgi) 分析获得21个ω-TAs基因全长序列 (具体数据作为附件,包括附表1和2,附图1和2,可在网络版中下载。见附表1)。
1.3 ω-TAs的克隆和表达
设计含双酶切位点的21个候选ω-TAs基因的引物序列 (见附件附表2),由上海捷瑞生物工程有限公司合成。使用南京诺唯赞生物科技有限公司的2×TaqMaster Mix进行PCR扩增,循环条件为:95 ℃预变性3 min;35个循环 (95 ℃变性15 s;60 ℃退火15 s;72 ℃延伸1.5 min);最终72 ℃延伸5 min,4 ℃孵育。将扩增成功的产物使用FavorPrep™ GEL/PCR purification kit(Favorgen,Taiwan) 进行DNA凝胶回收。
用FastDigest系列BamHⅠ、HindⅢ、EcoRⅠ和XhoⅠ(Thermo,USA) 将PCR产物和pET-28a (+) 质粒载体 (Merck,Germany) 酶切后使用Ligation high(TOYOBO,Janpan) 进行连接。重组质粒被转化到大肠杆菌Escherichia coliDH5α后通过菌落PCR及测序进行鉴定,鉴定成功后转入E.coliBL21(DE3)表达宿主中。E.coliDH5α和E.coliBL21 (DE3) 购自天根生化科技 (北京) 有限公司。
鉴定成功的单克隆接种到含50 μg/mL卡那霉素的LB培养基试管,在37 ℃、200 r/min摇床中过夜培养。按1%接种到含卡那霉素的LB培养基中,在37 ℃、200 r/min摇床中培养。当OD600达到0.6–0.8时,加入0.1 mmol/L IPTG,在20 ℃、200 r/min条件下诱导表达。收集菌体经2次洗涤后在100 mmol/L Tris-HCl缓冲液 (pH 8.0) 中超声破碎,在4 ℃、8 000×g条件下离心15 min收集得到上清。上清及沉淀重悬液用SDS-PAGE分析蛋白表达状况。
1.4 ω-TAs的活性筛选
按照Green AP的显色方法[28]在白色96孔微孔板 (Nucn,Denmark) 建立了200 μL反应体系,每个反应混合液中包含30 mmol/L邻亚二甲苯二胺二盐酸盐、20 mmol/L目标底物、0.1 mmol/L辅酶PLP及80 μL粗酶液,用100 mmol/L Tris-HCl(pH 8.0) 补足到200 μL。设置无酶和无底物对照,两个复孔。在微孔板振荡器 (杭州奥盛) 中37 ℃、500 r/min进行反应。反应持续到15 min和16 h后分别观察颜色变化及拍照。
1.5 ω-TAs的底物转化率测定
为了筛选能兼容IPA供体并对两种目标底物高转化率的ω-TAs,建立了1 mL反应体系。反应液包括30 mmol/L IPA、20 mmol/L目标底物、0.1 mmol/L辅酶PLP及 400 μL粗酶液,用100 mmol/L Tris-HCl (pH 8.0) 补足到1 mL。反应在37 ℃、200 r/min摇床中进行。反应持续16 h的产物用乙酸乙酯萃取后进行HPLC分析。HPLC分析条件为:Zorbax XDB-C18色谱柱 (Agilent,USA);流动相PBS︰MeOH=70︰30;流速0.8 mL/min;柱温37 ℃;检测波长210 nm。用不含酶对照的目标底物吸收峰面积为100%,用目标底物的峰面积除以对照体系的峰面积计算底物的转化率。
1.6 ATA-W12的酶学性质测定
采用常州天地人和生物科技有限公司的镍柱试剂盒对ATA-W12转氨酶进行纯化,用SDS-PAGE进行蛋白鉴定及Bradford法进行蛋白定量。
按照Schätzle等报道的酶动力学分析法[29],在紫外96孔酶标板中建立了200 μL反应体系,用SPECTRAMAX190酶标仪 (Molecular Devices,USA) 在波长245 nm下进行测定。反应液中包含2.5 mmol/L 1-PEA、2.5 mmol/L丙酮酸、0.25%二甲基亚砜及0.392 μg ATA-W12蛋白,用对应的反应缓冲液补足200 μL。
为了测定最适pH值我们配制了不同pH的缓冲液,包括100 mmol/L PBS的pH值调为6.0、7.0;100 mmol/L Tris-HCl的pH值调为8.0、8.5、9.0;100 mmol/L甘氨酸-氢氧化钠溶液pH值调为9.2、10.0、10.5。最适pH测定在37 ℃,5 min反应测定吸收值,以最高吸收值为100%计算相对酶活力。
为了测定ATA-W12的最适温度,我们使用最适pH的缓冲液,加入如上反应体系。在4 ℃、20 ℃、30 ℃、40 ℃、50 ℃、60 ℃、65 ℃及70 ℃下反应5 min后测定,以最高吸收值为100%计算相对酶活力。
为了测试ATA-W12热稳定性,将8台加热制冷金属浴(杭州博日)设置温度为4 ℃、10 ℃、20 ℃、30 ℃、40 ℃、50 ℃、60 ℃和70 ℃预热,然后将ATA-W12稀释后保温,分别在0.5、1、3、12、24、43、68、168 h时间点采样检测,反应缓冲液采用最适pH的缓冲液,40 ℃、5 min反应后测定吸收值,以−20 ℃保存的ATA-W12作为对照为100%酶活计算相对酶活。以上所有实验均以不加酶的反应体系作为空白扣除吸收值,设置3个重复。
1.7 1-Boc-3-氨基哌啶的50 mL放大规模制备
采用50 mL放大规模制备(S)-(+)-1-Boc-3-氨基哌啶,反应体系包括5 g ATA-W12湿菌体、500 mmol/L 1-Boc-3-哌啶酮、1.5 mol/L酸化IPA、2 mL二甲基亚砜、0.2 mmol/L PLP和100 mmol/L Tris-HCl (pH 8.5)。
反应在100 mL反应瓶中进行,利用2 mol/L IPA水溶液流加控制pH值为8.5,温度控制在40 ℃,搅拌速度为300 r/min。每小时取3个重复样检测反应进程,通过HPLC分析检测。转化率测定采用ZORBAX Extend C18 (4.6 mm×250 mm×5 μm),流动相为28%乙腈︰72% TFA溶液 (0.1%),流速为0.8 mL/min,柱温37 ℃,进样量5 μL,210 nm紫外检测。转化率通过产物摩尔量除以添加底物摩尔量的比率来计算。取反应后溶液100 μL加入500 μL的乙酸乙酯萃取2次,加入无水硫酸钠干燥过夜,溶于异丙醇后用HPLC测ee值。ee值测定采用Chiralcel AD-H,流动相为90%的正己烷︰10%的乙醇,流速为1 mL/min,柱温30 ℃,进样量5 μL,210 nm紫外检测。反应结束后用等体积的乙酸乙酯萃取3次,合并萃取相,12 000 r/min离心10 min后取有机相,旋转蒸发得到(S)-(+)-1-Boc-3-氨基哌啶。
2 结果与讨论
2.1 目标底物的选择
手性3-氨基哌啶及3-氨基吡咯烷是一种重要手性胺医药中间体,广泛用于原料药的合成,如妥舒沙星、克林沙星、头孢霉菌素衍生物等,还作为治疗肥胖、Ⅰ型和Ⅱ型糖尿病、抗抑郁和精神分裂的原料药的重要分子砌块。但化学法合成路线复杂,拆分及氨基保护试剂成本太高,手性胺产物的光学活性差[30]。近10年来科学家一直在尝试使用ω-TAs进行动力学拆分及不对称合成来生产这两种医药中间体,但限于ω-TAs性能都面临着底物水平低、转化率低及反应时间过长等问题难以适应工业用途[27,30-33]。所以针对这两种手性胺医药中间体的生产筛选一种适应于工业用途的ω-转氨酶非常具有研究价值和应用前景。
另外Höhne等[30]发现使用ω-TAs合成这两种医药中间体时,采用Boc或Cbz保护杂环氮能有效地提高ω-TAs的反应转化率和ee值,所以本研究选择1-Boc-3-哌啶酮和1-Boc-3-吡咯烷酮作为这两种手性胺合成的目标底物。
2.2 序列来源的选择
目前报道的野生转氨酶很少能适应工业应用,这可能由于序列来源的工业导向性差。我们进行此研究时采集了深海污泥、棉花地土壤、酒厂窖泥及贵州红壤4种环境样品。对比这4种土壤来源,棉花地土壤长期以尿素及动物粪便肥料为主,其中含有丰富的氨类化合物及耐受高氨浓度的细菌菌群,选择其宏基因组作为挖掘耐高氨浓度、适应工业应用的ω-TAs的最佳来源。我们对棉花地土壤基因组DNA进行了提取并进行了高通量测序,并获得了21个ω-TAs基因全长序列(见附表1)。
2.3 ω-转氨酶克隆筛选
从土壤宏基因组高通量测序所得到的ω-TAs基因的丰度和在工程菌中克隆表达情况有很大差异,所以我们设计了21个ω-TAs候选基因的引物(见附表2),对这些基因进行克隆筛选。
最终我们从21个候选ω-TAs基因中成功扩增了11个ω-TAs基因。接着将这11个基因克隆到pET-28a(+)载体上进行菌落PCR并将构建的质粒测序进行确认 (图1),图1酶的标号省略ATA-。结果显示,6种ω-TAs 包括ATA-W5、7、8、11、12及19被成功克隆。对这6种ω-TAs进行了表达,制备了6种粗酶液 (菌体裂解液上清),并用粗酶液 (图2中a系列) 和沉淀 (图2中b系列)分析了表达状况,图2酶编号省略ATA-W。
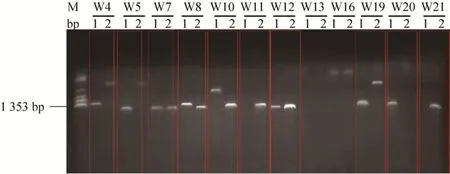
图1 菌落PCR和测序确认6种ω-TAs成功克隆Fig.1 Six of ω-TAs were successfully cloned and confirmed by colony PCR and sequencing.

图2 SDS-PAGE鉴定ω-转氨酶表达Fig.2 Identification of ω-TAs by SDS-PAGE.a:clarified cell lysates b:insoluble fraction.
ATA-W11、19两种蛋白以包涵体形式表达较多,而ATA-W5、7、8、12这4种ω-TAs主要为可溶性表达。虽然有两种在上清中表达较少,为了对其上清酶活进行确认,也对其进行了酶活筛选实验,进一步验证6种粗酶液酶活性情况。
2.4 酶活力初步筛选
为了筛选对两种目标底物有活性的酶,我们采用Green等报道的显色方法[28]针对6种新酶粗酶液和13种ω-TAs原酶库粗酶液进行了酶活筛选,结果如图3所示。

图3 19种ω-TAs粗酶液的酶活筛选Fig.3 Activity screening of 19 ω-TAs’ clarified cell lysates.
图3中1–3列含20 mmol/L 1-Boc-3-吡咯烷酮,4–6列含20 mmol/L 1-Boc-3-哌啶酮,每列含两个复孔。A行为无酶的对照组;含ATA-W5的B1/B2和含PSGA的B4/B5 作为无底物空白对照。C-H1/4分别包含ATA-W5、7、8、11、12、19共6种来自于宏基因组挖掘的新型ω-TAs。C-H2/5和C-H3/6分别为ATA-2、6、8、9、PSGA、BPSTM和ATA-12、13、14、15、16、17、18,共计13种为本研究组ω-TAs原酶库。
反应进行15 min后,含7种原酶库ω-TAs孔出现了不同程度颜色加深,包括PSGA、ATA-2、8、9、13、15、18,说明反应速度快。但由于B4/B5含PSGA的无底物对照颜色也变深,故无法说明颜色加深是否由于底物转化造成。反应经过16 h之后,除以上含7种酶的孔形成明显黑色沉淀外,含另外4种酶的孔,包括ATA-W12和ATA-12、14、17也形成了黑色沉淀,说明这4种酶反应速率慢,但也具有较高的活性。
因含PSGA酶的无底物对照组有不依赖目标底物反应的假阳性,因96孔板通量问题,原反应只对ATA-W5和PSGA做了对照。为了进一步确认,我们对经过16 h反应能形成黑色沉淀的11种酶重新进行测定,如图4所示,2/5列为含1-Boc-3-吡咯烷酮的反应,3/6列为含1-Boc-3-哌啶酮的反应,f5/6均为不含酶的对照。1/4为含酶不含底物的空白组。
经16 h反应后,含11种酶实验组及对照组出现了黑色沉淀 (图4)。图4中不含酶空白组均未出现黑色沉淀,说明了这种假阳性的产生不是Green等所推测的由PLP造成的,可能是由于其推测的粗酶液本身含有天然酮类底物如丙酮酸产生的非特异反应。

图4 确认粗酶液中酮类及PLP杂质的影响Fig.4 Confirming the influence of impurity ketone or PLP in the clarified cell lysates.
Green等报道的显色筛选法[28]一直被作为一种正向筛选法来高通量筛选ω-TAs,但是实验结果说明,可能由于粗酶液中太多丙酮酸等酮类杂质造成该方法并不适合粗酶液的正向筛选。无论如何,黑色沉淀的形成说明ω-TAs一定具有很高的酶活力。所以该方法可作为一种“负向筛选法”来排除低活性的酶进行酶活力初筛。通过这种“负向”酶活初筛,我们筛选出共11种具有较高活性的ω-TAs,包括原酶ATA-2、8、9、12、13、14、15、17、18、PSGA和宏基因组挖掘的新酶ATA-W12。
2.5 兼容IPA的转化率筛选
为了进一步确认这11种ω-TAs对IPA的兼容性及底物转化能力,以30 mmol/L IPA和20 mmol/L目标底物 (1-Boc-3-哌啶酮及吡咯烷酮) 建立了1 mL密闭反应,经过37 ℃、16 h反应后用HPLC法检测底物转化率。
图5显示了这种筛选的结果,除了ATA-12对1-Boc-3哌啶酮的反应非常低之外,其他所有酶对两种底物都在IPA供体下具有不同的转化率。转化率超过50%的是ATA-2、9和ATA-W12。转化率筛选结果和显色对比让我们感到意外的是,ATA-2、9在显色筛选法中仅15 min就发生了颜色变化,说明酶的反应速度很快;而ATA-W12反应很慢,16 h反应后却比ATA-2、9转化率高。这可能是由于ATA-W12比ATA-2、9在37 ℃下的热稳定性更高,一直在反应中维持更高的活性。也说明了显色筛选法只能作为一种不依赖于底物的初筛方法,为IPA供体下转化率筛选法降低工作量。
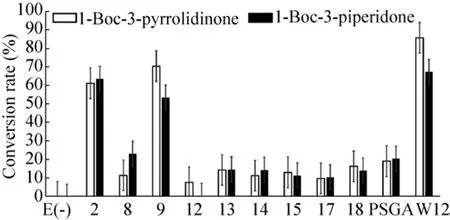
图5 兼容IPA的ω-TAs转化率筛选Fig.5 Conversion screening of ω-TAs with IPA.
分析以ATA-2、9和ATA-W12三种ω-TAs的反应产物测定的HPLC图谱 (见附图1),ATA-W 12处于25.663 min产物峰的信号是最强的。再者为了真实体现11种ω-TAs在不采取副产物移除的情况下对兼容IPA下底物转化效率,我们进行此1 mL反应时采取了密闭管反应体系。即使在这种密闭反应体系下,ATA-W12 可以转化67.42%的1-Boc-3-哌啶酮和85.84%的1-Boc-3-吡咯烷酮,这有利于减压或微加热去除副产物丙酮改变转氨反应平衡的策略实施。
2.6 ATA-W12的酶学筛选
根据宏基因组测序数据可知ATA-W12是一种来源于Caulobactersp.UNC358 MF Tsu5.1的转氨酶,用Pfam蛋白家族数据库分析可知属于Ⅲ类TAs。目前为止,在野生转氨酶[5]中,来源于Caulobactersp.的ω-TAs尚未见研究报道,所以我们对ATA-W12进行了酶学性质研究。
如图6所示,泳道1为纯化的ATA-W12,分子量大约55 kDa左右,110 kDa左右较淡条带为酶的二聚体形式;泳道2和3分别为菌体破碎液的沉淀部分及上清部分,说明了ATA-W12为可溶性表达。

图6 ATA-W12的表达及纯化Fig.6 Overexpression and purification of ATA-W12.Lane 1:purified ATA-W12 and its dimer;lane 2:precipitation fraction;lane 3:supernatant fraction.
为了得到ATA-W12的适宜反应条件,我们测定了ATA-W12ω-转氨酶的最适pH值、最适温度和温度依赖的热稳定性,结果见图7。
图7A显示了ATA-W12最适pH值为8.5,符合了用IPA为供体时理想指标 (pH值大于7.0)。在pH 8.5的碱性环境下,氨基供体和手性胺产物的氨基被质子化,从而减少减压或加热原位蒸馏时氨基供体和手性胺产物的损失。同时可以看出即使pH达到9.0,该酶依然保持90%左右的活性,pH 8.5–9.0的高活性范围使得工业生产控制过程更为简便。
图7B显示了ATA-W12最适温度为50 ℃,且在40 ℃时仍有96%以上的酶活力,这种40–50 ℃的范围也符合IPA供体原位蒸馏最佳范围40–60 ℃之间。这种范围既能实现有效产物移除,又能避免底物和目标产物的蒸馏损失。
图7C显示了ATA-W12温度依赖的稳定性,我们发现ATA-W12在40 ℃和50 ℃孵育12 h之内酶活力依然保持在96%以上。所以当反应能控制在12 h内完成时,该酶有40–50 ℃的温控范围,降低了工业生产对温度控制设备的要求。但是在12 h以上时,50 ℃孵育的酶活力逐渐下降,而40 ℃孵育168 h后依然保持,所以结合最适温度和热稳定性,ATA-W12的最适温度控制在40 ℃较为合适。出乎意料的是,40 ℃孵育的酶活力与4–30 ℃之间孵育相比,随着孵育时间的延长酶的活力反而缓缓上升,推测可能40 ℃情况下能让该酶保持高活性构象状态。

图7 1-PEA快速分析法鉴定ATA-W12酶学性质Fig.7 Characterization of the ATA-W12 by a rapid assay using 1-PEA.
综合以上三者的ATA-W12的酶学筛选结果,可得出ATA-W12在pH 8.5和温度40 ℃条件下进行手性胺中间体放大合成的优选适宜反应条件。pH值范围在8.5–9之间,若反应在12 h之内完成,温度可在40–50 ℃之间进行调整。
2.7 ATA-W12的工业潜力验证
为了验证新型转氨酶-ATA-W12工业适应的潜力,我们采用酶学筛选确立的ATA-W12的初步反应条件实现(S)-(+)-1-Boc-3-氨基哌啶的50 mL实验室规模放大测试。为了方便制备,采用5 g未破碎ATA-W12湿菌体,因在pH 8.5、40 ℃及搅拌速度300 r/min的反应条件下,ATA-W12很容易从湿菌体中裂解释放实现催化。添加4%的二甲基亚砜,使得500 mmol/L 1-Boc-3-哌啶酮容易溶解且对ATA-W12酶活抑制影响不大。采用3倍底物浓度的IPA供体,过量底物浓度使得反应利于向产物生成方向进行。因起始反应速度快造成pH下降,采用2 mol/L异丙胺水溶液供体流加调节pH为8.5。经过8 h反应后,用HPLC法不能检测到反应底物,500 mmol/L 1-Boc-3氨基哌啶酮几乎100%转化为 (S)-(+)-1-Boc-3-氨基哌啶,产物纯化后测试ee值>99.95% (见附图2),该项成果2016年申请了中国发明专利,并于2019年获得发明授权[34]。
3 结论与展望
Green等[28]建立的ω-TAs高通量筛选法是基于易脱氨供体邻亚二甲苯二胺,可广泛接受各类ω-TAs和酮类底物,因其方法的简便性及通用性得到广泛应用。本研究发现该方法在粗酶液筛选中易产生不依赖于目标底物的假阳性,但可以作为一种酶活初筛方法。Schatzle等[29]建立的ω-TAs快速动力分析法是基于另一种易脱氨供体1-PEA的方法,可以快速地对ω-TAs的热稳定性及反应条件进行初步筛选。虽然理想工业用氨基供体IPA可以采用传统的HPLC及转化率的筛选,但是因费时费力不太适合高通量筛选。本研究组合了基于3种供体的筛选方法建立了一套有效的“ω-转氨酶的工业适应性选择”流程。发展以生物传感器或显色法检测丙酮副产物,来建立“基于IPA供体的ω-转氨酶高通量筛选方法“是一个值得继续研究的课题。
Gundersen等[32]以25 mL实验规模,采用Ars-ωTA转氨酶和IPA氨基供体经过96 h反应得到50 g/L的(S)-(+)-1-Boc-3-氨基哌啶,转化率为91%。而本研究发现的ATA-W12采用酶学筛选的初步反应条件和1.5 mol/L的IPA供体,8 h后几乎完全转化500 mmol/L 1-Boc-3-哌啶酮生成100 g/L的(S)-(+)-1-Boc-3-氨基哌啶,生产效率大大提高。这可能主要源于ATA-W12具有耐高浓度IPA和高热稳定性的优良特性。对ATA-W12的转氨过程进行优化,提高生产效率值得进一步研究。
总之,本研究发现的ATA-W12是为数不多的具有工业应用“天赋”的野生新型ω-转氨酶,通过该酶的底物谱研究,可以实现其他S-型医药中间体的生产。另外也可作为“人工进化”改造的优良起始酶种,通过拓展底物谱改造可实现更多医药中间体生产,在制药工业中具有广阔应用前景。

