外泌体:病毒与宿主博弈的另一“角斗场”
朱依凡,于少雄,仇华吉,王翀
1 华南农业大学 动物科学学院 国家生猪种业工程技术研究中心 广东省农业动物基因组学与分子育种重点实验室,广东 广州 510642
2 中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069
外泌体是一类绝大多数细胞皆可分泌的小型细胞外囊泡[1]。20世纪90年代,美国华盛顿大学的研究团队和加拿大麦吉尔大学的研究团队相继发现,在哺乳动物细胞的胞外环境中存在囊泡[2-3]。二十多年后,匈牙利科学家György将所有在细胞外部且具有脂质双层膜封闭结构的物质定义为“细胞外囊泡 (Extracellular vesicles,EVs)”[4]。EVs有两种不同的亚型,它们的形成途径和直径大小有所不同[5]。一种是由质膜向外挤压出芽产生的微囊泡(Microvesicles,MVs),其直径范围在100–1 000 nm[6];另一种是在1987年被Johnstone正式命名为“外泌体 (Exosomes)”,其直径为40–150 nm[7]。外泌体的形成涉及多泡体(Multivesicular bodies,MVBs) 与质膜的融合 (图1)。最初细胞内体向内凹陷形成腔内囊泡 (Intralumenal vesicles,ILVs),ILVs接着聚集成为MVBs,最终MVBs与质膜融合通过胞吐作用将ILVs释放到细胞外空间,这些被释放的囊泡即为外泌体[8-9]。
起初外泌体被发现时并未引起人们的重视,它仅仅被看作细胞垃圾的“搬运工”[2-3]。然而在过去的几十年里,随着研究的深入,隐藏在外泌体背后的重要功能被逐步揭开。由于具有脂质双层膜结构,外泌体被细胞释放后能够稳定存在于细胞外环境中,并且可以包裹蛋白质、脂质、核酸等生物活性分子,跟随体液循环到达机体各处。外泌体是发挥信息传递的重要载体[10-12]。
病毒是严格的细胞内寄生物,必须在细胞内才能完成复制周期从而产生新的感染性病毒粒子。病毒复制周期指病毒入侵宿主细胞在其内部完成增殖的全过程,主要涵盖病毒的入侵、病毒蛋白的翻译合成、基因组的复制、病毒粒子的组装和释放。病毒粒子的组装以及ILVs分选进入MVBs都需要胞内囊泡的参与,此后新合成的病毒粒子和MVBs可以通过胞吐作用释放至细胞外(图1)。这些共用胞内囊泡的方式,为病毒“挟持”外泌体提供了可能性。早在2003年就有学者提出,逆转录病毒可以利用外泌体形成与分泌的既有途径合成新的感染性病毒粒子[13];2013年发表在Nature上的一项研究报道显示,甲型肝炎病毒(Hepatitis A virus,HAV) 本身不具有囊膜结构,但它可以在复制时通过类似途径合成具有膜结构的病毒颗粒——“有囊膜的HAV”(Enveloped HAV,eHAV)[14]。以上研究表明,外泌体参与病毒的复制过程。

图1 病毒复制与外泌体产生 (改编自参考文献[8-9,15])Fig.1 The virus life cycle and formation of exosomes (adapted from references [8-9,15]).ER:endoplasmic reticulum;ILVs:intralumenal vesicles;MVBs:multivesicular bodies.
病毒在宿主细胞内建立有效感染,产生新的子代颗粒。与此同时,宿主细胞被病毒感染后,固有的稳态被打破,外泌体遭病毒“挟持”。只有重新控制外泌体并将病毒清除,宿主细胞才能恢复至正常的生理状态。在这场双方的博弈中,病毒是如何通过“挟持”宿主外泌体传播感染?而宿主又是如何利用外泌体抵抗病毒感染?本文将讨论病毒操纵外泌体与宿主抗病毒机制斗争的动态过程。
1 病毒“挟持”外泌体
与正常细胞的外泌体相比,由病毒感染的细胞释放出的外泌体包含许多宿主不具备的病毒成分,包括病毒的蛋白质、基因组及其他遗传物质。例如由人类免疫缺陷病毒 (Human immunodeficiency virus,HIV) 感染的细胞释放的外泌体中包含病毒Nef和Tat蛋白[16-17]。在Ⅰ型单纯疱疹病毒 (Herpes simplex virus 1,HSV-1) 感染的细胞中也存在类似的现象,被HSV-1感染的细胞释放的外泌体装载着病毒gB糖蛋白与人白细胞抗原DR (Human leukocyte antigen DR,HLA-DR) 复合物[18]。又如细胞被丙型肝炎病毒(Hepatitis C virus,HCV) 感染后,会分泌包裹病毒胞膜蛋白E1和E2、病毒RNA及病毒IgG的外泌体[19-21]。除此之外,病毒的其他遗传物质如卡波氏肉瘤相关疱疹病毒 (KS-associated herpesvirus,KSHV) 编码的microRNA也可以富集于感染细胞的外泌体[22]。通过“挟持”外泌体并将自身成分装入其中,病毒可以逃避宿主的免疫应答,促进其在细胞间的传播。
1.1 “逃逸”中和抗体
中和抗体 (Neutralizing antibodies,NAbs) 能够阻断病毒感染,是常用的抗体治疗手段。由于被“挟持”的外泌体能够在一定程度上替代病毒抵抗NAbs的中和作用,从而导致中和抗体保护力不足。例如,经质谱和逆转录PCR技术鉴定分析,口蹄疫病毒 (Foot-and-mouth disease virus,FMDV) 感染的PK-15细胞所分泌的外泌体包含除L、2A和3B外的所有病毒蛋白以及除UTR外的基因组RNA。由于外泌体将大部分的病毒蛋白和病毒基因组从感染细胞运送至其他细胞,所以即使游离的FMDV经过特异性NAbs的处理后不再具有感染性,被FMDV感染的PK-15仍可通过释放外泌体促进FMDV在细胞间的传播[23]。外泌体也在猪繁殖与呼吸综合征病毒 (Porcine reproductive and respiratory syndrome virus,PRRSV) 逃逸宿主免疫反应的过程中发挥重要的功能。在PRRSV感染的PK-15CD163细胞产生的外泌体中,同样存在M、N及GP5这3个病毒结构蛋白以及病毒的基因组RNA,并且感染细胞的外泌体可介导PRRSV在未感染的易感细胞甚至非易感细胞中的感染,同样这种传递方式不被NAbs阻断[24]。此外,E2蛋白是HCV的重要囊膜糖蛋白,在其入侵及复制过程中发挥核心作用。E2蛋白的特异性抗体可以阻断游离HCV粒子的感染,但不影响含有病毒基因组RNA的外泌体介导HCV在细胞间的感染;与之相对应的是,E2蛋白包被的外泌体与HCV在细胞内平行组装、被释放至胞外,E2包被的外泌体可隔离NAbs对HCV的中和作用,使HCV保持感染性[25-26]。
1.2 传递免疫抑制因子
病毒“挟持”外泌体后通过多种方式抑制宿主的免疫应答反应。被“挟持”的外泌体可以抑制宿主细胞抗病毒基因的表达。分离被新城疫病毒(Newcastle disease virus,NDV) 感染的细胞所分泌的外泌体,并将其与未感染细胞共孵育,导致未感染细胞中的白介素1β (Interleukin 1β,IL-1β)、肿瘤坏死因子α (Tumor necrosis factor α,TNF-α)、干扰素β (Interferon β,IFN-β) 等抗病毒细胞因子的mRNA水平显著下降[27]。当B细胞被爱泼斯坦-巴尔病毒 (Epstein-Barr virus,EBV) 感染,其释放的外泌体包裹着病毒的miR-BART15,被未感染细胞内化后,miR-BART15靶向结合核苷酸结合寡聚化结构域样受体蛋白3 (NLR family pyrin domain containing 3,NLRP3) mRNA的区,抑制NLRP3的转录和翻译。由于NLRP3炎性小体的减少,宿主的抗病毒活性也随之降低[1,28]。此外,为削弱宿主的免疫防御,病毒凭借“挟持”的外泌体诱导宿主免疫细胞发生大量凋亡。如装载埃博拉病毒(Ebola virus,EBOV) VP40蛋白的外泌体进入免疫细胞后,通过下调细胞中RNA诱导沉默复合体(RNA-induced silencing complex,RISC) 的Dicer、Drosha、Ago 1等蛋白的表达,解除miRNA对基因的沉默作用,诱导单核细胞、巨噬细胞和T细胞凋亡[29-30]。与之类似的是,HIV的Nef蛋白能够刺激T细胞分泌外泌体诱导旁观者T细胞凋亡。因此,除了病毒对感染细胞直接的细胞毒性作用外,外泌体引发的未感染的旁观者T细胞凋亡也可能是T细胞耗竭的原因之一[31]。
2 宿主利用外泌体抵抗病毒感染
尽管外泌体介导的病毒成分转移可能有利于传播病毒感染,但是宿主也可凭借外泌体的运输作用激发细胞建立抗病毒状态。
2.1 诱导抗病毒因子的表达
病毒核酸通常会触发感染细胞的先天免疫反应,而包裹病毒核酸的外泌体可在受体细胞中发挥相同的作用。HCV能够在HCV亚基因组复制子(Subgenomic replicon,SGR) 细胞中复制但不产生具有感染性的病毒粒子。HCV SGR细胞被HCV感染后,分泌的外泌体携带病毒RNA成分并将其传递至未感染的浆细胞样树突状细胞 (pDC),激活pDC且诱导其表达干扰素α (Interferon α,IFN-α),从而产生抗病毒反应[20]。呼吸道合胞病毒(Respiratory syncytial virus,RSV) 感染的细胞分泌的外泌体含有病毒RNA,载有RSV核酸的外泌体诱导人单核细胞和气管上皮细胞释放TNF-α、RANTES等细胞因子和趋化因子,激活细胞的先天免疫应答[32]。
2.2 递送抗病毒因子
作为抵抗病毒感染的主要宿主防御系统,干扰素家族可诱导抗病毒基因的表达,启动有效的抗病毒反应[33]。外泌体包裹干扰素刺激基因(Interferon-stimulated genes,ISGs) 在细胞间传播,增强细胞的抗病毒反应。
干扰素诱导的跨膜蛋白3 (IFN inducible transmembrane protein 3,IFIM3) 是重要的抗病毒因子,能够在病毒感染的早期抑制病毒侵入细胞[34]。细胞被登革热病毒 (Dengue virus,DENV)感染后,胞内干扰素表达量增加,促进下游的IFIM3高表达来抵御病毒侵入。同时,细胞将IFIM3装载进外泌体并释放至胞外。外泌体在细胞间运输IFITM3,将其从被DENV感染的细胞递送至未感染的细胞,赋予未感染细胞同等的抵抗DENV侵入的能力[35]。
此外,IFN-α可诱导HepG2.2.15细胞表达人胞苷脱氨酶 (APOBEC3G,A3G) 抵抗乙型肝炎病毒(Hepatitis B virus,HBV) 的感染[36]。通过荧光标记试验发现,在IFN-α的刺激下,肝非实质细胞能够通过释放外泌体,将A3G递送至被感染的肝实质细胞,恢复肝实质细胞的抗病毒能力[37]。A3G还是细胞固有免疫系统针对HIV-1和其他逆转录病毒的关键抗病毒蛋白。载有A3G的外泌体进入被HIV-1感染的细胞,可抑制HIV-1的反转录及病毒蛋白的合成,阻止HIV-1复制[38]。来自健康男性的精液外泌体被受体细胞内化后,释放其内包裹的抗病毒因子APOBEC3来抑制HIV-1的RNA逆转录,阻碍其复制[39]。
2.3 抑制病毒传播
外泌体通过阻碍病毒对宿主细胞的入侵来抑制病毒感染。阴道上皮细胞是HIV在性传播途径中最早接触的细胞,HIV-1能够通过胞吞作用进入其中,而精液来源的外泌体可引发这一过程的阻滞,进而降低HIV-1从阴道上皮细胞向靶细胞传播的效率[40-41]。HIV还可通过结合细胞表面的受体进行入侵。树突状细胞特异性细胞间粘附分子3-结合非整合素 (Dendritic cell specific intercellularadhesion-molecule-3 grabbing nonintegrin,DCSIGN) 是树突状细胞重要的模式识别受体,可以与HIV-1结合,而来自健康女性乳汁的外泌体表面带有DC-SIGN的配体——可溶性粘蛋白1(MUC1),因此乳汁外泌体能够在单核细胞来源的树突状细胞 (Monocyte-derived dendritic cells,MDDC) 上与HIV-1竞争性结合DC-SIGN受体,从而抑制HIV-1的复制并减少病毒向CD4+T细胞的传播[42]。
3 总结与展望
外泌体是宿主重要的物质及信息传递工具,它本身是中立的存在,其内容物的包裹取决于它的供体细胞,而在它的受体细胞上则体现内容物的功能。当病毒感染宿主时,外泌体的功能表现出两面性 (表1)。一方面,外泌体由于病毒的“挟持”而协助病毒逃逸中和抗体及抑制宿主的免疫应答。另一方面,外泌体也辅助宿主诱导产生和传递抗病毒因子,建立抗病毒的防御机制。外泌体功能的两面性是病毒与宿主博弈的结果,但目前尚不明确病毒或宿主对外泌体控制权的具体因素,可能与病毒的感染时期、病毒的感染水平以及外泌体靶细胞的特性等有关。此外,病毒感染会引起宿主外泌体内容物的改变,最明显的差异在于外泌体内出现了外源性的病毒成分,既有病毒基因组,也有病毒蛋白。不同的病毒其遗传物质、形态结构、种属特征迥异,外泌体对病毒成分的包裹是否具有倾向性还有待探讨。

表1 外泌体在病毒感染和免疫应答中的作用Table 1 Various functions of exosomes in viral infections and immune responses
近年来研究外泌体的热潮只增不减。然而迄今为止,有关外泌体调控病毒感染宿主细胞的机制研究占比较少,主要原因在于学者们面临如何高效、便捷地将外泌体与病毒粒子分离开来并同时保留外泌体生物活性的技术瓶颈。由于病毒与外泌体的大小相近,通过超速离心法、聚合物沉降法、凝胶排阻法等分离未感染细胞的外泌体(后简称“未感染外泌体”) 的方法来分离感染细胞的外泌体 (后简称“感染外泌体”),得到的产物往往是外泌体与病毒粒子掺杂在一起的混合物[43-44]。现已证明,联合使用密度梯度离心或免疫磁珠吸附的方法可以从混合物中纯化出感染外泌体(表2)。密度梯度离心法的使用成本较低,但存在耗时久、介质洗脱困难等问题;而免疫磁珠由外泌体标记蛋白(CD63或CD81)的抗体包被,可以特异性吸附外泌体,因此通过该法获得的外泌体的纯度高,然而也存在抗体对于不同物种来源的外泌体可能不通用以及磁珠处理通量小等问题[44]。外泌体的纯化方法有待进一步优化。目前,建立病毒感染细胞模型的技术已经十分成熟,纯化外泌体有助于建立内化感染外泌体的细胞模型,以便开展病毒感染宿主细胞的机制研究,为探索阻断病毒感染的防控机制奠定理论基础。
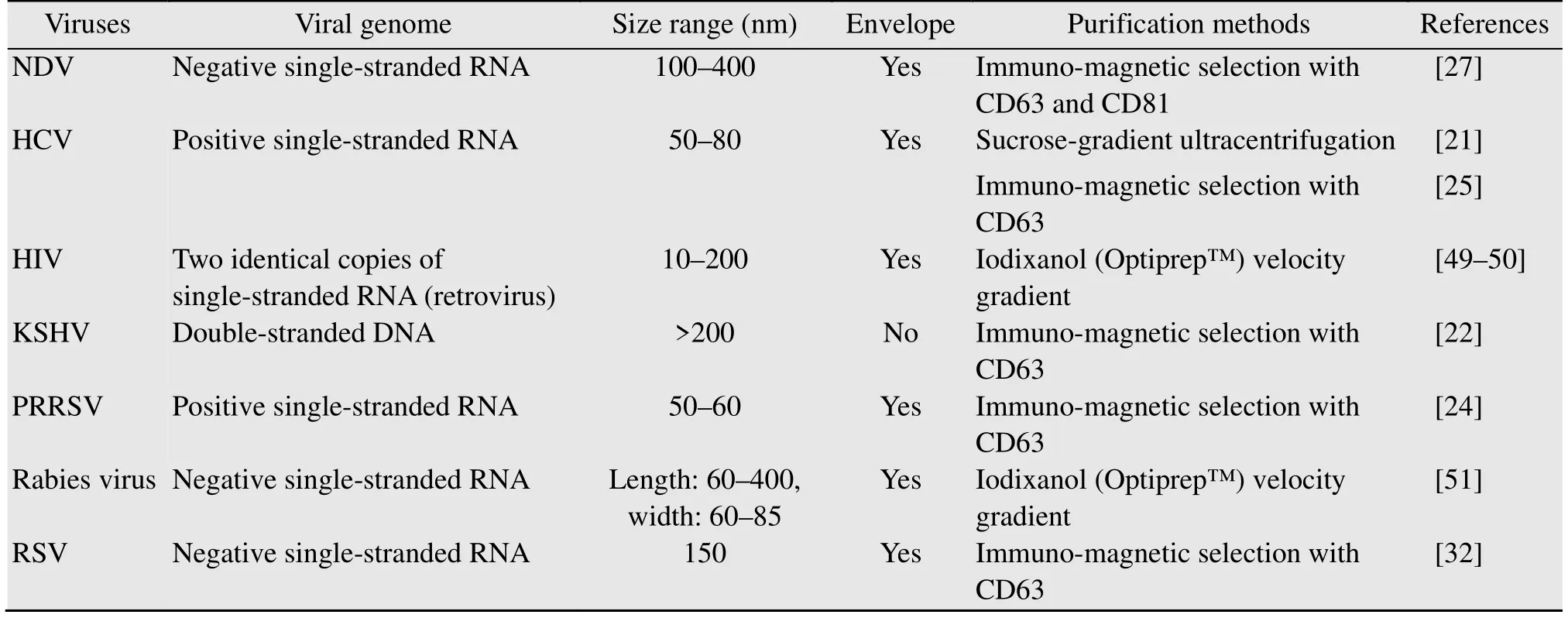
表2 不同病毒感染细胞外泌体的纯化方法Table 2 Methods for purifying exosomes released from virus-infected cells
病毒感染细胞引起细胞内核酸、蛋白质等生物活性分子的表达发生变化。外泌体包裹这些分子释放至胞外,被未感染细胞内化后释放包裹的分子发挥调控作用。外泌体不仅调节病毒感染的致病机制,还影响宿主的抗病毒免疫反应。研究外泌体有助于为抗击病毒感染提供新的思路。
——外泌体与老年慢性疾病相关性的研究进展

