脂肪干细胞来源外泌体携带miR-27抑制白色脂肪的棕色化
钟琼慧,黄波,卢婉,徐颜美,闵清华,李书琪,姜钰环,林晋△,王小中△
肥胖及其相关疾病的发病率逐年上升,成为全球不可忽视的一大问题。白色脂肪组织(white adi⁃pose tissue,WAT)的过度聚集是导致肥胖的直接原因之一[1]。WAT 与棕色脂肪组织(brown adipose tis⁃sue,BAT)是共同存在于哺乳动物体内的2种脂肪组织,前者通常以三酰甘油的形式储存能量,而后者则通过解偶联蛋白1(uncoupling protein 1,UCP 1)介导的非寒战形式产生热量[2]。研究发现,WAT 可以向BAT转换,拮抗肥胖的产生,这种转变称为白色脂肪棕色化,在这过程中过氧化物酶体增殖剂激活受体γ(PPARγ)、含PR结构域的锌指蛋白16(positive reg⁃ulatory domain zinc finger protein 16,PRDM16)及过氧化物酶体增殖子激活受体γ 共激活因子1α(per⁃oxisome proliferators-activated receptor γ coactivator-1α,PGC-1α)是最核心的调控因子[3-4]。外泌体作为一种存在于机体几乎所有微环境中的新兴的功能性物质,能够通过携带蛋白质、信使核糖核酸(messen⁃ger ribonucleic acid,mRNA)、微小核糖核酸(microribonucleic acid,miRNA)等生物活性分子释放到微环境中,充当细胞间信息交流的中介,参与调节多种细胞生物学功能[5]。本研究旨在探讨脂肪干细胞来源的外泌体通过携带高浓度miR-27 抑制白色脂肪棕色化的作用机制,以期为肥胖的研究及治疗提供参考。
1 材料与方法
1.1 材料 SPF级雄性Balb/C小鼠3只,体质量18.6~20.1 g,4周龄,由湖北省动物研究中心提供,用于分离培养脂肪干细胞(ASC);SPF 级雄性C57BL/6 小鼠18 只,体质量14.9~17.6 g,购自江西中医药大学实验动物中心,3周龄,用于构建肥胖模型及后期实验。饲养环境均为温度22~26 ℃,相对湿度50%~60%,人工光照明暗各12 h。人胚肾细胞系293T 细胞株,购自中国科学院细胞库。低糖DMEM培养基(Hyclone公司),Ⅰ型胶原酶(Gibco 公司),多聚赖氨酸(Sigma 公司),流式检测抗体CD34、CD45、CD105、CD133及Sca-1(eBioscience公司),质粒提取试剂盒(OMEGE 公司),T4 DNA 连接酶(TAKARA 公司),内切酶BamHⅠ、内切酶XbaⅠ(NEB 公司),Lipofectamine2000 转染试剂盒(Invitrogen 公司),Western blot 抗 体 UCP1、PPARγ、PRDM16 及 PGC-1α(Bioswamp公司),倒置荧光显微镜(Leica公司),流式细胞仪(艾森公司),实时荧光定量核酸扩增(real-time quantitative polymerase chain reaction,qRT-PCR)仪、水平电泳设备、凝胶成像系统(Bio-Rad公司)。
1.2 方法
1.2.1 脂肪干细胞的分离培养及鉴定 SPF级雄性Balb/C小鼠3只,普通饮食,不经特殊处理,断颈处死小鼠,于75%乙醇中浸泡15 min,无菌条件下分离双侧腹股沟脂肪组织。将收集的脂肪组织剪碎后置于50 mL的离心管内,加入适量的氯霉素,15 min 后用2~3 倍体积的磷酸盐缓冲液(PBS)冲洗3次。1 000 r/min 离心5 min 后弃上清,加入5 倍体积的0.1%胶原酶NB4,将离心管置于37 ℃恒温汽浴摇床内消化2 h,150目无菌网筛滤去未被消化的残余组织。接着1 000 r/min离心5 min 弃上清,细胞沉淀用PBS 洗涤2 次,将收集的细胞用培养液重悬,以1×105个/cm2的密度接种于培养皿内。置于培养箱中培养,每3 d 换液,待细胞生长达到90%融合时,消化传代。收集第3代细胞进行形态、表型的鉴定:倒置相差显微镜下(×40、×100、×200)观察细胞的生长及形态学特点;用流式细胞仪检测细胞CD34、CD45、CD105、CD133 及Sca-1抗原的表达。
1.2.2 外泌体的提取与鉴定 取第3 代ASC 细胞用低糖DMEM 培养液于5%CO2、37 ℃饱和湿度温箱中进行扩增培养,所用胎牛血清在使用前均经110 000×g超高速离心18 h以去除可能存在于血清中的外泌体。收集120 mL细胞培养24 h后的培养液,依照差次梯度超高速离心法提取外泌体[6]。提取的外泌体用PBS溶液重悬后于-80 ℃保存备用。外泌体的鉴定包括透射电子显微镜观察外泌体形态以及Western blot 技术检测外泌体标志蛋白Alix 和TSG101 的表达(重复3次上样)。
1.2.3 过表达miR-27载体的构建 目的基因序列通过基因合成的方法获取,将合成的DNA 片段及载体分别用内切酶BamHⅠ、内切酶XbaⅠ于37 ℃双酶切3 h;双酶切后目的基因片段与载体进行连接,16 ℃连接过夜,待长出菌落,挑取单个菌落,摇菌提取质粒DNA。取对数生长期的293T细胞,以含10%血清的培养基调整细胞密度为1.0×106个/mL,37 ℃、5%CO2培养箱内培养,24 h 待细胞密度达70%~80%时即可用于转染。转染24 h 后更换培养基,48 h 和72 h 分别2 次收集病毒上清,收集后以0.45 μm滤器过滤,上清液加浓缩试剂(慢病毒液体积∶浓缩试剂体积=5∶1)4 ℃孵育过夜。完成孵育后,混合液于50 mL 超速离心管中4 ℃、3 500×g离心25 min。弃去上清,根据收集的慢病毒上清液体积,1/100~1/10体积的PBS重悬病毒沉淀,分装后置于-80 ℃保存备用。
1.2.4 荧光显微镜验证转染效率及qRT-PCR 验证miR-27表达量 慢病毒上清感染293T细胞,分为3组:对照组(不进行感染)、空载体组(加入空载体)及慢病毒过表达组(加入构建的过表达miR-27载体),48 h后在荧光显微镜下观察转染效率,以转染效率最好的病毒液浓度作为最佳的病毒转染滴度,计算病毒滴度=病毒颗粒数/病毒原液量。培养生长良好的ASC 细胞24 h 后,取病毒液以最佳滴度感染ASC,培养48 h后收集培养液,提取获得过表达miR-27的外泌体。提取总RNA,利用qRT-PCR 检测miR-27 的表达量。按表1 序列进行引物构建,反应过程:95 ℃预变性3 min;95 ℃ 5 s,56 ℃ 10 s,72 ℃ 25 s,39个循环;72 ℃延伸7 min。
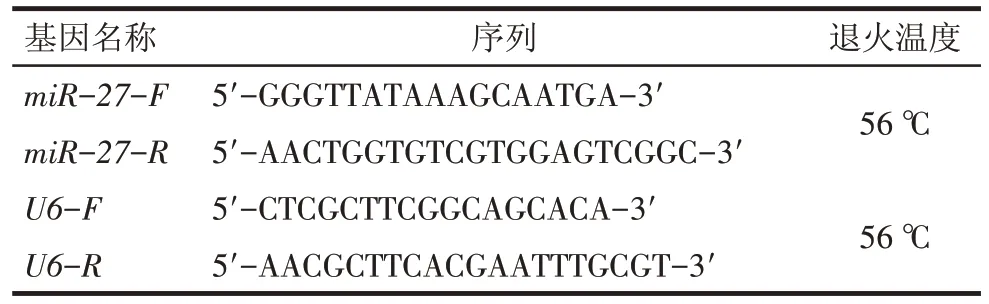
Tab.1 Primer sequences of miR-27 and internal reference U6表1 miR-27及内参U6的引物序列
1.2.5 动物实验 C57BL/6 小鼠18 只在适宜的环境中普通喂食。适应7 d后,每2 d以含45%脂肪饲料喂食。喂养8周构建肥胖小鼠模型,并记录体质量,以肥胖度大于>20%为造模成功[7]。将肥胖小鼠随机均分为3组,每组6只:通过尾静脉分别注射过表达miR-27 ASC 细胞分泌的外泌体(过表达组)、正常ASC 细胞外泌体(正常表达组)及生理盐水(对照组),每2 d注射1次,共12 d;这期间3组继续以高脂肪喂食6 d记录体质量,第7 d开始予以普通喂食,并且每天给予寒冷刺激1 h。第12 天记录体质量后,分离小鼠附睾皮下脂肪组织(即WAT)和肩胛骨脂肪组织(即BAT),检测UCP1、PPARγ、PRDM16、PGC-1α的表达情况。
1.2.6 Western blot 检测UCP1、PPARγ、PRDM16、PGC-1α 的表达 配制12%的分离胶、5%的浓缩胶。每孔上样量为20 μg 蛋白。电泳:80 V 40 min,120 V 50 min,当染料到达胶底部时即终止电泳,260 mA转膜120 min(转膜前将膜在甲醇中浸泡5 min);5%脱脂奶粉室温封闭2 h,一抗室温孵育1 h或4 ℃孵育过夜;洗涤3次,每次5 min。随后根据用量,按照1∶10 000 稀释二抗,与膜室温孵育1 h,洗涤3 次,每次5 min。之后进行ECL化学发光检测,通过TANON GIS软件读取相关条带灰度值。
1.3 统计学方法 采用SPSS 24.0统计学软件分析数据。符合正态分布的计量资料采用均数±标准差()表示,多组间比较采用单因素方差分析和重复测量的方差分析,组间多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 ASC细胞的形态观察与鉴定 ASC刚贴壁的细胞呈圆形,培养24 h后细胞呈长梭形;培养第3代的ASC 的形态,见图1。流式细胞仪检测显示,CD34、CD45、CD133 低表达,阳性率分别为6.43%、6.35%、0.09%;CD105 与 Sca-1 高表达,阳性率为 93.71%、92.62%,见图2。
2.2 外泌体的鉴定 分离的外泌体透射电镜下呈囊泡状,大小为30~120 nm,见图3A;Western blot 检测示,提取物表达外泌体标志蛋白Alix 和TSG101,见图3B;qRT-PCR 检测示,脂肪干细胞(5.65±0.78)及脂肪干细胞外泌体(5.26±0.67)中miR-27 表达量高于白色脂肪组织(1.00±0.02),差异有统计学意义(n=3,F=56.661,P<0.001)。
2.3 miR-27转染效率 慢病毒转染293T细胞48 h后,当病毒滴度为5×108TU/mL 时,光学显微镜下显示细胞生长良好(图4A、B、C),荧光显微镜下显示慢病毒密度高(图4D、E),以此滴度为病毒最佳转染滴度。转染ASC 细胞后的对照组、空载体组及过表达组的 miR-27 的表达量分别为(1.00±0.02)、(1.02±0.02)、(39.68±0.31),差异有统计学意义(n=3,F=44 357.091,P<0.001)。
2.4 外泌体携带miR-27对小鼠体质量与脂肪组织体积的影响 过表达miR-27 对小鼠的体质量变化无明显影响,相同时点3 组间的体质量组间差异无统计学意义(P>0.05),见表2。3组干预后12 d的小鼠体质量与干预前的体质量的减少量分别为:对照组(3.32±1.36)g、过表达组(1.12±0.43)g、正常表达组(1.75±0.31)g,组间差异有统计学意义(F=10.878,P<0.01)。相对于对照组,过表达组与正常表达组小鼠分离的WAT 体积要大,且过表达组更明显;而BAT的大小变化不明显,见图5。
Tab.2 Changes in body weights of three groups of mice表2 各组小鼠体质量变化情况 (g,)
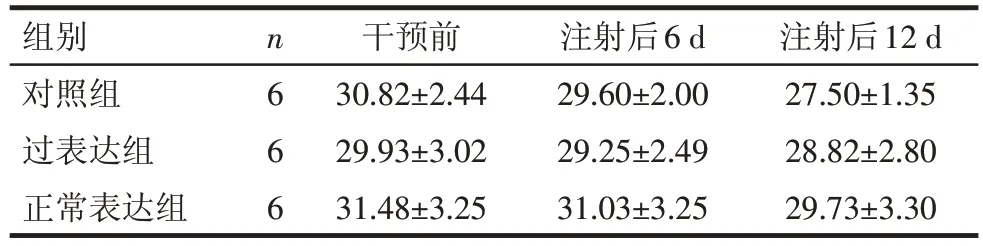
Tab.2 Changes in body weights of three groups of mice表2 各组小鼠体质量变化情况 (g,)
F时间=69.108,F交互=7.370,P<0.05;F组间=0.628,P>0.05
组别对照组过表达组正常表达组n6 6 6干预前30.82±2.44 29.93±3.02 31.48±3.25注射后6 d 29.60±2.00 29.25±2.49 31.03±3.25注射后12 d 27.50±1.35 28.82±2.80 29.73±3.30
2.5 外泌体携带miR-27对UCP1、PPARγ、PRDM16及PGC-1α 的影响 对照组、正常表达组与过表达组的UCP1、PPARγ、PRDM16及PGC-1α相对表达水平呈依次降低趋势(P<0.05),见表3、图6。
Tab.3 Comparison of expression levels of UCP1,PPARγ,PRDM16 and PGC-1α between the three groups表3 各组小鼠中UCP1、PPARγ、PRDM16、PGC-1α的表达水平比较 (n=3,)
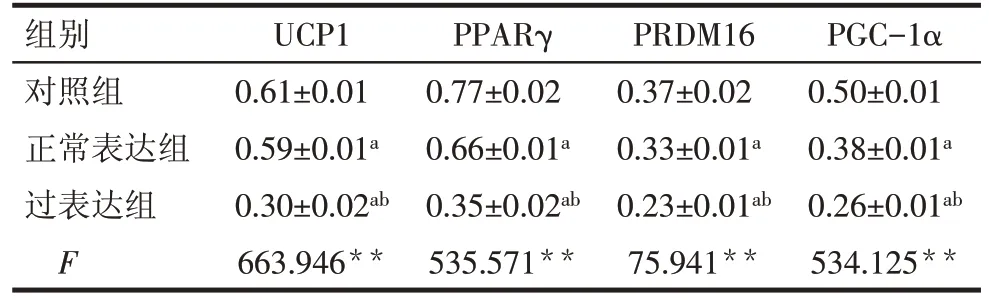
Tab.3 Comparison of expression levels of UCP1,PPARγ,PRDM16 and PGC-1α between the three groups表3 各组小鼠中UCP1、PPARγ、PRDM16、PGC-1α的表达水平比较 (n=3,)
*P<0.05,**P<0.01;a 与对照组比较,b 与正常表达组比较,P<0.05
组别对照组正常表达组过表达组F UCP1 0.61±0.01 0.59±0.01a 0.30±0.02ab 663.946**PPARγ 0.77±0.02 0.66±0.01a 0.35±0.02ab 535.571**PRDM16 0.37±0.02 0.33±0.01a 0.23±0.01ab 75.941**PGC-1α 0.50±0.01 0.38±0.01a 0.26±0.01ab 534.125**
3 讨论
WAT被认为是一种复杂的内分泌器官,通过产生多种脂源性细胞因子调节复杂的生理过程,维持系统能量平衡[8]。BAT主要生理学功能是产生和释放热量,对维持机体能量平衡也有重要作用[9]。ASC来源的外泌体内含大量的遗传信息,通过自分泌或旁分泌的方式对邻近或远处的靶细胞发挥其调控作用[10]。因此,如何调控外泌体的产量及控制其携带的遗传信息对WAT的影响,对于理解白色脂肪棕色化的进程及肥胖控制有至关重要的意义。
miRNA 可以从供体细胞传递到远端的受体细胞,以内分泌或旁分泌的方式向特异靶组织细胞传递调节信号,改变靶组织某些基因的表达,因此其可以作为疾病诊断的生物标志物[11]。笔者团队前期也证实了ASC 富含微囊泡(包括外泌体),且携带丰富的miRNA,具有促进血管生成、肿瘤发展的生物学作用[6]。有研究表明miR-27 在抗肿瘤方面的作用也不可小觑,包括诱导食管癌、肝癌、胃癌、胰腺癌细胞凋亡[12],抑制肺癌细胞增殖[13],参与前列腺癌、乳腺癌、淋巴瘤的疾病进展等,这提示miR-27 可能成为治疗或预防肿瘤的靶标,而ASC 来源的外泌体可能成为未来攻克肿瘤难题的新方向。
研究显示,miR-27 可以直接抑制PPARγ 基因,影 响 线 粒 体 功 能[14];miR-27 通 过 靶 向 调 节PRDM16,进而参与脂肪棕色化调控[15]。同时有研究发现miR-27a/PPARγ/β-catenin 轴激活也可促进糖尿病肾病的发展,主要是引起足细胞损伤,使血流动力学因子改变,刺激系膜细胞胞外基质的合成增加[16]。在脂肪细胞分化过程中,miR-27能够直接靶向结合抗增殖蛋白(prohibitin,PHB),引起线粒体结构变化及功能障碍,从而抑制脂肪细胞的分化[17]。由此可见,miR-27可以在多位点参与调控脂肪代谢过程,具有调控白色脂肪棕色化的潜能。但关于外泌体这一具有生物传导的活性物质,却鲜有研究其中的miR-27 的含量及其对脂肪组织转化、代谢的作用。
研究显示,肥胖状态下血清中升高的miR-27主要来源于脂肪细胞分泌[18],且通常作为一种负向调控因子来抑制脂肪细胞分化[19]。本研究结果显示,ASC 及其外泌体中的miR-27 显著高于WAT,证实ASC 可能是研究miR-27 功能与机制的良好材料来源。另有研究认为,肥胖小鼠中的WAT 中miR-27含量下降,而体循环中miR-27 则呈现上调趋势[18]。本研究同样发现此种现象,这可能与脂肪干细胞分泌外泌体并携带miR-27进入体循环有关,进而影响或调控脂肪的代谢。以往研究发现,miR-27主要靶向PPARγ 的表达来抑制脂肪沉积[20]。而本研究发现,miR-27 可以抑制PPARγ 的表达,但主效应是抑制白色脂肪向棕色脂肪转变,使得白色脂肪消耗减少,呈现出肥胖小鼠体质量下降缓慢。小鼠WAT体积增大,这可能与miR-27 对其他棕色化相关蛋白(UCP1、PRDM16、PGC-1α)的抑制作用更强有关,对BAT合成的抑制作用强于WAT的消耗。
综上所述,miR-27能够由ASC以外泌体形式分泌,且能够被脂肪细胞所摄取;ASC以外泌体形式分泌的miR-27能够抑制白色脂肪棕色化,该抑制作用主要通过转运miR-27 下调UCP1、PPARγ、PRDM16及PGC-1α棕色化相关蛋白的表达完成。

