抗新型冠状病毒靶点及药物研究进展
韩露,王同兴,肖智勇,周文霞,张永祥
(军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
2002年末以来,严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)、中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)和新型冠状病毒(SARS-CoV-2)等冠状病毒的传播,不仅导致了严重的人类疾病,威胁民众的生命安全,还引发严峻的公共卫生危机,造成了巨大经济损失[1-3]。因SARS-CoV-2 感染引起的COVID-19已在全球范围内大流行,成为自1918 年流感大流行暴发以来最大的公共卫生、社会和经济危机。然而,迄今尚无针对冠状病毒的特效防治药物。此次疫情发生后,我国迅速启动了包括药物筛选、研发等在内的科技攻关计划,首先对已上市或处于临床研究阶段的对COVID-19可能有效的药物进行了筛选和研究,发现一些具有抗SARS-CoV-2活性的药物,如氯喹(chloroquine)、羟氯喹(hydroxychloroquine)、法匹拉韦(favipiravir)和瑞德西韦(remdesivir)等[4]。随着疫情进展,国外也开展了抗SARSCoV-2 药物的研发,但这些药物疗效有待进一步研究确定。随后进一步的研究发现,氯喹不能有效阻止SARS-CoV-2 入侵肺细胞[5],提示氯喹可能对治疗COVID-19 疗效欠佳。深入研究并阐明SARSCoV-2的生物学特性、感染和致病等机制,寻找有效靶标,研发疗效及安全性好的抗SARS-CoV-2 药物是当前的迫切需求。本文介绍SARS-CoV-2 的组成和生存周期,综述其潜在的靶点和药物研发现状,为快速有效地研发COVID-19 防治药物提供参考。
1 SARS-CoV-2结构与生存周期
导致COVID-19 的病原体SARS-CoV-2 是一组高度多样、具包膜的正义单链RNA 病毒,与SARS-CoV 和MERS-CoV 同属于β 冠状病毒[1]。SARS-CoV-2 的基因组成和功能与已知冠状病毒具有高度相似性[6]。SARS-CoV-2 基因组由多达29 个开放阅读框和一些附属基因组成,长度约30 kb[1]。SARS-CoV-2 确切的功能蛋白数目虽尚待确定,但至少有16 种非结构蛋白、4 种结构蛋白和6~7种辅助蛋白得到了确认。
1.1 结构
冠状病毒属病毒颗粒由外层的包膜和内层的核衣壳构成,包膜与细胞膜一样同为磷脂双分子层结构,其中包含由病毒基因组编码的结构蛋白包括刺突糖蛋白(spike glycoprotein,S蛋白)、包膜蛋白(envelope protein,E 蛋白)和膜蛋白(membrane protein,M 蛋白),核衣壳则由核衣壳蛋白(nucleocapsid protein,N蛋白)和病毒RNA组装而成(图1A)。
S 蛋白在病毒-细胞受体相互作用中起着关键作用,对抗病毒药物或疫苗的开发具有重要意义。S蛋白由S1亚基和S2亚基组成,其中S1具有与受体结合的功能,而S2 则介导随后与宿主细胞膜融合[3]。S1 亚基的受体结合域(receptor-binding domain,RBD)与宿主受体结合,触发S2 亚基的构象变化,使病毒和宿主细胞膜接近并产生融合[7](图1B)。E蛋白是一种小型膜结合蛋白,参与病毒装配和出芽等。M 蛋白是冠状病毒最丰富的结构蛋白,主要功能是维持病毒包膜的形状,并可将其他结构蛋白募集到“内质网-高尔基中间室(endoplasmic reticulum-Golgi intermediate compartment,ERGIC)”以介导病毒组装和出芽。N蛋白的主要作用是与病毒基因组RNA结合并形成螺旋状核糖核蛋白,参与基因组保护、病毒RNA 复制、病毒体组装和免疫逃逸。
非结构蛋白主要由冠状病毒的2个功能开放阅读框(open reading frame,ORF)1a 和ORF1b 编码。ORF1a/b 翻译出多聚蛋白1a(polyprotein 1a,pp1a)和pp1ab,它们被木瓜蛋白酶样蛋白酶(papainlike protease,PLpro)和3-胰凝乳样蛋白酶(3Clike protease,3CLpro)分割产生多个非结构蛋白,其中包括参与病毒转录和复制的RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase,RdRp)和解旋酶等[3,8](图1)。
SARS-CoV-2 作为冠状病毒属成员,其基因组和结构组成与其他冠状病毒基本相同,而基因组中的关键位点差异导致SARS-CoV-2 的不同致病特点及感染后果[9]。其结构蛋白中的S蛋白在病毒吸附和穿入细胞中发挥关键作用,E蛋白、M蛋白和N蛋白则对于病毒的装配起关键作用;非结构蛋白包括病毒的酶以及由非结构蛋白组成的复制复合体,在病毒完成整个生命周期中起关键作用。这些蛋白、病毒结构中的脂质膜以及结构和复制中的核酸都可成为抗病毒的重要靶点。由于病毒生存周期高度依赖宿主,所有参与病毒生存周期的宿主蛋白也都可成为重要的抗病毒宿主靶点。
1.2 复制周期
SARS-CoV-2 复制周期与其他冠状病毒相似,包括吸附、穿入、脱壳、核酸和蛋白质合成、装配和释放5 个步骤。吸附:首先SARS-CoV-2 通过S 蛋白与宿主表面受体蛋白结合,实现吸附作用(图2①)。冠状病毒可吸附的宿主蛋白包括血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)、二肽基肽酶-4(dipeptidyl peptidase 4,DPP4)、氨肽酶N(aminopeptidase N)和CD147等,而目前已经发现SARS-CoV-2 可以利用ACE2 或CD147 实现吸附[10-13]。穿入:吸附之后,SARS-COV-2 可通过2种途径穿入细胞(图2①),一种是胞内体途径,另一种是细胞表面非胞内体途径[3]。其中胞内体途径需要依靠低pH 值环境以及pH 依赖性的半胱氨酸蛋白酶,从而促进膜融合反应[14-15]。冠状病毒穿入的非胞内体途径依赖其他宿主蛋白酶,如跨膜蛋白酶丝氨酸2(transmembrane protease serine 2,TMPRSS2)和跨膜蛋白酶丝氨酸11D(transmembrane protease serine 11D,TMPRSS11D)。蛋白酶可将S 蛋白切割成S1 和S2 亚基,从而激活S 蛋白,促进非胞内体途径进入[16-17]。脱壳:穿入之后冠状病毒在宿主细胞内解体,将核衣壳和病毒RNA释放到细胞质中(图2②)。核酸和蛋白质合成:在核酸和蛋白质合成阶段,ORF1a/b 翻译为pp1a 和pp1ab(图2③),病毒基因组RNA 开始复制(图2④)[8]。pp1a 和pp1ab 被PLpro 和3CLpro 裂解产生大量非结构蛋白,并形成复制-转录复合物。冠状病毒复制-转录复合物的疏水结构域附着在内质网膜上,产生冠状病毒复制结构[18-19]。病毒基因组RNA的全长正链转录形成全长负链模板,负链模板用于合成新的全长基因组RNA[3,8]。病毒复制结构合成亚基因组RNA(subgenomic RNA)和各种结构蛋白的mRNA(图2⑤),并产生结构蛋白和辅助蛋白(图2⑥)[3,8]。装配和释放:最后在装配和释放阶段,N蛋白和全长基因组RNA组装形成螺旋状核衣壳,核衣壳与S蛋白、E蛋白和M蛋白形成组装的成熟病毒(图2⑦和⑧),组装完成的病毒通过胞吐释放到细胞外,继续新的病毒复制周期(图2⑨)[6]。

图1 新型冠状病毒(SARS-CoV-2)基因组结构和刺突糖蛋白(S蛋白)介导的与宿主细胞融合.A:SARS-CoV-2基因组结构及其蛋白组成;其中数字表示基因组结构碱基序列位置,数字~数字表示编码蛋白的基因组区间;B:S蛋白通过不同构象实现与细胞受体结合介导膜融合.ACE2:血管紧张素转换酶2;RBD:受体结合域;PLpro:木瓜蛋白酶样蛋白酶;3CLpro:3-胰凝乳样蛋白酶;RdRp:RNA依赖性RNA聚合酶;E蛋白:包膜蛋白;M蛋白:膜蛋白;N蛋白:核衣壳蛋白.
2 靶向SARS-CoV-2与相关药物研发
SARS-CoV-2 是一种高度宿主依赖的病原体,因此靶SARS-CoV-2 病毒本身或靶向宿主的治疗手段都可发挥作用。针对SARS-CoV-2的吸附、穿入、脱壳、核酸和蛋白质合成、装配和释放5 个步骤的每个阶段都可实现抗病毒效果。目前针对病毒结构蛋白(图2a)、病毒的酶(图2b)、病毒的复制复合体(图2c)和病毒核酸、核苷酸及脂质膜(图2d)的药物研究取得了一定进展。由于病毒的生命周期本身高度依赖宿主,因此针对宿主在各阶段发挥作用的分子也可产生抗病毒效果。目前针对参与病毒入侵的膜受体和蛋白酶(图2e)、细胞内吞作用(图2f)、其他参与病毒复制的信号通路(图2g)以及免疫调节(图2h)(表1)[6]的药物研究取得一定进展。
2.1 病毒自身靶点及其相关药物
冠状病毒整个生命周期中可作为靶点的分子包括病毒的结构蛋白、非结构蛋白(包括关键的酶以及由非结构蛋白构成的复制复合体)以及病毒的核酸。这些分子共同组成病毒来源的COVID-19治疗靶点。下面将分别叙述这些靶点的靶向药物。
2.1.1 病毒结构蛋白靶点及其相关药物
感染性病毒颗粒中的结构蛋白可以作为抗病毒药物的靶点。根据冠状病毒的结构可知其主要结构蛋白包括S 蛋白、E 蛋白、M 蛋白和N 蛋白(图2a),其中S 蛋白作为冠状病毒进入宿主细胞的重要蛋白可与宿主细胞表面受体结合,帮助病毒进入宿主细胞[9,20-22]。因此,以S 蛋白为靶点是抗冠状病毒药物研发的重要策略。
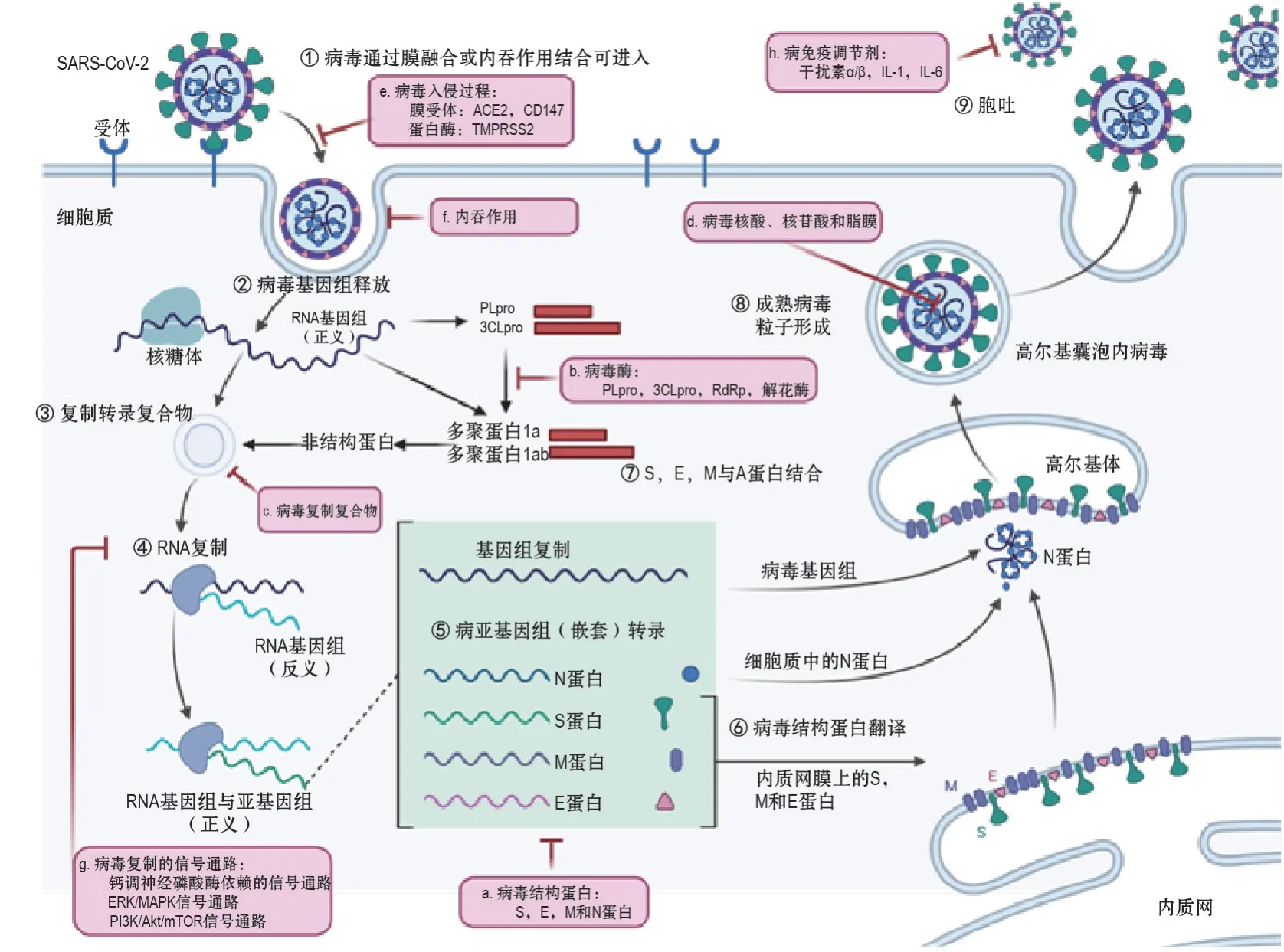
图2 SARS-CoV-2复制周期及药物靶向策略.CD147:基质金属蛋白酶诱导子;TMPRSS2:跨膜蛋白酶丝氨酸2;ERK:细胞外调节蛋白激酶;MAPK:丝裂原活化蛋白激酶;PI3K:磷脂酰肌醇3-激酶;Akt:蛋白激酶B;mTOR:哺乳动物雷帕霉素靶蛋白;IL-1:白细胞介素1;➝:病毒复制周期涉及的步骤;—:药物靶向策略.
针对S 蛋白的抗体在SARS-CoV 和MERSCoV 病毒中已经表现出抗病毒活性。在SARSCoV研究中,部分SARS 患者在症状发作后接受恢复期患者血浆治疗后出院率显著升高,且死亡率降低,而这些血浆中含有靶向SARS-CoV-S 的抗体[23-24]。在MERS-CoV研究中发现,对于利用腺病毒载体表达人源DPP4基因的MERS-CoV 感染的BALB/c 小鼠模型,含MERS-CoV-S 抗体的血清可以阻断病毒附着并加速体内病毒的清除[25]。在SARS-CoV-2 S 蛋白抗体研发中发现,人源化单克隆抗体H014 可在nmol 水平通过与S 蛋白RBD 结合以中和SARS-CoV-2,并在ACE2 人源化小鼠模型中降低感染肺部的病毒滴度,预防肺部病变[26]。单克隆抗体COV2-2196 和COV2-2130 也能够靶向RBD,阻断病毒与ACE2 受体结合,并在小鼠和恒河猴模型得到验证[27]。对于病毒频繁突变可能产生的耐药问题,可能通过多抗体联合治疗的方法解决。已有研究表明,2 种或以上靶向非交叉耐药表位或S蛋白不同区域的单克隆抗体有助于减少病毒突变导致的免疫逃逸现象[28]。
靶向S 蛋白的多肽药物也具有抗病毒活性,提示这类药物在COVID-19防治中具有良好的应用前景。在抗SARS和MERS的体外药物实验中,针对S蛋白的抗病毒肽类均显著减少感染导致的细胞空斑形成[29-30]。而在MERS感染的小鼠模型中,抗病毒肽HP2P-M2表现出保护作用,且与干扰素β联合使用时具有增效作用[31]。靶向S 蛋白的多肽药物对SARS-COV-2 感染也具有对抗作用,基于SARS-CoV和MERS-CoV的抑制剂EK1开发的脂肽EK1C4,体外应用对SARS-CoV-2膜融合过程有显著抑制作用,并能保护小鼠模型不受HCoVOC43 感染,提示其对SARS-CoV-2 感染的防治作用[32]。针对S 蛋白不同区域的抗病毒肽可具有协同作用,并克服病毒的耐药突变[33]。
靶向S蛋白的其他蛋白类药物在冠状病毒感染模型上也表现出治疗效果。如格瑞弗森(griffithsin)是从一种红藻中分离得到的抗病毒蛋白[34],能与冠状病毒S蛋白上的寡糖特异性结合[35],并在体外模型和感染SARS-CoV 的小鼠模型中表现出对冠状病毒的抑制作用。然而其对SARS-CoV-2 的治疗效果尚未见报道。
靶向S蛋白的小分子药物也同样受到关注。如在体外实验中,阿比朵尔(arbidol)具有抗SARS-CoV 的活性[36],其可能通过作用于S 蛋白发挥作用。阿比朵尔也在COVID-19患者中进行了临床试验。来自69例COVID-19患者的临床数据显示,阿比朵尔治疗组病死率(0%)明显低于未使用阿比朵尔组(16%)[37]。然而后续也有研究显示阿比朵尔并未表现出明确药效[38]。

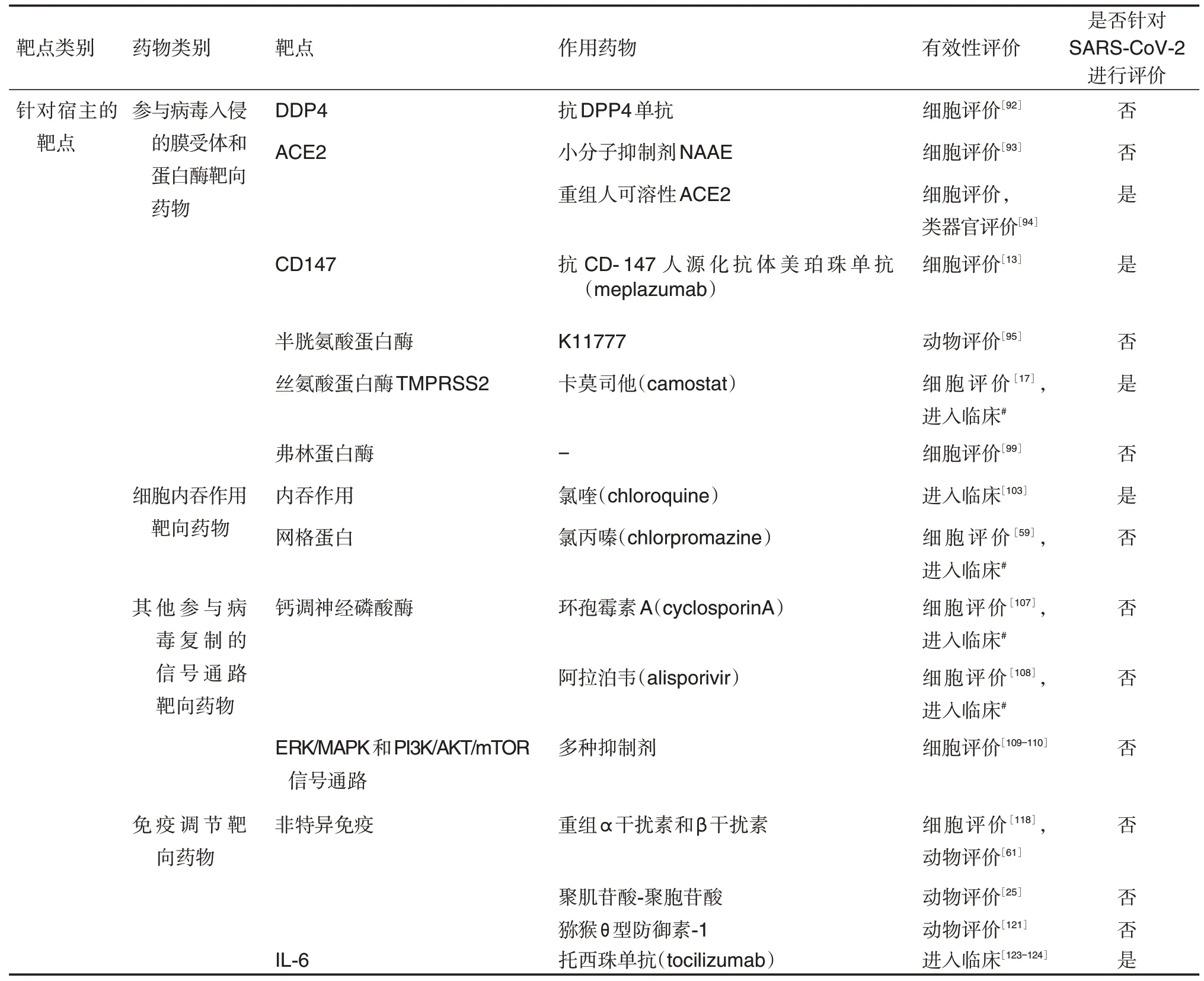
表1 冠状病毒靶点和具有潜在作用的药物
续表1
冠状病毒其他的结构蛋白,包括E蛋白、M蛋白和N 蛋白,不仅是病毒组装必需的蛋白,而且部分蛋白还具有抑制宿主免疫反应以促进病毒复制的功能。例如,SARS-CoV-M蛋白具有干扰素拮抗活性,SARS-CoV-N 蛋白可抑制由shRNA 或siRNA触发的RNA 干扰[39-40],且靶向SARS-CoV E 蛋白、M 蛋白和N 蛋白,ORF3a,ORF7a 或ORF7b 的siRNA 能够抑制病毒在体外模型中的复制[41],说明S蛋白以外的结构蛋白也可能成为抗病毒靶点。目前已发现部分靶向E 蛋白和N 蛋白的化合物具有一定抗病毒活性,如SARS-CoV 和HCoV 229E 的E蛋白抑制剂阿米洛利(amiloride),与HCoV-OC43中N 蛋白的N 端结构域结合的PJ34 等[42-44]。然而总的看来,以S 蛋白以外的其他结构蛋白为靶点的药物研究仍然较少,是否具有良好的研发前景目前尚难判断。
2.1.2 病毒酶靶点及其相关药物
病毒基因组除编码结构蛋白外,还编码了大量的非结构蛋白,其中病毒酶在病毒生命周期发挥重要作用(图2b),是潜在的治疗靶点,包括蛋白水解酶和复制酶等。在病毒的生命周期中,蛋白水解酶类的PLpro 和3CLpro 通过水解病毒的复制酶多聚蛋白,产生的大量非结构蛋白,进而形成病毒的复制;RdRp 和解旋酶在病毒的复制复合物过程中分别催化RNA 合成和RNA 双链解旋过程。PLpro、3CLpro、RdRp 和解旋酶在病毒生命周期中的重要作用决定了它们极可能成为有效的抗病毒靶点,针对这些病毒酶的靶向药物研发也取得了一定的进展。
PLpro 作为冠状病毒的一个关键蛋白水解酶,在多聚蛋白水解、去泛素化等方面发挥作用[45-47]。病毒PLpro蛋白的晶体结构解析促进了对PLpro蛋白功能的了解和靶向分子的发现[48],然而目前发现的某些SARS-CoV 的PLpro 抑制剂却不能抑制病毒复制[49-51]。而且不同的冠状病毒(例如SARSCoV 和MERS-CoV)的PLpro 蛋白结构具有差异,目前发现的PLpro 抑制剂无法发挥广谱作用[52-53]。因此,针对SARS-CoV-2 的PLpro 靶向药物研究应关注其PLpro 蛋白与其他病毒的同源性,及其在细胞和动物模型中的活性。
3CLpro 是另一种冠状病毒病毒复制所需要的水解酶,可通过分解病毒复制中产生的复制酶多聚蛋白发挥作用。已有研究表明,多种药物可靶向SARS的3CLpro蛋白[54],部分抑制剂在体外实验中表现出广谱的抗冠状病毒活性[55-56]。已经上市的用于治疗HIV 感染的蛋白酶抑制剂洛匹那韦是一种3CLpro抑制剂,在多种体内外实验中表现出单用或联合使用的抗MERS-CoV 或SARS-CoV 活性[25,57-61]。针对SARS-CoV-2 的3CLpro 蛋白的晶体结构解析和药物筛选也发现部分能够抑制3CLpro蛋白活性的小分子,其中依布硒(ebselen)在细胞模型中表现出活性[62]。
参与病毒转录和复制的RNA 依赖性RdRp 是冠状病毒复制-转录复合物的重要组成部分,参与基因组和亚基因组RNA 的产生。核苷(酸)类似物通过抑制RdRp的功能发挥作用。核苷类似物利巴韦林(ribavirin)是一种具有广谱抗病毒活性的鸟嘌呤类似物,用于治疗严重呼吸道合胞病毒感染、丙型肝炎病毒感染和病毒性出血热,其确切的作用机制尚不清楚,但抑制mRNA 加帽和诱导RNA 依赖性病毒复制中的突变对治疗包括冠状病毒在内的多种RNA病毒感染至关重要[63]。细胞实验结果表明,利巴韦林在体外能够抑制SARS-CoV-2复制[4]。然而,用利巴韦林治疗SARS患者和MERS患者的结果并未显示出明显的临床获益[64-67]。此外,使用大剂量利巴韦林的严重副作用也限制了其在严重冠状病毒感染患者中的临床应用[2,64]。腺苷类似物BCX4430 作为一种非专一的RNA 链终止剂,可抑制多种RNA 病毒的RdRp,包括SARS-CoV 和MERS-CoV等冠状病毒以及埃博拉和马尔堡病毒等丝状病毒[68]。其他核苷类似物,如阿昔洛韦(aciclovir)在体外可抑制MERS-CoV 和HCoV-NL63[69]。2014 年,法匹拉韦在日本批准上市,用于甲型和乙型流感的治疗,其安全性良好[70]。研究表明,法匹拉韦在体外对SARS-COV-2 有一定的抑制作用[4]。且在深圳开展的一项开放性非随机对照研究中显示,其对COVID-19 疾病进展和病毒清除具有作用,法匹拉韦治疗组病毒清除中位时间更短(内距2.5~9.0 d),与对照组(内距8.0~13.0 d)相比差异显著(P<0.01),法匹拉韦治疗组胸部CT 改善率(91.43%)也显著高于对照组(62.22%)(P=0.004)[71]。法匹拉韦仿制药阿维法韦(avifavir)已在俄罗斯获批用于COVID-19 治疗(https://rdif.ru/Eng_full-News/5224/),而印度也批准了法匹拉韦用于轻度至中度COVID-19 患者的治疗(https://www.glenmarkpharma.com/sites/default/files/Indian-regulatorapproves-Favipiravir-for-the-treatment-of-mild-tomoder.pdf)。瑞德西韦作为靶向RdRp 的抗RNA病毒的新型核苷类似物被广泛关注并尝试用于治疗SARS-CoV-2感染[4,72-73]。晶体结构研究表明瑞德西韦对SARS-CoV-2 的RdRp 具有靶向作用[74]。瑞德西韦较早开展用于治疗COVID-19 的临床研究[75]。在中国的一项双盲安慰剂对照临床试验(注册号:NCT04257656)中,瑞德西韦不能使COVID-19重症患者明显获益,但在症状持续时间≤10 d的患者中,瑞德西韦治疗组的临床改善时间比安慰剂组更短(风险比1.52,95%置信区间为[0.95~2.43])[76]。而美国的一项RCT 研究以及一项国际的同情用药试验则支持瑞德西韦对COVID-19患者的临床获益,瑞德西韦组患者的中位恢复时间为11 d,显著小于安慰剂组的15 d(P<0.01)[77]。2020年5月1日,美国食品药品管理局宣布瑞德西韦获得紧急使用授权(emergency use authorization)。随后,日本、印度、英国和欧盟等也批准了瑞德西韦用于COVID-19治疗或紧急使用。然而瑞德西韦抗SARS-CoV-2 的作用和安全性等还有待进一步观察和研究。一种新的核苷类似物EIDD-1931在细胞模型上表现出对SARS-CoV-2 及其他病毒的抑制作用,并且对瑞德西韦耐药的病毒依然有效。口服其前体药物EIDD-2801 可抑制冠状病毒感染的小鼠模型体质量降低和肺部出血现象[78]。与其他病毒靶标类似,冠状病毒RdRp 的突变可导致耐药性问题。除核苷类似物外,靶向RdRp 的siRNA分子对SARS-CoV也有抑制作用,然而由于siRNA递送困难,尚难进行临床应用[79-80]。
解旋酶在冠状病毒复制周期中催化双核苷酸链解旋成单链。由于不同冠状病毒的解旋酶高度同源,针对解旋酶的抑制剂可具有广谱活性。解旋酶抑制剂根据其作用机制差别可分为ATP 酶活性和非ATP 酶活性2 种不同类型。其中靶向ATP 酶发挥活性的某些抑制剂,如巴拿宁(bananins)和2,6-双芳甲氧-5-羟色酮(2,6-bis-arylmethyloxy-5-hydroxychromones)可在体外抑制SARS-CoV 复制[81-82]。然而,这些化合物对细胞ATP酶或激酶的抑制所产生的毒性不利于临床应用。而非ATP 酶活性的冠状病毒螺旋酶抑制剂如SSYA 10-001,可选择性抑制螺旋酶的解旋活性,从而抑制包括SARS-CoV 和MERS-CoV 等在内的多种冠状病毒[83-84]。因此,针对SARS-CoV-2的解旋酶研发非ATP 酶活性的抑制剂,有利于减小副作用,提高成药性。
2.1.3 病毒复制复合体靶点及其相关药物
病毒的复制复合体由多种非结构蛋白组成,由于病毒的核酸合成依赖于冠状病毒复制复合物。因此,以该复合体为靶点进行治疗可起到抗病毒作用(图2c)。针对病毒复制复合体进行抗病毒研发的研究较少。已发现针对该复合物的药物K22 在体外实验中表现出对多种冠状病毒的抑制活性,而对组成复合体的非结构蛋白NSP6 发生突变的HCoV 229E 病毒则表现出耐药性[18],提示该药物作用靶点与该蛋白有关。由于复制复合体组成复杂,针对哪些非结构蛋白设计药物可发挥抗病毒作用仍不明确,为相关药物的研发带来了一定困难。
2.1.4 靶向病毒核酸、核苷酸和脂质膜的药物
SARS-CoV-2 病毒的生命周期中除了上述蛋白外,核酸及组成核酸的核苷酸以及其结构中的脂质膜均发挥了重要作用(图2d)。针对这些非蛋白类靶点进行药物研发也可具有抗病毒作用。
核酸和核苷酸作为SARS-CoV-2 的遗传物质和结构单元,承载着病毒的基因组信息,并在蛋白合成中发挥作用。靶向核苷或核苷酸的药物通常具有广谱抗病毒活性。霉酚酸酯通过非竞争性可逆性抑制嘌呤核苷酸从头合成途径,使鸟嘌呤核苷酸耗竭,其作为一种对乙型肝炎病毒、丙型肝炎病毒和登革病毒等具有广泛抗病毒作用的药物,在体外模型中表现出对冠状病毒的抑制活性[85]。然而在MERS-CoV 感染的动物模型中却表现出加重感染的症状[61],这可能与其强烈抑制T 淋巴细胞和B 淋巴细胞增殖作用相关。因此,单独使用这类药物在整体水平未必起到很好的治疗作用。
靶向核酸的药物主要是RNA酶。RNA酶作为催化特定生化反应的RNA分子,在体外筛选模型中可以抑制冠状病毒RNA 表达[86]。然而由于这类分子会在体内迅速降解导致其难以应用于临床治疗。
SARS-CoV-2 作为一种包膜病毒,脂质膜是形成病毒结构的重要组成部分,针对病毒脂质膜的靶向药物也可发挥抗病毒作用。LJ001和LJ103通过产生单态氧分子破坏病毒脂质膜,对多种冠状病毒有抑制作用,有潜力成为一类新的抗病毒药物[87-90]。
2.2 宿主靶点及其相关药物
2.2.1 膜受体和蛋白酶靶点及其相关药物
SARS-CoV-2 利用特定的宿主受体和蛋白酶进入细胞并复制(图2e)。靶向参与病毒入侵的膜受体和蛋白酶进行药物研发可抑制冠状病毒的感染。
病毒利用的宿主受体可通过特异性抗体、肽或功能性抑制剂进行靶向干预。DPP4 是MERSCoV入侵依赖的膜受体,DPP4单抗可抑制MERSCoV 进入细胞[91]。ACE2 是SARS-CoV 和SARSCoV-2 入侵依赖的膜受体,在SARS-CoV 的治疗中,小分子进入抑制剂N-(2-氨基乙基)-1-氮杂环丙烷胺〔N-(2-aminoethyl)-1-aziridineethanamine,NAAE〕在体外实验中抑制ACE2 介导的细胞融合[92]。在SARS-CoV-2 治疗的体外实验中,抗CD147 人源化抗体美泊珠单抗(meplazumab)可抑制SARS-CoV-2 进入宿主细胞[13]。重组人可溶性ACE2在细胞模型中可以显著抑制SARS-CoV-2感染能力,在小鼠模型无效果,但对于工程化的人血管和肾器官,可抑制其感染,提示重组人可溶性ACE2可用于阻断SARS-CoV-2早期感染[93]。然而针对这些受体的药物尚未在人体上证明有效,而应用这类药物时需要综合考虑这些靶点本身在人体的基本生理作用以及免疫方面的副作用。
冠状病毒通过2 种不同途径,即胞内体途径和非胞内体途径进入宿主细胞[3]。胞内体途径需要依赖宿主的蛋白酶如半胱氨酸蛋白酶,其抑制剂如K11777可以抑制冠状病毒的胞内体入侵[94]。半胱氨酸蛋白酶抑制剂可对多种有包膜RNA 病毒表现出抗病毒活性[94-97]。而丝氨酸蛋白酶TMPRSS2介导冠状病毒非胞内体进入途径,其抑制剂卡莫司他(camostat)在体外实验中表现出对SARS-CoV,MERS-CoV 和SARS-CoV-2 的抑制活性,并提高SARS-CoV感染模型小鼠存活率[16-17,94]。弗林蛋白酶在MERS-CoV进入中也起重要作用,阻断弗林蛋白酶可以在MERS-COV的体外模型中抑制病毒进入和细胞融合[98]。针对SARS-CoV-2 胞内体途径进入细胞所依赖的蛋白酶进行药物干预,可取得一定的治疗效果,但由于病毒进入细胞途径多样,利用的蛋白酶种类亦多样,因此,单独干预可能效果有限,临床应用时可考虑多药联用以增强药效。
靶向宿主内参与病毒入侵的膜受体和蛋白酶的药物可抑制冠状病毒进入宿主细胞从而发挥抗病毒作用,但可能给宿主带来副作用,应考虑与不同机制的药物联合使用。如使用不同药物分别阻断病毒的胞内体途径或非胞内体途径,可能取得更优的效果。
2.2.2 细胞内吞作用靶点及其相关药物
在SARS-CoV-2的胞内体途径中,病毒通过细胞内吞作用进入细胞并释放病毒核酸,开始细胞内的生命周期。靶向这一途径也有利于冠状病毒的防治(图2f)。抗疟疾药物氯喹将质子隔离到溶酶体中以增加细胞内pH 值,从而抑制内吞作用。它在体外对多种冠状病毒和其他RNA 病毒具有广谱抗病毒活性[59,99-101]。体外细胞模型的受体可能会影响活性评价结果,在介导非胞内体途径的TMPRSS2 阳性细胞上,氯喹和羟氯喹不能阻断SARS-CoV-2感染,这可能与其无法阻断非胞内体进入途径有关[5]。氯喹和羟基氯喹用于COVID-19治疗的临床实验开展较早,影响较大[102]。在中国开展的一项30例患者参与的前瞻性临床试验中,羟氯喹治疗组在体温变化,胸部CT改善等各方面均未表现出与对照组的显著差异[103]。而一项纳入1376例患者的大样本观察性研究结果表明,相比未服用的患者,服用羟氯喹的患者插管或死亡的风险无显著降低(风险比1.04,95%置信区间为[0.82~1.32])[104]。网格蛋白是另一个内吞作用靶点,氯丙嗪(chlorpromazine)作为一种已上市的精神类药物,可以抑制网格蛋白介导的内吞作用。该药物在体外实验中表现出对冠状病毒的抑制活性[59]。然而这些药物在临床是否具有较好的抗病毒效果仍然需要进一步实验验证,同时应注意相关药物使用带来的副作用。
2.2.3 其他参与病毒复制信号通路的靶点及其相关药物
SARS-CoV-2 在进入细胞进行病毒复制的过程中也利用其他细胞信号通路,这些通路也是潜在的治疗靶点(图2g)。亲环素(cyclophilin)与SARS冠状病毒非结构蛋白1(nonstructural protein 1,NSP1)相互作用,调节钙调神经磷酸酶途径,参与病毒复制,并在T 细胞介导的适应性免疫应答中起重要作用[35]。钙调神经磷酸酶抑制剂环孢霉素能够在体外广泛抑制冠状病毒感染[35,105-106]。而环孢霉素对免疫系统的抑制作用限制了它的临床应用。非免疫抑制的钙调神经磷酸酶抑制剂,如阿拉泊韦(alisporivir)表现出对人冠状病毒NL63的抑制活性[107]。调节其他细胞信号通路的药物,如丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)等相关通路的抑制剂,也发现具有抗冠状病毒活性[108-109]。将这些宿主靶向的抗病毒药物用于治疗冠状病毒感染时应充分考虑其副作用。
2.2.4 免疫调节靶点及其相关药物
除以上SARS-CoV-2 生命周期内会利用的宿主蛋白外,调节宿主的免疫功能也有助于感染防治(图2h)。宿主应对病毒的免疫反应可分为非特异免疫和特异免疫。
非特异免疫是宿主应对感染的重要屏障。其中宿主固有的干扰素应答对包括SARS-CoV-2 在内的多种冠状病毒感染至关重要[110]。针对非特异免疫的治疗药物主要包括干扰素和天然免疫调节剂,它们与有效抗病毒药物的联合应用具有协同作用。
尽管冠状病毒能够削弱或逃避干扰素作用。但体外实验中干扰素治疗仍然有效[111-112]。重组α干扰素和β 干扰素在体外和动物模型中均可抑制SARS-CoV和MERS-CoV的复制[2,31,61,84,113-117]。干扰素α或干扰素β与其他抗病毒药物的各种组合已被用于治疗SARS或MERS患者。
天然免疫调节剂可诱导干扰素产生,从而发挥防治效果。聚肌苷酸-聚胞苷酸作为人工合成的核苷酸二聚物,能强烈诱导Ⅰ型干扰素产生。在利用腺病毒载体表达人源DPP4基因的MERS-CoV 感染的BALB/c 小鼠中,MERS-CoV 的病毒载量显著降低[25]。该药物在针对恶性胶质瘤的Ⅱ期临床试验中具有良好的耐受性[118-119]。猕猴θ 型防御素-1参与宿主病毒感染相关的免疫调控作用,在动物模型中具有抗SARS-CoV作用[120]。
特异免疫对于COVID-19 患者治疗也非常重要,参与特异免疫的白细胞介素1 和相关促炎通路对感染者的预后有一定的提示作用,是治疗SARSCoV-2 的一个候选靶点[121]。白细胞介素6 作为在细胞因子释放综合征中重要的靶点,其抗体托珠单抗(tocilizumab)已在临床用于COVID-19重症患者的救治[122-123]。已发表的临床试验结果中托珠单抗和标准治疗患者的临床改善和死亡率无统计学差异,其有效性和安全性仍有待进一步实验确证[124]。
在应用其他抗病毒药物进行COVID-19 治疗时,应考虑联合使用免疫干预手段,以起到协同增效作用。对于重症患者,应综合考虑免疫反应带来的优势与劣势,重点关注过强的免疫反应带来的严重后果。
3 对SARS-CoV-2靶点和药物研究的思考
长期以来,冠状病毒作为一种引起人类轻度感染的病毒并未受到医学研究机构的较多关注。自2002年末SARS暴发以来,冠状病毒开始受到全世界的重视[6]。由于尚缺乏针对冠状病毒感染的有效药物,充分认识病毒的感染和致病机制将为研发冠状病毒治疗药物提供帮助。
抗病毒靶点包括病毒靶点和与病毒密切相关的宿主靶点。虽然抗冠状病毒候选靶点很多,但目前关注和研究所聚焦的病毒靶点主要是冠状病毒S蛋白及RdRp。S 蛋白作为病毒与宿主细胞结合的关键蛋白,在病毒入侵宿主细胞过程中具有重要作用,是一个非常被看好的抗病毒靶点,但是尚无针对该靶点的特效药问世,仍需更多实验和临床疗效评价结果证明。在抗流感病毒药物研发过程中,靶向流感病毒与宿主细胞结合的血凝素的药物研发未能成功,但靶向病毒神经氨酸酶和M2 离子通道的抑制剂具有良好的抗病毒效果,针对这2 个靶点的药物均已成功上市,如神经氨酸酶抑制剂磷酸奥司他韦是当前抗流感病毒的特效药物。因此,在抗SARS-CoV-2药物研发中还应考虑S蛋白以外的靶点,如E 蛋白和M 蛋白等。另一类受关注的靶点RdRp 在SARS-CoV-2 复制过程中起关键作用,该靶点受关注的主要原因是现有RdRp抑制剂具有广谱抗病毒作用,在体外抗病毒实验及临床试验中表现出了良好的效果,如法匹拉韦和瑞德西韦[71,75]。因此,已经存在的靶向其他病毒RdRp 抗病毒药物也可能对SARS-CoV-2有效。
关于宿主靶向的药物研究相对较少。在抗SARS-CoV-2研究中发现,氯喹和羟氯喹虽然能够抑制细胞内吞作用,但由于SARS-CoV-2 可以由TMPRSS2 介导非胞内体途径进入细胞,因此氯喹或羟氯喹无法完全阻断SARS-CoV-2 进入细胞[5]。为了获得较好的细胞保护作用,氯喹或羟氯喹与TMPRSS2抑制剂联用或许是一个更好的方案。
研究发现,COVID-19 重症患者死亡的重要原因是SARS-CoV-2 感染引发了细胞因子风暴。虽然靶向白细胞介素6 的抗体药物托西珠单抗用于COVID-19重症患者治疗的SARS-CoV-2临床试验失败,但是对于感染者免疫系统反应的恰当干预仍然可能成为治疗COVID-19的重要手段。不同人群感染后发展为重症的概率差异很大,如肥胖者发展为重症的概率是正常体质量患者的3.4倍以上[125],儿童感染后相比于成年人更少发展为重症[126],提示患者本身在代谢与免疫方面的差异可能直接导致了不同的感染结局。运用传统中医疗法的江夏方舱医院收治的564例COVID-19患者无1例转为重症,或许与传统中医对代谢和免疫系统的调节作用相关[127]。因此,深入研究SARS-CoV-2 引发的免疫反应机制及调控免疫应答反应的关键环节,寻找有效的干预靶点,开发新型免疫疗法,对于有效发挥机体免疫系统抗病毒的能力、提高COVID-19 的治疗效果具有重要意义。
新发病原体往往存在基因关键位点的突变,所储备的抗病毒药物,尤其是靶向病毒的药物,仍然难以直接用于新病毒的防治。因此,为了增强对新型病毒的应对能力,一方面应当加强适用范围广的抗病毒药物即广谱抗病毒药物的研发,在突发疫情到来时可快速作为候选药物进行验证筛选。发现和确证有效的广谱抗病毒靶点是研发广谱抗病毒药物的关键和难点,需要进一步加强病毒学、免疫学、生物信息学、药理学和药物化学等多学科与大数据、人工智能等新技术的密切合作,实施协同攻关,可望在广谱抗病毒药物研发方面取得新的突破。此外,充分发挥我国中医药的特色和优势,认真总结和分析防治COVID-19 等传染病的经验,深入研究中药治疗传染病的理念和作用机制,可望研发出具有独特临床价值的防治传染病的中药新药。另一方面,进一步加强药物重定位新技术的研究,不断提高药物重定位的准确性和效率,对于从已有药物或化合物中寻找有效的抗病毒药物具有重要意义。尤其是在应急情况下,药物重定位技术是一条快速发现有效抗病毒药物的重要途径。因此,应当建立完善的应急药物研发技术流程,在获得病毒结构、序列、感染受体及致病特征等关键信息的第一时间,能够迅速运用药物重定位技术从已上市药物或已有化合物中寻找有效的抗病毒候选药物。此外,应大力发展基于计算分析及高通量筛选等新技术、新方法,不断提高抗病毒药物发现的准确性和效率。

