应用UPLC-QTOF-MS/MS技术测定肝细胞癌患者血清代谢组
王淑凤,柏兆方,杨馨,王心正,何昆,王红霞
(1.国家生物医学分析中心,北京 100850;2.中国人民解放军总医院第五医学中心肝病医学部,北京 100039)
肝癌是全球第五大最常见癌症,是导致癌症相关死亡的第三大原因。2018年约有84万新发病例和78万死亡病例[1],超过90%的原发性肝癌是肝细胞癌(hepatocellular carcinoma,HCC)[2]。80%HCC 是由肝硬化(liver cirrhosis,LC)发展而来的,而LC 向HCC 的恶性转变往往是致命的,部分原因是在HCC 的进展阶段,缺乏特异、灵敏的诊断标志物。血清甲胎蛋白(alpha-fetoprotein,AFP)和肝超声检查是HCC早期常规监测筛查指标,但临床诊疗实践表明,AFP 持续升高仅是发生HCC 的危险因素,有30%~40%HCC患者AFP检测呈阴性。目前通过肝影像和AFP测定诊断HCC的方法缺乏足够的敏感性和特异性。影像学检查包括电子计算机断层成像、磁共振和超声检查,虽然对HCC 的准确诊断具有重要作用,但总体而言影像学技术的灵敏度、准确性和人为操作依赖性等还不能满足HCC早期诊断的需要[3-5]。肝中的再生结节与早期肿瘤很相似,且AFP水平升高,这一特点导致对LC引起的HCC的诊断具有很大的挑战性[6]。因此,迫切需要在LC患者的高危人群中发现更可靠、更准确的肿瘤标志物,以提高早期HCC的诊断率。
代谢组学是通过高通量的分析技术来识别、定量和表征生物系统中内源性的小分子代谢物(相对分子质量<1800)。肿瘤标志物的发现是代谢组学的重要应用领域,目的是识别与各种疾病和环境暴露相关的代谢产物,是转录组学和蛋白质组学的补充[7-8]。液相色谱-质谱联用(liquid chromatograph mass spectrometer,LC-MS)技术是代谢组学研究的重要技术,在识别各种肿瘤研究中基于代谢的生物标志物方面具有灵敏度高、检测范围广等明显优势[9]。由于代谢产物的变化被认为是肿瘤的特征之一[10],并且肿瘤细胞的代谢重编程对其快速增殖很重要[11-13],因此通过研究HCC患者的血清代谢物变化,有望找到理想的早期诊断标志物及新的药物靶标。虽然HCC 血清代谢组学研究已广泛开展[14-25],但由于这些研究开展比较早,限于当时质谱技术的局限性,所鉴定的差异代谢物相对较少。更为重要的是目前尚无新的代谢标志物应用于临床检测。因此,本研究采用目前最灵敏的高分辨质谱仪TripleTOFTM6600结合超高效液相色谱法的2种分离方式——反相色谱(reversed phase liquid chromatography,RPLC)和亲水色谱(hydrophilic interaction liquid chromatography,HILIC)对50 例HCC 患者和50 例LC 患者的血清代谢组进行深度分析,探究HCC 血清代谢组变化,为寻找高灵敏度高特异性的生物标志物和治疗靶标提供依据。
1 材料与方法
1.1 仪器和试剂
高分辨电喷雾四极杆飞行时间串联质谱仪TripleTOFTM6600(Sciex,美国);LC-30AD 液相色谱仪(SHIMADZU,日本)。水(质谱级)和乙腈(质谱级)购于美国Sigma-Aldrich 公司;甲酸(纯度98%)购于比利时Acros Organics公司。
1.2 血清样本
50 例HCC 患者和50 例LC 患者血清由解放军总医院第五医学中心肝病医学部于2012 年9 月-2014 年12 月收集。所有患者均签署知情同意书,研究协议得到该医学中心肝病医学部伦理委员会批准。所有血清样本于-80℃冰箱长期保存。所有受试者的临床数据见表1。
1.3 血清代谢物提取
所有血清4℃解冻后,取上层血清100 μL 加至1.5 mL离心管中,再加入4倍-80℃预冷的乙腈:甲醇(1∶1)溶液,涡旋30 s,冰浴超声10 min,置于-20℃沉淀。1 h 后离心10 min(13 523×g,4℃),取上清,真空离心干燥后置于-80℃待质谱分析。质谱分析时,用10%甲醇水溶液(0.1%甲酸)100 μL复溶样品,冰浴超声10 min,离心10 min(13 523×g,4℃)后取上清进行分析。
1.4 色谱条件
1.4.1 反相色谱
色谱柱:ACQUITY UPLCTMHSS T3(100 mm×2.1 mm,1.8 μm)(Waters,美国);柱温:40℃;进样量:3 μL;流动相A:0.1%(体积分数)甲酸水溶液;流动相B:0.1%(体积分数)甲酸乙腈溶液;流速:0.3 mL·min-1;梯度洗脱程序:0~1.5 min,1%B;1.5~20.0 min,1%B~99%B;20.0~25.0 min,99%B;25.0~25.1 min,99%B~1%B;25.1~30.0 min,1%B。

Tab.1 Clinical data of patients enrolled in non-targeted metabolomic study
1.4.2 亲水色谱
色谱柱:ACQUITY UPLC BEH Amide(100 mm×2.1 mm,1.7 μm),(Waters,美国);柱温:40℃,进样量:3 μL;流动相A:10%(体积分数)水/乙腈溶液,含10 mmol·L-1乙酸铵和0.1%甲酸;流动相B:0.1%(体积分数)甲酸水溶液,含10 mmol·L-1乙酸铵;流速:0.3 mL·min-1;梯度洗脱程序:0~1.0 min,5%B;1.0~12.0 min,5%B~32%B;12.0~12.1 min,32%B~55%B;12.1~15.0 min,55%B;15.0~15.1 min,55%B~5%B;15.1~20.0 min,5%B。
1.5 质谱条件
电喷雾离子源,在正、负离子模式下分别检测。数据采集方式为数据依赖采集模式,一次一级全扫描进行12 次二级谱图扫描。扫描范围为50~1000 u,质量偏差为50 ppm,离子源雾化气Gas1和辅助气Gas2 都为50 Pa,气帘气为35 Pa,温度为500℃,喷雾电压(ion spray voltage floating,ISVF)为5500 V/-4500 V,去簇电压(declustering potential,DP)为80 V/-80 V,碰撞能量(collision energy,CE)为(30±15)eV。
1.6 数据分析
1.6.1 应用Progenesis Ql 3.0.3软件进行数据分析
将UPLC-QTOF-MS/MS 采集的原始数据导入代谢组学软件Progenesis QI 3.0.3进行分析,包含数据预处理和代谢物鉴定。数据预处理即自动峰值提取、归一化及背景扣除等。代谢物鉴定通过检索人类代谢组数据库(Human Metabolome Database,HMDB)(https://hmdb.ca/,2020-04-21)和Metlin 数据库(美国Waters 公司,2020-04-21),根据分子质量测定准确度,同位素相似性及二级碎片信息进行比对分析,测量误差为12 ppm。分值Score>40的代谢物为鉴定代谢物。
1.6.2 应用EZinfo软件对数据进行多元统计分析
将预处理的数据直接导入EZinfo 软件(Progenesis QI 插件)进行主成分分析(principal component analysis,PCA)、正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)和方差分析(analysis of variance,ANOVA)分析,对样本代谢组的差异性进行统计分析和可视化处理。通过PCA和OPLS-DA的得分图分析组内和组间样本代谢组的差异性;根据变量重要性投影指标(variable importance in the projection,VIP)≥1、P<0.05 和变化倍数(fold change,FC)≥1.5或≤0.67,筛选出组间显著差异代谢物。
1.6.3 应用MetaboAnalyst 4.0进行代谢通路分析
将筛选出的差异代谢物导入在线代谢组学分析工具MetaboAnalyst 4.0(https://www.metaboanalyst.ca/)进行代谢通路分析。
2 结果
2.1 UPLC-QTOF-MS/MS的稳定性
由于代谢组研究测试样本通常比较多,UPLCQTOF-MS/MS 的稳定性对获得准确可靠的差异代谢物非常重要。质量控制(quality control,QC)样本用于评价方法的重复性和稳定性。QC样本由每个样本2 μL混合组成。在样本测定过程中每10个样本中间分析一个QC样品。图1显示了HILIC分离质谱正离子检测模式(HILIC positive mode,HILIC-POS)下QC样本和所有患者样本的PCA图。可以看出,QC 样本紧密聚集在一起,表明UPLC-QTOF-MS/MS 的重复性和稳定性高,能够保证测定数据的可靠性。通过PCA 得分图看QC 样本的聚集程度能够直观、快速判断所采用技术的重复性和稳定性。
2.2 肝癌和肝硬化患者血清代谢谱
为提高代谢物的鉴定覆盖率,每个患者血清的代谢物经RPLC 和HILIC 分离后,分别用正负离子化方式检测,共有4种分析方式。为便于描述,分别缩写为RPLC-POS,RPLC-负离子检测(RPLCnegative mode,RPLC-NEG),HILIC-POS 和HILIC-NEG。合并所有样品的检测数据,上述4种方式分别检测到31 294,36 450,9 033和10 803个代谢特征谱峰,即由保留时间和精确质荷比组成的一对数值。经检索HMDB和Metlin数据库,分别鉴定到3 474,4 082,1 279 和1 655 个代谢物,共鉴定7 848 代谢物。图2 显示了4 种分析模式检测代谢物的重复性和互补性。上述数据表明,结合4 种分析模式,可以显著提高代谢物鉴定的覆盖率。

Fig.1 Principal component analysis(PCA)score plot of quality control(QC)samples and all patients′samples by hydrophilic interaction liquid chromatography(HlLlC)in positive ion mode.PCA score plot was performed using EZinfo software to evaluate the repeatability and stability of the method.The more clustered,the better the repeatability and stability.t[1]represents the first principal component,t[2]represents the second principal component.Each point represents a serum sample.
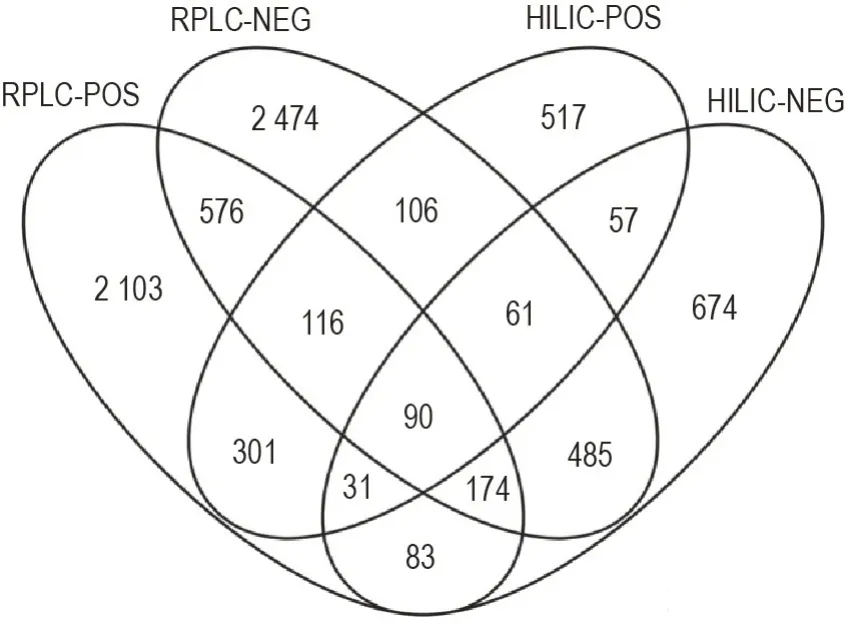
Fig.2 Venn diagram of identified metabolites in four analysis modes based on ultra-performance liquid chromatography-quadrupole time of flight-mass spectrometry(UPLC-QTOF-MS/MS). All samples were separated via reversed phase liquid chromatography coupled with positive and negative mode electrospray ionization mass spectrometry(RPLC-POS,RPLC-NEG)and were separated via hydrophilic interaction liquid chromatography in positive and negative ion mode(HILIC-POS,HILIC-NEG).Non-overlapping part of the figure is unique to each group,and the overlapping part is common to each group,and the numbers are shown.
2.3 多元统计分析
无监督的PCA分析可以降低数据的复杂性,直观地反映两组数据之间的分离度及组内数据的相似性。图3 展示了4 种分析模式下HCC 和LC 的PCA 得分图。PCA 得分图反映了每个样本在2 个主成分t[1]和t[2]组成的坐标系中的分布,每个点代表一个样本。可以看出4种分析模式下2组的分离程度均不明显。由于HCC和LC患者的发病机制及临床症状有较高的相似性,因此血清代谢组相似性也较高,分离不明显,与文献报道一致[15]。为寻找能区分HCC 和LC 患者的潜在代谢标志物,本研究进一步对数据进行了有监督的OPLS-DA 分析。图4 为4 种分析模式的OPLS-DA 得分图。可以看出,HCC 和LC 患者在4 种分析模式下分离都很明显。根据OPLS-DA,可以计算出每个代谢物的VIP 值,这是筛选差异代谢物的重要参数之一。同时,对数据进行ANOVA分析,可得到每个代谢物在2组之间的P值。

Fig.3 PCA score plot of hepatocellular carcinoma(HCC)and liver cirrhosis(LC)patients′ sera in four analysis modes. The PCA score plots of RPLC-POS(A),RPLC-NEG(B),HILIC-POS(C)and HILIC-NEG(D)were performed using EZinfo software to evaluate the degree of separation between HCC and LC groups,and the similarity within HCC group or LC group.This figure shows the distribution of each sample in the coordinate composed of two principal components t[1]and t[2],and each point represents a serum sample.
2.4 差异代谢物筛选
为获得可靠的差异代谢物,本研究采用了比较严格的筛选条件。首先,2组数据之间ANOVA分析P值<0.05;其次基于OPLS-DA 分析的VIP 值≥1;最后,HCC 与LC 比较,FC≥1.5 或≤0.67。应用上述3 个条件筛选,RPLC-POS,RPLC-NEG,HILICPOS 及HILIC-NEG 分别得到154,162,61 和94 个差异代谢物,4种方式共定量差异代谢物438个,主要包括胆汁酸(18 个)、游离脂肪酸(34 个)、磷脂(46 个)和小肽(33 个)。这些差异代谢物的重复性和互补性见图5。表2列出了最显著的50个差异代谢物的信息。
2.5 通路分析

Fig.5 Venn diagram of differential metabolites in RPLC-POS,RPLC-NEG,HlLlC-POS and HlLlC-NEG modes.Venn diagram displays the differential metabolites in four analysis modes of all samples based on UPLC-QTOF-MS/MS.Non-overlapping part of the figure is unique to each group,the overlapping part is common to each group,and the numbers are shown.
为进一步探究差异代谢物的生物学功能,对所有差异代谢物进行了通路分析。图6展示了通路分析结果。P<0.05 或影响值(pathway impact)≥0.1通常认为差异显著。符合上述条件的通路有12个,其中P<0.05的代谢通路是鞘磷脂代谢,其余包括三羧酸循环、半胱氨酸和蛋氨酸代谢、甘油磷脂代谢、α-亚麻酸代谢、苯丙氨酸、酪氨酸和色氨酸的生物合成等代谢通路的影响值均≥0.1,其中鞘磷脂代谢、半胱氨酸和蛋氨酸代谢、三羧酸循环和甘油磷脂代谢均显著上调,代谢相关网络见图7。

Fig.6 Pathway analysis results obtained by Metabo-Analyst.Each bubble indicates one pathway.The bubble color was used to represent the P value of this metabolic pathway(the redder the bubble,the smaller the P value),and the bubble size was used to represent the pathway impact value(it was calculated by adding up the importance measures of each of the matched metabolites and then dividing by the sum of the importance measures of all metabolites in each pathway).a:sphingolipid metabolism;b:phenylalanine,tyrosine and tryptophan biosynthesis;c:riboflavin metabolism;d:glycerophospholipid metabolism;e:α-linolenic acid metabolism;f:sulfur metabolism;g:citrate cycle(TCA cycle);h:β-alanine metabolism;i:tyrosine metabolism;j:cysteine and methionine metabolism;k:porphyrin and chlorophyll metabolism;l:terpenoid backbone biosynthesis.
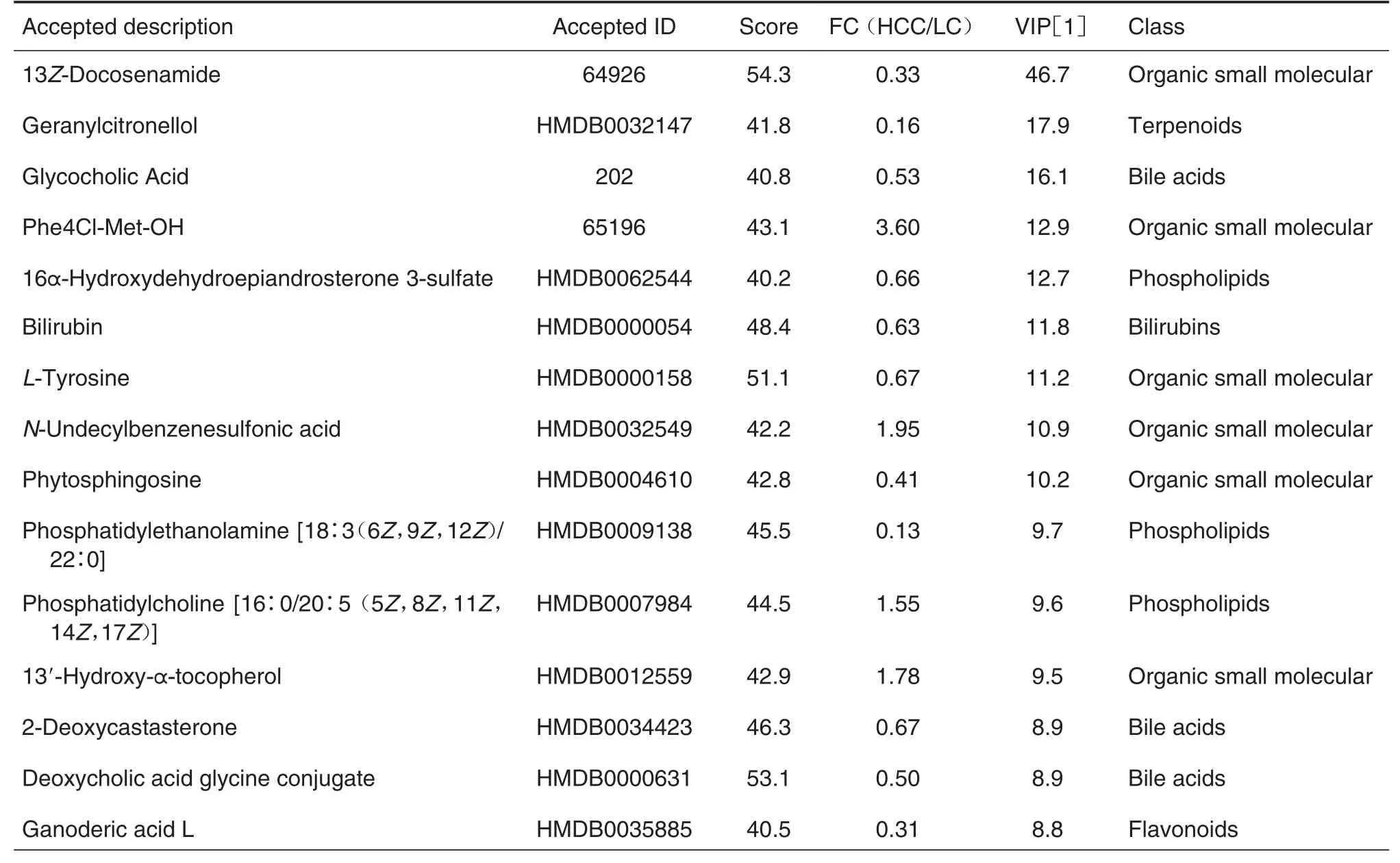
Tab.2 lnformation of top 50 differential metabolites
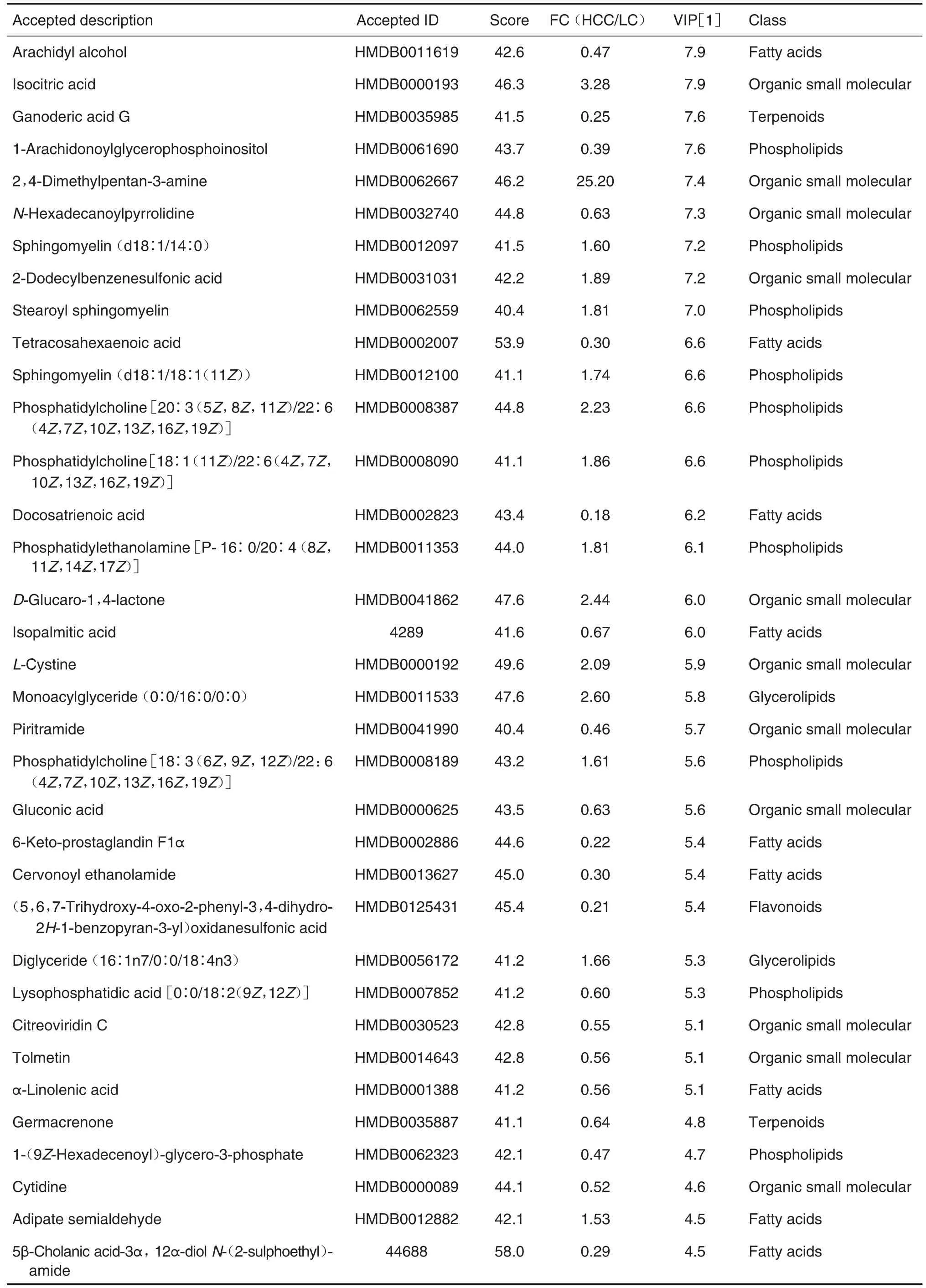
续表2

Fig.7 Metabolic network of significantly changed metabolism pathways constructed using metabolic pathway analysis(MetPA).The detailed construction of the altered metabolism pathways of sphingolipid metabolism(A),citrate cycle(TCA cycle)(B),cysteine and methionine metabolism(C)and glycerophospholipid metabolism(D).Red metabolites represent the differential metabolites that have been be quantified,blue metabolites represent those that have not been quantified,and the red metabolites can be directly linked to KEGG.
3 讨论
应用UPLC-QTOF-MS/MS 技术对HCC 和LC血清的非靶向代谢组比较研究表明,HCC患者血清代谢谱发生显著变化。通过PCA,OPLS-DA 及ANOVA 等多元统计分析,共筛选出438 个差异代谢物,其中差异最显著的代谢物是潜在的早期诊断标志物。与文献报道相比较,本研究鉴定的代谢物及差异代谢物数量均有显著增加[15,18,20,23-25]。PATTERSON 等[15]应用UPLC-ESI-QTOF-MS、UPLC-ESI-TQ-MS 和GC-MS 联用技术对20 例HCC、17例LC、22例白血病患者及6例健康对照的血浆代谢组进行了比较研究,共鉴定到20个差异代谢物。差异代谢物主要是溶血磷脂酰胆碱(lysophosphatidylcholines,LPC)和胆汁酸。TAN 等[18]应用LC-MS 技术对262 例HCC、76 例LC 和74 例肝炎患者的血清进行了代谢组研究,鉴定了52个差异代谢物,其中牛磺胆酸(taurocholic acid,TCA)、溶血磷脂酰乙醇胺16∶0(lysophosphatidylethanolamine 16∶0,LPE 16∶0)和LPC 22∶5 作为标志物能够用于区分HCC,LC和肝炎患者。GAO等[20]应用GC-TOF-MS 技术进行了HCC、LC、乙型肝炎患者及健康对照的血清比较代谢组研究,发现15个差异代谢物与肝病的进展相关,包括氨基酸、脂肪酸和有机酸。许国旺团队[23]招募了1 448 名受试者,包括健康对照、慢性乙型肝炎病毒感染、HCC和LC患者,利用LC-MS 研究受试者的代谢谱,筛选出的血清代谢生物标志物组苯丙基色氨酸和甘胆酸,联合AFP在临床诊断前能更好地预测临床前HCC的风险。此外,他们采用GC-MS 对射频消融术(radiofrequency ablation,RFA)治疗前后复发患者和非复发患者的血清样本进行代谢组学分析,提示联合使用谷氨酸和天门冬氨酸以及联合使用甘油和脯氨酸可能分别是预测HCC在RFA治疗前后复发的潜在生物标志物[24]。KIM等[25]应用GC-MS和LC-MS 对53 例早期HCC、47 例LC 患者和50 例健康人血清作为训练集,82 例早期HCC 和80 名LC样本作为验证集,发现5种代谢物(蛋氨酸、脯氨酸、鸟氨酸、肉碱和辛酰肉碱)作为一个代谢标志物组明显优于AFP。
本研究代谢物的鉴定率增加的原因主要有2个。首先是本研究对每个样本进行了4种模式的测定,RPLC和HILIC分离相互补充,质谱的正负离子化方式也互相补充,因此大大提高代谢物鉴定覆盖率;其次是高分辨的TripleTOFTM6600 扫描速度快,灵敏度高也是提高代谢物鉴定率的重要因素之一。
通路分析能够揭示差异代谢物的生物学功能及其之间的关系。差异代谢物的通路分析表明,与LC 相比,HCC 患者血清中变化最显著的代谢通路是鞘磷脂代谢,通路中有4个代谢物显著变化,包括二氢神经鞘氨醇磷酸酯、鞘氨醇磷酸酯、鞘磷脂和鞘氨醇。除鞘氨醇下降2.5倍外,其余3个代谢物的量都增加,变化倍数在1.8~10.55,VIP值在1.3~7.0之间。与LC 相比较,鞘氨醇在HCC 血清中的下降已有报道[35]。前期的血清代谢组研究也报道了1-磷酸鞘氨醇在HCC 血清中的增加[6]。本研究中鞘氨醇和1-磷酸鞘氨醇的变化趋势与文献报道的一致[35]。这5个鞘脂代谢物是潜在的早期诊断标志物,VIP 值较高的鞘氨醇和鞘磷脂值得进一步验证。鞘磷脂代谢与粘膜保护,炎症及肿瘤发生的关系已有报道[30,36]。鞘磷脂代谢在HCC和LC发生发展中的作用值得深入研究。
在本研究中,19 个胆汁酸相关代谢物在HCC患者血清中的量发生显著改变,其中12个胆汁酸的量降低,7 个升高。其中变化最显著的是甘胆酸(glycocholic acid,GCA),在RPLC-POS,RPLCNEG 和HILIC-NEG 3种模式下均检测出且变化倍数一致,与LC 相比下降2 倍。VIP 值分别为8.0,16.0 和33.0。另外2 个差异显著代谢物2-脱氧栗甾酮和脱氧胆酸甘氨酸偶联物,VIP 值均为8.9。VIP 越大,表示对LC 和HCC 患者区分的贡献越大。因此,这3个代谢物是潜在的HCC早期诊断标志物。TCA的变化倍数为0.48,VIP为1.9。胆汁酸量的异常与LC和肝炎有一定的联系。与正常健康对照相比较,肝病患者血清中的胆汁酸增加已被报道,包括甘氨脱氧胆酸(glycodeoxycholic acid,GDCA)、GCA、TCA 和鹅去氧胆酸(chenodeoxycholic acid,CDCA)[34]。但是与LC相比较,HCC患者血清中的胆酸是下降的,主要有GCA、GDCA、TCA 和牛磺鹅去氧胆酸(taurochenodeoxycholic acid,TCDCA)[6,35],这与本研究结果一致。肝癌患者癌与癌旁组织代谢组学研究表明,癌组织中的胆酸也是下降[37],与前期的研究相比较,本研究鉴定并定量了更多的胆汁酸相关代谢物,进一步确认了胆酸代谢紊乱对HCC 和LC 发生发展的影响。GCA、2-脱氧栗甾酮、脱氧胆酸甘氨酸偶联物和TCA是潜在早期临床诊断标志物,其临床转化应用需要大规模临床样本的验证。
在本研究中,胆红素在RPLC-NEG,HILICPOS和HILIC-NEG 3种模式中都差异显著,变化趋势一致,变化倍数分别为0.63,0.63和0.47。VIP值为1.8,11.8 和14.3。胆绿素在RPLC-NEG 中也显示差异,变化趋势与胆红素一致。PATTERSON等[15]报道,与HCC患者相比较,LC患者血清中的胆红素和胆绿素的量均升高。根据离子强度,胆红素升高约3 倍,胆绿素升高约10 倍,与本研究结果一致。根据VIP值判断,胆红素更有利于区分HCC和LC。胆红素来自红细胞的血红蛋白中血红素的断裂,其经氧化变为胆绿素[33]。SNYDER等[26,31]研究表明,胆红素可以保护细胞来自增加10 000倍过氧化氢引起的氧化应激。临床中血清胆红素在肝胆疾病以及血液疾病的诊断中有着非常重要的作用,而在生理条件下胆红素则被视为是一种天然的抗氧化剂,可对氧自由基进行清除,促使脂质过氧化得到有效抑制,进而更好地实现对炎症反应的控制和应激反应的对抗[38]。另外,有报道认为血浆中氧化型胆红素的升高能降低肝癌复发的风险[27]。胆红素在肝病各阶段的作用机制及治疗靶标的价值值得深入研究[33]。血清胆红素和胆绿素对肝癌早期诊断的临床价值值得进一步验证。
差异代谢物中,磷脂类代谢物数目最多,包括15 个磷脂酰乙醇胺(phosphatidylethanolamine,PE),7个磷脂酰丝氨酸(phosphatidylserine,PS),5 个磷脂酰胆碱类(phosphatidylcholines,PC),2 个磷脂酰甘油(phosphatidylglycerol,PG),2 个溶血磷脂酸(lysobisphosphatidic acid,LPA),2 个溶血磷脂酰乙醇胺(lysophosphatidylethanolamine,LPE),1 个磷脂酸(phosphatidic acid,PA)。5 种PC 在HCC 患者血清中的量均高于LC 患者血清中的量,变化差异倍数从1.55 到6.86,VIP 值从1.1 到9.6,表明PC 对HCC 和LC 的区分有重要贡献。PC 在HCC 患者血清中的升高与文献报道一致,尽管是不同种类的PC[32]。15 个PE 中有13 个的量在HCC血清高于LC血清,只有2个PE的量在HCC组中降低,分别是PE〔18∶3(6Z,9Z,12Z)/22∶0〕和PE(14∶0/14∶0),变化倍数为0.13和0.54。其中升高变化倍数最大的PE〔22∶5(4Z,7Z,10Z,13Z,16Z)/20∶4(5Z,8Z,11Z,14Z)〕升高了20.89 倍。VIP 值的范围在1.0~9.7 之间。在HCC 和LC 之间7 个PS 显著变化,其中4 个量下降,3 个量升高,变化倍数在1.5~3.9 之间。PC,PE 和PS 之间能够相互转化[29],因此,总体来讲磷脂是在HCC 血清中显著增加。文献报道,PC和PE在肿瘤组织种的量显著增加[37],与本研究结果一致。可能是由于技术方法的不同,早期的HCC代谢组学研究鉴定和定量的差异PE和PS较少,主要是PC和LPC[18]。2个PG,1个在HCC血清中的量增加,另1个量减少。另外,有2个LPE和2个LPA的量在HCC血清中降低,降低倍数分别为0.63,0.23,0.47 和0.6。VIP 值在1.8~5.3 之间。PC 在肿瘤进展中发挥重要作用,其生物合成研究得较为深入。PE 在肿瘤进展中的作用及其生物合成相对较少[28]。合成PE的中间代谢物磷酸乙醇胺积累有利于谷氨酰胺饥饿条件下肿瘤细胞的生长[29]。本研究结果表明,磷脂代谢在HCC发生发展过程中显著失调,靶向磷脂代谢通路有可能找到新的HCC 治疗方法。变化显著的磷脂代谢物(表2)是潜在的诊断标志物,其临床应用价值有待进一步验证。
本研究中,游离脂肪酸是另一类数目最多的差异代谢物,共检测到25个游离脂肪酸,其中17个在HCC 血清中的量比LC 血清中低,8 个较LC 高。VIP值>5的4个游离脂肪酸分别为二十四碳六烯酸、二十二碳三烯酸、异棕榈酸和香芹酮酰乙醇胺α-亚麻脂酸。游离脂肪酸的降低与我们前期的HCC蛋白组研究结果一致,HCC 组织中脂肪酸的β-氧化降低[20]。游离脂肪酸的失调在HCC组织与癌旁组织的代谢组学研究已有报道,不同的脂肪酸变化趋势不同,α-亚麻脂酸在HCC组织中下降约3倍,在受试者工作特征曲线(receiver operating characteristic curve,ROC)分析中单独的曲线下面积(area under the curve,AUC)为0.783,具有较高的区分能力[39]。在本研究中,与LC患者血清中的α-亚麻脂酸相比较,HCC血清中α-亚麻脂酸下调近2倍,VIP值5.4,在2组分组中有较大贡献,与上述HCC组织中的结果一致。
与文献报道不同,本研究测定的差异代谢物包含了33个小肽,主要是二肽,也有少量的四肽。33个小肽中,只有6 个小肽的量在HCC 血清中升高,其余27 个均降低。这些小肽的来源、变化及在HCC发生发展中功能尚不清楚,有待进一步探索,小肽的鉴定是通过检索Metlin 数据库实现的。另外,本研究还检测到了10个甘油酯类化合物,8个甘油二酯,2 个单酰基甘油,它们的量在HCC 血清中均升高。甘油三酯升高与肝功受损有关,推测这10个甘油酯类代谢物的升高与甘油三酯的升高作用相似。小肽和甘油酯类代谢物的鉴定及差异尚未见文献报道,这主要源于本研究采用技术的高灵敏以及数据库的不断完善。
总之,应用基于UPLC-QTOF-MS/MS 的技术,对50例HCC及50例LC患者血清代谢组进行了深入研究,共检测到差异代谢物7 848个;采用严格的筛选条件,筛选出438个差异代谢物。据我们所知,这是目前HCC血清代谢组鉴定代谢物最多的研究,主要是由于本研究应用RPLC 和HILIC 2种方式分离代谢物,且高分辨质谱仪TripleTOFTM6600 具有灵敏度高和扫描速度快的优点。这些差异代谢物涉及45 个代谢通路,其中12 个通路显著变化。变化最显著的50 个差异代谢物具有较高的早期诊断价值,值得进一步在临床大样本中确认并转化。另外,该研究也为揭示HCC发生发展的机制及寻找新的治疗靶点提供了丰富的资源。

