姜黄素抑制动力相关蛋白1介导的线粒体分裂抗H9c2细胞低氧复氧损伤
牟幼灵,吕京珂,赵瑞,韩丽萍,刘骞
(浙江中医药大学药学院,浙江杭州 311402)
急性心肌梗死的发病率和致死率一直居高不下,目前公认的治疗手段是恢复血流再灌注以减少梗死区心肌坏死,然而再灌注过程诱发的一系列心肌损伤却缺少有效的临床干预方法[1]。心肌缺血再灌注(ischemia/reperfusion,I/R)损伤是多种病理机制共同作用的结果,主要包括炎症[2]、线粒体障碍[3]、氧化应激[4]和微血管障碍[5]等。心脏的高能量需求使得心肌细胞内线粒体比例高于其他脏器,维持线粒体稳态在心肌I/R损伤的治疗中具有重要作用[6]。研究发现,心肌I/R损伤与线粒体分裂/融合动态平衡有密切关系[7],再灌注阶段动力相关蛋白1(dynamin-related protein 1,Drp1)激活并参与心肌细胞线粒体的过度分裂,导致线粒体片段化和功能障碍,进一步加重心肌细胞死亡[8]。因此,有效抑制线粒体过度分裂已成为I/R 损伤心肌保护的研究重点,探明线粒体稳态在心肌I/R 损伤中的作用机制将有助于减少心肌细胞死亡提高心梗患者预后。
姜黄(Curcuma longaL.)原产于印度,除作为香料外,还广泛应用于咳嗽、糖尿病性溃疡、肝胆疾病和关节炎等疾病的治疗,属于药食两用的药材[8]。姜黄素(curcumin,Cur)是姜黄的活性成分之一,具有抗炎[9]、抗氧化[10]、降糖[11]、抗衰老[12]和抗肿瘤[13]等多种药理活性。研究认为,Cur 可能通过抑制心肌细胞炎症[14]、氧化应激[15]和凋亡[16]维持心肌细胞结构和功能,通过Notch[17]和沉默调节蛋白3(silent mating type information regulation 2 homolog 3,SIRT3)[18]等信号通路减轻心肌细胞损伤并改善I/R 后心功能。有报道Cur 可减轻星形胶质细胞氧化应激造成的线粒体损伤和功能障碍[19],对I/R 后心肌细胞线粒体也有保护作用[20],但对线粒体形态的影响仍有待进一步研究。因此,本研究拟通过大鼠心肌细胞H9c2 低氧复氧(hypoxia/reoxygenation,H/R)损伤模型探讨Cur是否通过抑制线粒体分裂维持线粒体完整性和功能,从而减轻细胞凋亡并发挥心肌细胞保护作用,以期进一步揭示Cur 对心肌I/R损伤保护的作用机制。
1 材料与方法
1.1 药物、试剂和主要仪器
Cur(CAS 号458-37-7,批号110823-201706,HPLC 纯度≥98%,中国食品药品检定研究院);胎牛血清、DMEM 培养基和胰蛋白酶(美国Gibco 公司);乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒和丙二醛(malondialdehyde,MDA)测定试剂盒(南京建成生物工程研究所);BCA蛋白浓度测定试剂盒、DAPI荧光探针、ATP检测试剂盒、兔抗大鼠电压依赖性阴离子通道蛋白1(voltage-dependent anion channel protein1,VDAC1)单克隆抗体、兔抗大鼠β 肌动蛋白单克隆抗体和辣根过氧化物酶标记山羊抗兔IgG(H+L)抗体(上海碧云天生物技术有限公司);DHE 荧光探针、Mito-Tracker荧光探针和JC-1荧光探针(美国Invitrogen公司);Calcein-AM 荧光探针(美国Life Technologies公司);TUNEL检测试剂盒(美国Roche公司);兔抗大鼠细胞色素c 单克隆抗体(美国Abcam 公司);兔抗大鼠活化胱天蛋白酶3 单克隆抗体、兔抗大鼠Drp1 单克隆抗体和兔抗大鼠丝氨酸616 位点磷酸化Drp1(phospho-Drp1,p-Drp1)单克隆抗体(美国Cell Signaling Technology 公司);Spectra-Max 190 全波长酶标仪(美国MD 公司);Olympus IX71 荧光显微镜(日本Olympus 公司);LSM 880共聚焦激光扫描显微镜(德国Carl Zeiss公司)。
1.2 细胞和分组
H9c2细胞(中国科学院细胞库)置37℃,5%CO2培养箱中,用含10%FBS的DMEM培养液培养。使用胰蛋白酶消化对数生长期细胞,以每孔5×103密度接种于96 孔板或以每孔5×104密度接种于6 孔板。细胞分为5组:细胞对照组、H/R组、H/R+Cur 1,5和10 μmol·L-1组;Cur预处理H9c2细胞12 h,在低氧小室内以低氧条件(94%N2∶5%CO2∶1%O2)孵育16 h,再置于正常培养环境复氧培养2 h,建立H/R损伤模型。
1.3 CCK-8法检测细胞存活率
取1.2 分组细胞,加CCK-8 溶液至每孔终浓度为10%,继续孵育2 h,酶标仪测定450 nm 处吸光度(A450nm)值,计算细胞存活率。细胞存活率(%)=(实验组A450nm-空白组A450nm)/(细胞对照组A450nm-空白组A450nm)×100%。
1.4 LDH漏出量、SOD活性和MDA含量检测
取1.2 分组细胞,分别按试剂盒检测说明书测定细胞培养液中LDH 漏出量、细胞SOD 活性和MDA含量。采用BCA蛋白浓度测定试剂盒测定各孔细胞总蛋白量,以每g 蛋白样品中SOD 活性和MDA含量进行统计分析。
1.5 DHE 探针检测细胞内活性氧(reactive oxygen species,ROS)水平
取1.2分组细胞,加DHE 荧光探针10 μmol·L-1避光孵育30 min。经PBS润洗后,荧光显微镜随机视野拍照并统计荧光强度。
1.6 MitoTracker探针检测线粒体形态、长度和密度
细胞分为3 组:细胞对照、H/R 组和H/R+Cur 10 μmol·L-1组,加MitoTracker荧光探针100 μmol·L-1染色线粒体30 min,PBS 润洗后,激光共聚焦显微镜观察各组细胞线粒体形态并拍照,检测线粒体平均长度(μm)和密度(每100 μm2内线粒体数量)。
1.7 Calcein-AM 探针荧光强度评价线粒体通透性转换孔开放程度
按1.6 分组细胞,加Calcein-AM 荧光探针1 μmol·L-1和氯化钴2 mmol·L-1孵育20 min,PBS润洗后,荧光显微镜随机视野拍照并统计Calcein绿色荧光强度,用荧光强度表示线粒体通透性转换孔开放。
1.8 JC-1探针检测线粒体膜电位
按1.6 分组细胞,加JC-1 荧光探针2.5 mg·L-1孵育20 min,PBS 润洗后,荧光显微镜随机视野拍照,JC-1 聚合体(红色)/JC-1 单体(绿色)荧光强度比值表示线粒体膜电位。
1.9 细胞内ATP含量测定
按1.6分组细胞,按试剂盒检测说明测定细胞内ATP含量。采用BCA蛋白浓度测定试剂盒测定细胞总蛋白量,以每mg蛋白样品中ATP含量进行统计分析。
1.10 TUNEL染色检测细胞凋亡
取1.6 分组细胞,按照试剂盒检测说明测定TUNEL 阳性细胞数量,同时加DAPI 荧光探针5 mg·L-1孵育5 min,PBS润洗后,荧光显微镜随机视野拍照并统计TUNEL 阳性细胞和DAPI 阳性细胞,计算细胞凋亡率。细胞凋亡率(%)=TUNEL 和DAPI双阳性细胞数/DAPI阳性细胞数×100%。
1.11 Western 印迹法检测细胞内Drp1、p-Drp1、活化胱天蛋白酶3、胞浆细胞色素c 和线粒体内细胞色素c蛋白表达
取1.6 分组细胞,使用含蛋白酶和磷酸酶抑制剂的裂解液于冰上裂解H9c2 细胞,BCA 法测定蛋白浓度。各实验组以等量总蛋白进行SDS-PAGE分离,电泳结束后转移至PVDF 膜上。经10%脱脂牛奶封闭后,分别使用Drp1(1∶1000)、p-Drp1(1∶1000)、细胞色素c(1∶1000)及活化胱天蛋白酶3(1∶1000)一抗和相应二抗(1∶4000)检测目的蛋白,β 肌动蛋白作为细胞总蛋白的内参,VDAC1 作为线粒体总蛋白的内参,以目标蛋白与内参积分吸光度值比值表示蛋白相对表达水平。
1.12 统计学分析
所有实验均独立重复3次,使用Minitab 14 软件进行数据分析,实验结果数据以表示,进行单因素方差分析,两组间比较采用t检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 Cur对H/R诱导H9c2细胞存活率的影响
如表1 所示,与细胞对照比较,H/R处理后细胞存活率显著下降(P<0.01);与H/R组比较,H/R+Cur 5和10 μmol·L-1组细胞存活率显著提升(P<0.01)。

Tab.1 Effect of curcumin(Cur)on cell viability of H9c2 cells exposed to hypoxia/reoxygenation(H/R)injury by CCK-8 kit
2.2 Cur 对H/R 诱导H9c2 细胞LDH 漏出量、SOD活性和MDA含量的影响
如表2 所示,与细胞对照比较,H/R 处理后H9c2细胞LDH漏出增多(P<0.01),SOD活性降低(P<0.01),MDA 含量增加(P<0.01);与H/R 组比较,H/R+Cur 5 μmol·L-1组LDH 漏出显著降低(P<0.05),MDA含量显著降低(P<0.05);H/R+Cur 10 μmol·L-1组LDH 漏出显著降低(P<0.01),SOD活性显著升高(P<0.01),MDA 含量显著降低(P<0.01),提示Cur 10 μmol·L-1能显著减轻细胞损伤和氧化应激。
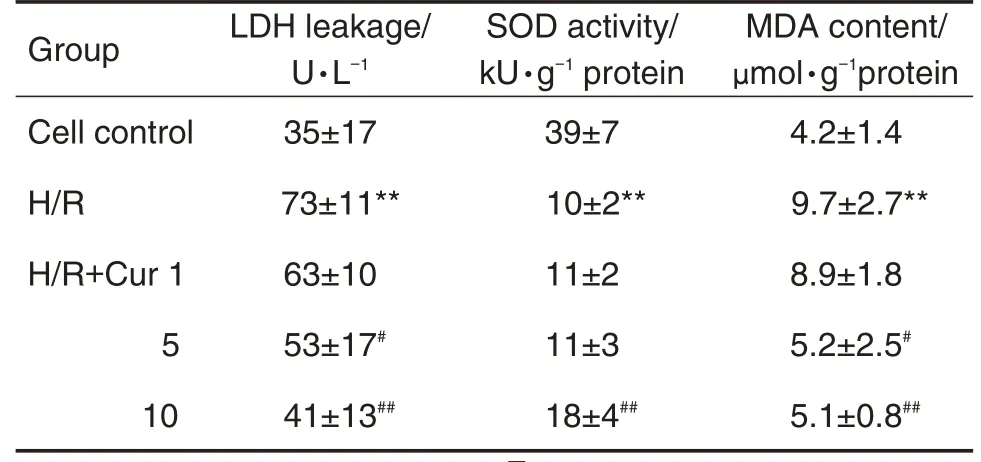
Tab.2 Effect of Cur on lactate dehydrogenase(LDH)leakage,superoxide dismutase(SOD)activity,and malondialdehyde(MDA)content in H9c2 cells exposed to H/R injury
2.3 Cur对H/R诱导H9c2细胞内ROS水平的影响
如图1 结果所示,与细胞对照(260±28)比较,H/R组细胞内ROS水平显著增加(P<0.01);与H/R组比较,H/R+Cur 5 和10 μmol·L-1组细胞内ROS水平显著降低(P<0.05,P<0.01)。结合2.1 和2.2实验结果,Cur 10 μmol·L-1表现出显著细胞保护和抗氧化作用,因此,后续实验选择Cur 10 μmol·L-1研究其对H9c2细胞线粒体形态和功能的影响及作用机制。

Fig.1 Effect of Cur on reactive oxygen species(ROS)level in H9c2 cells exposed to H/R injury by DHE staining.See Tab.1 for the cell treatment.B was the semiquantitative result of A. ,n=6.**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with H/R group.
2.4 Cur对H/R诱导H9c2细胞线粒体形态、长度和密度的影响
如图2结果所示,与细胞对照组比,H/R组细胞线粒体分裂增加,线粒体平均长度减少(P<0.01),线粒体密度显著降低(P<0.01);与H/R 组相比,H/R+Cur 10 μmol·L-1组线粒体平均长度增加(P<0.05),线粒体密度显著增加(P<0.05)。
2.5 Cur 对H/R 诱导H9c2 细胞线粒体通透性转换孔开放程度的影响
如图3所示,与细胞对照细胞比较(62±8),H/R组线粒体内Calcein绿色荧光强度显著降低(18±7,P<0.01),提示线粒体通透性转换孔开放增加;与H/R组相比,H/R+Cur 10 μmol·L-1组线粒体绿色荧光强度显著增加(32±8,P<0.01),提示线粒体通透性转换孔开放程度降低。
2.6 Cur对H/R诱导H9c2细胞线粒体膜电位的影响
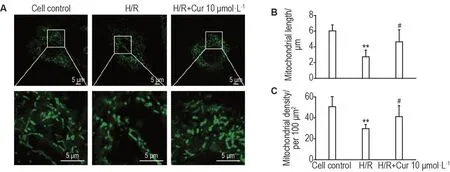
Fig.2 Effect of Cur on mitochondrial morphology,length and density in H9c2 cells exposed to H/R injury by MitoTracker staining.H9c2 cells were treated with Cur 10 μmol·L-1 before H/R injury,and mitochondrial morphology was detected by MitoTracker(green).A was the representative fluorescence images of mitochondrial morphology.B and C were the semi-quantitative results of mitochondrial length and density,respectively.,n=60(cells from three biological replicates).**P<0.01,compared with cell control group;#P<0.05,compared with H/R group.
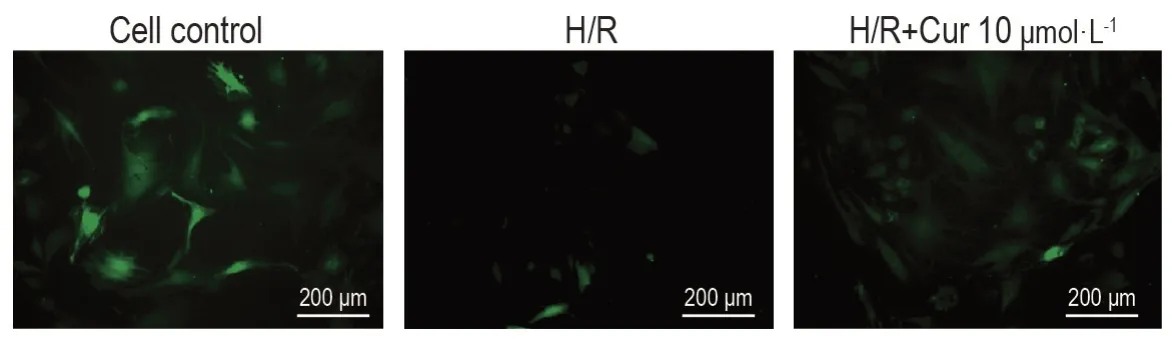
Fig.3 Effect of Cur on mitochondrial permeability transition pore opening in H9c2 cells exposed to H/R injury by Calcein-AM(green).See Fig.2 for the cell treatment.

Fig.4 Effect of Cur on mitochondrial transmembrane potential in H9c2 cells exposed to H/R injury by JC-1 staining.See Fig.2 for the cell treatment.
如图4 所示,与细胞对照比较(3.3±0.8),H/R组JC-1 红色荧光/绿色荧光强度显著降低(0.5±0.2,P<0.01),提示线粒体膜电位去极化(图4);与H/R 组相比,H/R+Cur 10 μmol·L-1组JC-1 红色荧光/绿色荧光强度显著增加(1.5±0.5,P<0.01),表明线粒体膜电位极化水平升高。
2.7 Cur对H/R诱导H9c2细胞ATP含量的影响
如表3 所示,与细胞对照组相比,H/R 组H9c2细胞内ATP 含量显著降低(P<0.01);与H/R 组相比,H/R+Cur 10 μmol·L-1组ATP含量显著增加(P<0.05)。

Tab.3 Effect of Cur on ATP content in H9c2 cells exposed to H/R injury
2.8 Cur对H/R诱导H9c2细胞凋亡的影响
如图5 所示,与细胞对照组相比(3.3±1.8)%,H/R 组TUNEL 和DAPI 双阳性细胞比例明显增加〔(34.9±6.8)%,P<0.01〕,提示大量心肌细胞发生凋亡;与H/R 组比较,H/R+Cur 10 μmol·L-1组细胞凋亡率显著降低〔(19.6±5.8)%,P<0.01〕。

Fig.5 Effect of Cur on apoptosis of H9c2 cells exposed to H/R injury by TUNEL staining.See Fig.3 for the cell treatment.
2.9 Cur 对H/R 诱导H9c2 细胞Drp1、p-Drp1、活化胱天蛋白酶3、胞浆细胞色素c 和线粒体细胞色素c蛋白表达的影响
如图6 所示,与细胞对照组相比,H/R 组Drp1、p-Drp1和活化胱天蛋白酶3蛋白表达明显升高(P<0.01),细胞色素c 从线粒体释放到细胞浆显著增加(P<0.01,P<0.05);与H/R 组比较,H/R+Cur 10 μmol·L-1组Drp1、p-Drp1 和活化胱天蛋白酶3蛋白表达显著降低(P<0.05),细胞色素c 由线粒体释放到细胞浆显著减少(P<0.05)。
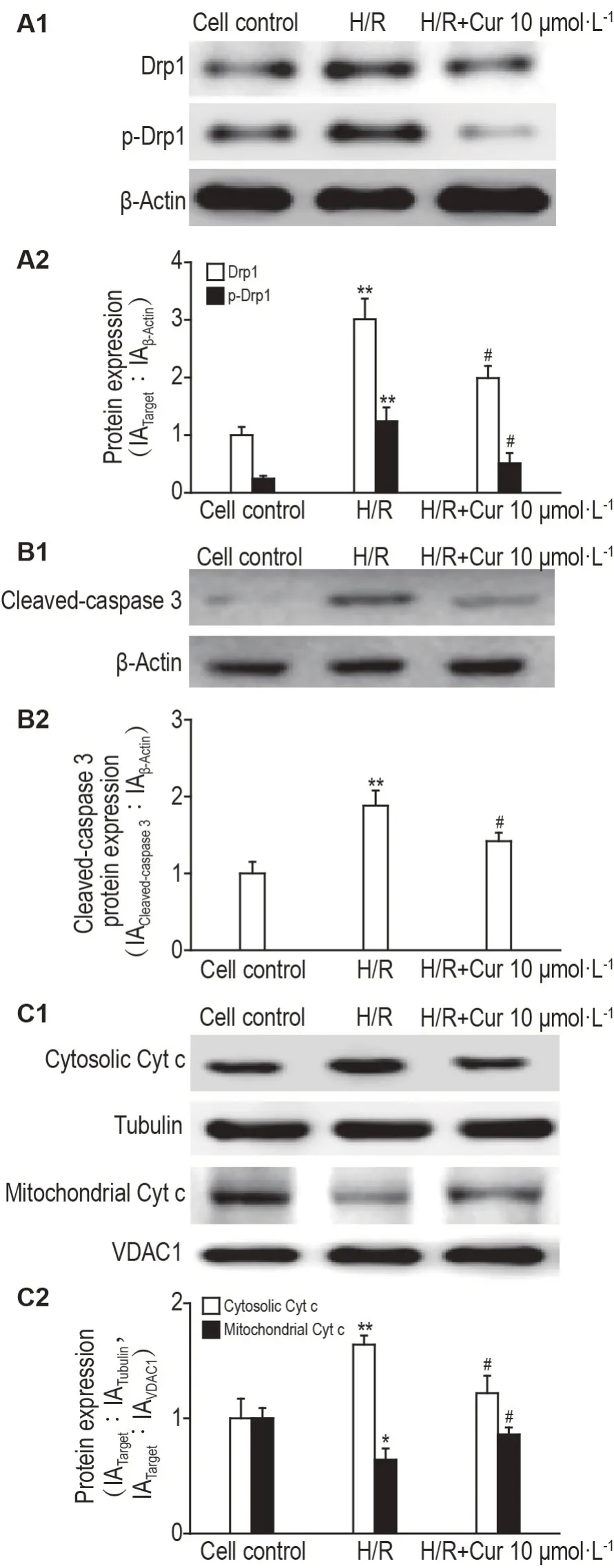
Fig.6 Effects of Cur on protein expressions of dynaminrelated protein 1(Drp 1),phospho-Drp 1(P-Drp1),cleaved-caspase3,cytosolic cytochrome c(Cyt c)and mitochondrial Cyt c in H9c2 cells exposed to H/R injury by Western blotting.See Fig.2 for the cell treatment.A2,B2 and C2 were the semi-quantitative results of A1,B2 and C2,respectively.VDAC1:voltage-dependent anion chanel protein 1. ,n=3.*P<0.05,**P<0.01,compared with cell control group;#P<0.05,compared with H/R group.
3 讨论
本研究发现,Cur可显著增加细胞存活率,减少LDH 泄漏,显著增加SOD 活性,降低细胞内MDA和ROS 含量,提示Cur 能减轻心肌细胞H/R 损伤。Cur 可显著增加线粒体长度和线粒体密度,抑制Drp1激活,降低线粒体通透性转换孔开放程度和细胞色素c 从线粒体到细胞浆的释放,增加线粒体膜电位极化和细胞ATP 水平,显著降低细胞凋亡率。提示Cur 可调控线粒体过度分裂,减轻线粒体功能障碍和细胞凋亡。
线粒体是细胞内ROS的主要来源,受损的线粒体会形成“合成过量ROS-加剧线粒体损伤-ROS合成过量”的恶性循环,直至线粒体凋亡和细胞死亡。本研究发现,Cur可降低细胞氧化应激损伤,此现象可能与线粒体保护作用有关。线粒体除作为细胞能量源外,还具有调节细胞免疫、钙稳态和自噬等作用,并通过调整其形态的分裂/融合动态平衡来发挥正常功能[21]。一旦线粒体分裂/融合动态失衡,过度分裂会导致线粒体片段化,从而造成线粒体功能障碍、细胞应激以及细胞死亡[22]。本研究发现,Cur 可抑制线粒体过度片段化,维持线粒体长度,增加线粒体密度。有研究认为,线粒体分裂与Drp1 蛋白的激活密切相关[23],Cur 可通过调节C2C12 成肌细胞[24]和衰老小鼠脑细胞[25]等多种细胞内Drp1 表达以维持线粒体分裂/融合动态平衡。本研究发现,Cur 可下调H9c2 细胞Drp1 表达和磷酸化水平,表明Cur可参与调控H9c2细胞线粒体分裂进程。线粒体作为ATP合成的主要细胞器,细胞内ATP水平是衡量线粒体功能的常用指标之一[26],本研究发现,Cur可增加ATP含量,表明其对线粒体功能具有一定的保护作用。线粒体通透性转换孔开放程度对于维持线粒体功能具有重要作用,过度开放会导致线粒体膜电位去极化,造成线粒体功能障碍[27]。此外,线粒体通透性转换孔过度开放还会导致细胞色素c 从线粒体释放到细胞质,诱导细胞凋亡。本研究发现,Cur 可降低线粒体通透性转换孔开放程度,维持线粒体膜电位极化,减少线粒体细胞色素c的释放,降低细胞凋亡率。
综上所述,Cur 可明显改善H9c2 细胞H/R 损伤,其机制可能与抑制Drp1 介导的线粒体分裂,维持线粒体功能,减轻氧化应激和细胞凋亡有关。但本研究均是在离体细胞中进行的,尚未在动物体内进行验证,并且是否与已报道的Notch 和SIRT3 等信号通路有关,或仍有其他调控机制的参与,还有待后续深入研究。

