双歧杆菌微胶囊的制备及其理化性能
李作美, 许晓云,刘琦
1(蚌埠学院 食品与生物工程学院,安徽 蚌埠,233030)2(中国科学技术大学 生命科学院,安徽 合肥, 230000)
益生菌(Probiotics)是一类对宿主有益的活性微生物,它黏附于生物肠道内,在与有害菌进行营养竞争的同时形成占位效应,可减少有害菌的定植[1-2]。其主要应用于食品、药品及保健品等领域,除可调节人体健康外,还可应用于动物体内,在提高产量、减少病死率等方面发挥着重要的作用[3-4]。
双歧杆菌常见于健康人体和暖血动物肠道内,可作为肠道益生菌单独使用,也可和其他益生菌复合使用,是一种具备多种生理活性、在开发益生菌产品方面具有巨大的潜力[5]。在食品行业中,双歧杆菌主要用于发酵乳制品的生产[6]。在药品保健品行业中,主要是制作成微胶囊,李来酉[7]将包括双歧杆菌在内的3种菌包埋,制作出了性能良好、储存性质稳定的三联菌微胶囊。另外双歧杆菌在家畜养殖方面也能发挥一定的作用,BARBA等[8]发现,给仔猪喂食含长双歧杆菌和乳双歧杆菌的微胶囊后,其采食量和绒毛/隐窝的比率及回肠乙酸浓度大大提高,因肠道不适而表现出的异常反应也有所改善。
双歧杆菌的生理活性需定植于肠道中才能被发挥出来,但双歧杆菌对酸、氧环境极为敏感,环境因素对其的影响是不可避免的[9]。因此,国内外多将双歧杆菌微囊化以降低其死亡率,这已成为双歧杆菌应用研究的重要方向[10-11]。合理运用微胶囊技术和壁材,可提高包埋率与稳定性,也可将微胶囊的粒径控制在一个合适的范围内[12-13]。
乳化法和挤压法在微胶囊实验领域应用较多[14]。乳化法因钙离子分布范围、扩散距离和通过液相的不同而分为内源乳化法和外源乳化法,常和冷冻干燥技术相结合[15]。有研究表明前者的包埋性能要优于后者[16],且内源乳化法制备出的微胶囊较外源乳化法来说球形度高、凹凸率低[17-18]。
微胶囊壁材种类繁多,性质各异,在壁材液中添加海藻酸钠,可提高双歧杆菌微胶囊在人工模拟消化液中的稳定性[19],在对其进行理化性质检测时表现出了良好的肠溶性[20]。以乳清蛋白作为壁材可提高微胶囊的缓冲能力[21],还可作为菌种的冻干保护剂,提高菌在冷冻干燥过程中的存活率[22]。可在酸性环境下与海藻酸钠发生静电反应,弥补其大孔结构,这样更容易拦截菌体并使菌体嵌合[23]。
本实验采用内源乳化法,旨在优化双歧杆菌微胶囊的制备工艺,以得到包埋率较高的湿胶囊和干胶囊;同时考察了湿胶囊和干胶囊在经过人工模拟消化液及消化道体系后的稳定性,为后续相关生产或研发奠定了基础。
1 材料与方法
1.1 菌种
双歧杆菌(Bifidobacteriumanimalsssp. Lactis),北京川秀有限公司。
1.2 培养基
改良MRS培养基,杭州百思生物科技有限公司。
1.3 试剂与仪器
海藻酸钠、低聚果糖、乳清蛋白、CaCO3、Span-80、冰醋酸、乙酸钠、NaCl、MRS培养基、PBS粉剂、Na2HPO4·12H2O、柠檬酸、HCl、胃蛋白酶、KH2PO4、胰蛋白酶、胆盐等均为分析纯,北京化工有限公司。
CVC FD8-5真空冷冻干燥机,Gold SIM International Group CO,LTD;H4-20KR台式高速冷冻离心机,湖南可成仪器设备有限公司;LRH-150-Ⅱ生化培养箱,广东省医疗器械厂;YXQ-LS-50SⅡ立式压力蒸汽灭菌器,上海博讯医疗生物仪器股份有限公司;ZNCL-T 250磁力搅拌器,巩义市子华仪器有限公司;JH-11-09可见分光光度计,上海菁华科技仪器有限公司。
1.4 双歧杆菌微胶囊的制备及单因素实验
1.4.1 实验材料的预处理
菌悬液的制备:将长双歧杆菌菌种活化后进行厌氧培养,在MRS培养基中加入半胱氨酸盐酸盐37 ℃恒温培养24 h,37 ℃下4 500 r/min离心15 min,收集菌泥,加入少量生理盐水混合均匀。进行梯度稀释,接着用平板计数法辅以血球板计数法检测菌悬液的活菌数,保证活菌数为109~1010CFU/mL,最后将稀释到合适梯度的双歧杆菌置于4 ℃冰箱保存备用。
壁材液的制备:将一定质量的海藻酸钠和乳清蛋白均匀混合于质量为10 g的pH 6.5的无菌PBS缓冲液中,在紫外灯下照射30 min,放置在无菌操作台备用。
芯材液的制备:将低聚果糖溶解在无菌水中制成质量分数为2.6%的溶液,再将其与菌悬液按体积比1∶1混合,放置备用。
1.4.2 主要溶液的配制
0.9%生理盐水:称取0.9 g NaCl,溶解在少量无菌水中,定容至100 mL。
醋酸溶液:取冰醋酸11.55 mL,加无菌水定容至1 L。
醋酸盐溶液:称取27.22 g的乙酸钠,加少量无菌水溶解后定容至1 L,用配制好的醋酸溶液调pH至5.5。
解囊液: 称取为35.8 g Na2HPO4·12H2O和10.5 g的柠檬酸,加纯净水定容至1 L,搅拌使之充分溶解,调pH为7.25,121 ℃高压灭菌20 min。
人工模拟胃液:取0.1 mol/L稀HCl溶液16.4 mL,先加适量无菌水溶解,再加胃蛋白酶10 g,最后定容至1 L,调节pH值为1.2,过0.22 μm滤膜除菌备用。
人工模拟胆盐溶液:取10 g胆盐溶于无菌水中定容至1 L,过0.22 μm滤膜除菌备用。
人工模拟肠液:称取KH2PO46.8 g,先加适量无菌水溶解;同时在另一烧杯中称取胰蛋白酶10 g,加适量无菌水使之溶解。将两液混合后,加无菌水定容至1 L,调节pH值为7.4,过0.22 μm滤膜除菌备用。
1.4.3 双歧杆菌微胶囊的制备方法
内源乳化法制备微胶囊的过程参照邓玉娣等[24]、张国芳等[25]报道的方法, 并在此基础上进行修改:将浓度不低于109CFU/mL的菌悬液与等体积的低聚果糖溶液混合均匀,制成芯材溶液,取与芯材溶液体积相同的壁材溶液,将其加入芯材溶液缓慢搅拌使之均相;将CaCO3粉末均匀地分散到该混合溶液中,然后再将此混合液乳化到含有体积分数1.0%的Span-80大豆油中(转速为400 r/min),15 min后,加入冰醋酸继续搅拌,以促进冰醋酸和CaCO3的接触反应;30 min后,再加入60 mL醋酸盐溶液(调pH为5.5),缓慢搅拌,静置约2 h,离心去油,收集微胶囊,生理盐水洗涤3次后4 ℃冰箱保存;取最优条件下的到的湿胶囊,先于-20 ℃预冻12 h,然后放入-60 ℃真空冷冻干燥机于冷冻干燥48 h,得到的冻干微胶囊-20 ℃保存[25]。
以下单因素试验按1.4.1的标准将备用的壁材液和芯材液混合,按1.4.3的步骤在5个100 mL烧杯中进行水相的均匀分散,在5个500 mL烧杯中完成油相的搅拌,接着进行后续的操作。
1.4.3.1 海藻酸钠的质量分数对湿胶囊包埋率的影响
海藻酸钠质量分数分别设为1%、2%、3%、4%、5%,其余因素分别为m(乳清蛋白)∶m(海藻酸钠)=1∶1,m(CaCO3)∶m(海藻酸钠)=1∶2,V(水相)∶V(油相)=1∶3,冰醋酸体积为400 μL。测湿胶囊的包埋率,获得海藻酸钠的最适质量分数。
1.4.3.2m(乳清蛋白)∶m(海藻酸钠)对湿胶囊包埋率的影响
m(乳清蛋白)∶m(海藻酸钠)分别设为5∶1、3∶1、1∶1、1∶3、1∶5,其余因素分别为海藻酸钠质量分数2%,m(CaCO3)∶m(海藻酸钠)=1∶2,V(水相):V(油相)=1∶3,冰醋酸体积为400 μL。测湿胶囊的包埋率,获得乳清蛋白和海藻酸钠的最适质量比。
1.4.3.3m(CaCO3)∶m(海藻酸钠)对湿胶囊包埋率的影响
m(CaCO3)∶m(海藻酸钠)分别设为1∶1、1∶2、1∶4、1∶6、1∶8,其余因素分别为海藻酸钠质量分数2%,m(乳清蛋白)∶m(海藻酸钠)=1∶1,V(水相)∶V(油相)=1∶3,冰醋酸体积为400 μL。测湿胶囊的包埋率,获得CaCO3和海藻酸钠的最适质量比。
1.4.3.4V(水相)∶V(油相)对湿胶囊包埋率的影响
V(水相)∶V(油相)分别设为1∶1、1∶2、1∶3、1∶5、1∶7,其余因素分别为:海藻酸钠质量分数为2%,m(乳清蛋白)∶m(海藻酸钠)=1∶1,m(CaCO3)∶m(海藻酸钠)=1∶2,冰醋酸体积为400 μL。测湿胶囊的包埋率,获得水相和油相的最适体积比。
1.4.3.5 冰醋酸体积对湿胶囊包埋率的影响
冰醋酸体积分别设为200、400、600、800、1 000 μL,其余因素分别为海藻酸钠浓度为2%,m(乳清蛋白)∶m(海藻酸钠)=1∶1,m(CaCO3)∶m(海藻酸钠)=1∶2,V(水相)∶V(油相)=1∶3。测湿胶囊的包埋率,获得冰醋酸的最适体积。
1.4.4 总菌数与包埋率的计算
1.4.4.1 总菌数的计算公式
总菌数计算如公式(1)所示:
(1)
式中:A,5个中方格的总菌数;B,稀释倍数。
1.4.4.2 包埋产率的计算公式
包埋产率计算如公式(2)所示:

(2)
式中:G1,1 mL解囊液中的双歧杆菌活菌数,CFU/mL;V1,解囊液的总体积,mL;N0,包埋前单位体积原菌液中的活菌数,CFU/mL;V0,制备微胶囊所用原菌液的体积,mL;M,所得微胶囊的总质量,g;M0,称取微胶囊的质量,g。
1.5 响应面试验的因素和水平
比较单因素试验中这5个因素对湿微胶囊包埋率的影响程度,选取3个影响程度较大的因素,以包埋率为响应值,使用响应面软件进行3因素3水平试验,根据结果确定最优的双歧杆菌微胶囊制备工艺条件。因素水平表如下表1所示。
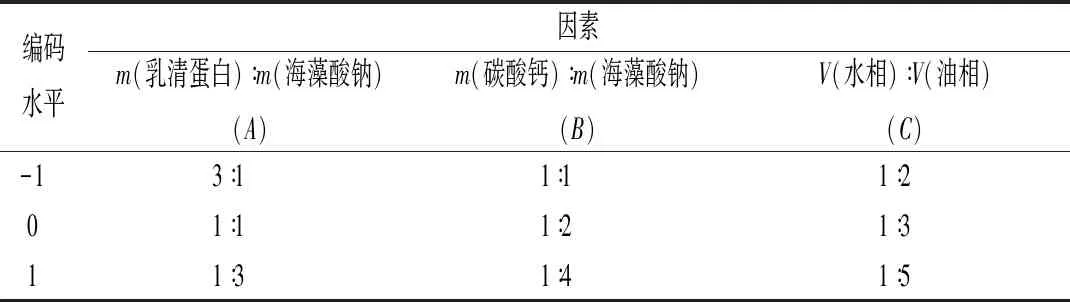
表1 因素水平表
1.6 验证试验
为进一步考察软件得出结果的真实性,在以上得出的最佳条件下进行试验,接着测定双歧杆菌湿润微胶囊的包埋率。将试验结果与软件数学结果相比较,观察差别是否明显,试验是否具有代表性。
1.7 双歧杆菌湿、干胶囊的理化性能的测定
1.7.1 表征分析
将药匙煮沸且用体积分数75%酒精消毒后置于紫外灯下通风30 min,取最佳工艺条件下制得的湿润微胶囊与冻干微胶囊,描述粒径大小和形态特征。
1.7.2 耐胃酸实验
取最优条件下得到的双歧杆菌湿胶囊1 g、冻干微胶囊0.1 g和1.4.1保存的菌悬液1 mL,分别置于9 mL人工模拟胃液中,37 ℃恒温摇晃0、1、2 h后,弃去溶液(菌悬液不必弃去溶液)。收集微胶囊,用解囊液彻底崩解后,制成菌悬液,计数。
1.7.3 耐胆盐实验
取最优条件下得到的双歧杆菌微胶囊1 g、冻干微胶囊0.1 g和菌悬液1 mL,分别置于9 mL人工模拟胆盐溶液中,37 ℃水浴0、1、2、3 h后弃去溶液(菌悬液不必弃去溶液)。收集微胶囊,用解囊液彻底崩解后,制成菌悬液,计数。
1.7.4 肠道释放性实验
取最优条件下得到的双歧杆菌微胶囊1 g、冻干微胶囊0.1 g和菌悬液1 mL,分别置于9 mL人工模拟肠液中,放在恒温摇床中。将其温度调节为37 ℃,摇速设置成210 r/min,0、30、60、90 min后,直接吸取3~4 mL溶液,在波长600 nm处测吸光度。
1.7.5 模拟消化道体系实验
取最优条件下得到的双歧杆菌微胶囊1 g、冻干微胶囊0.1 g和菌悬液1 mL,分别置于人工模拟胃液中处理1 h,然后转移至人工模拟胆盐溶液中处理30 min,最后将各实验组置于人工模拟肠液中处理45 min,弃去溶液(菌悬液不必弃去溶液)。收集微胶囊,用解囊液彻底崩解后,制成菌悬液,计数。
2 结果与分析
2.1 单因素试验的结果与分析
2.1.1 海藻酸钠质量分数对湿胶囊包埋率的影响
由图1可知,当海藻酸钠质量分数从1%升至2%时,双歧杆菌微胶囊的包埋率提高了约10%,后又逐渐下降。当质量分数<2%时包埋率较低,原因是此时形成的囊壁较薄,机械强度较弱,微胶囊容易破裂导致菌体流出[26];当质量分数>2%时包埋率缓慢下降,这是因为随着海藻酸钠质量分数的增大,壁材液密度和黏度也变大,不利于菌体的分散和包埋[27]。综上所述,海藻酸钠的最适质量分数为2%。

图1 海藻酸钠质量分数对双歧杆菌微胶囊包埋率的影响
2.1.2 乳清蛋白与海藻酸钠的比值对湿胶囊包埋率的影响
由图2可知,双歧杆菌微胶囊的包埋率先急剧增大,后又急剧减小,当m(乳清蛋白):m(海藻酸钠)为1∶1时包埋率达到最大值。当二者质量比值较大时,乳清蛋白较多,形成的蛋白质网过大、过于疏松,且粘连度较高,不利于形成规格一致的微胶囊;当二者质量比值较小时,乳清蛋白在溶液中含量太低,与Ca2+和海藻酸钠交联程度均不足,双歧杆菌包埋得不充分[28]。乳清蛋白与海藻酸钠复配作为双歧杆菌微胶囊壁材,当pH值低于乳清蛋白的等电点时,乳清蛋白的静电荷为正,与带负电荷的海藻酸钠多糖产生静电相互作用,从而形成牢固的微胶囊膜结构,可对双歧杆菌提供一定程度的保护作用。综上所述,m(乳清蛋白)∶m(海藻酸钠)最适为1∶1。

图2 m(乳清蛋白)∶m(海藻酸钠)对双歧杆菌微胶囊包埋率的影响
2.1.3m(CaCO3)∶m(海藻酸钠)对湿胶囊包埋率的影响
由图3可知,双歧杆菌微胶囊的包埋率先急剧增大,后逐渐下降,当m碳酸钙∶m海藻酸钠为1∶2时微胶囊的包埋率最大。CaCO3质量分数较大时,与海藻酸钠及乳清蛋白的结合位点较多,因此包埋率会有一个飞跃过程;m(CaCO3)∶m(海藻酸钠)<1∶2时,随着碳酸钙质量的增大,溶液渗透压不断上升,这可能会对整个微胶囊体系造成损伤,使得包埋率降低。综上所述,m(CaCO3)∶m(海藻酸钠)最适为1∶2。

图3 m(CaCO3)∶m(海藻酸钠)对双歧杆菌微胶囊包埋率的影响
2.1.4V(水相)∶V(油相)对湿胶囊包埋率的影响
由图4可知,双歧杆菌微胶囊的包埋率呈先出增大、后减小、最后趋于平缓的趋势,当V(水相)∶V(油相)为1∶3时微胶囊的包埋率最大。分析可能是大豆油体积较小时,微胶囊之间摩擦力较大,表面不平整,影响包埋率;而当大豆油体积过大时,摩擦力减小,无法均匀菌体和壁材液,且会造成微胶囊粒径过大的现象,因此包埋率也会降低。综上所述,V(水相)∶V(油相)最适为1∶3。
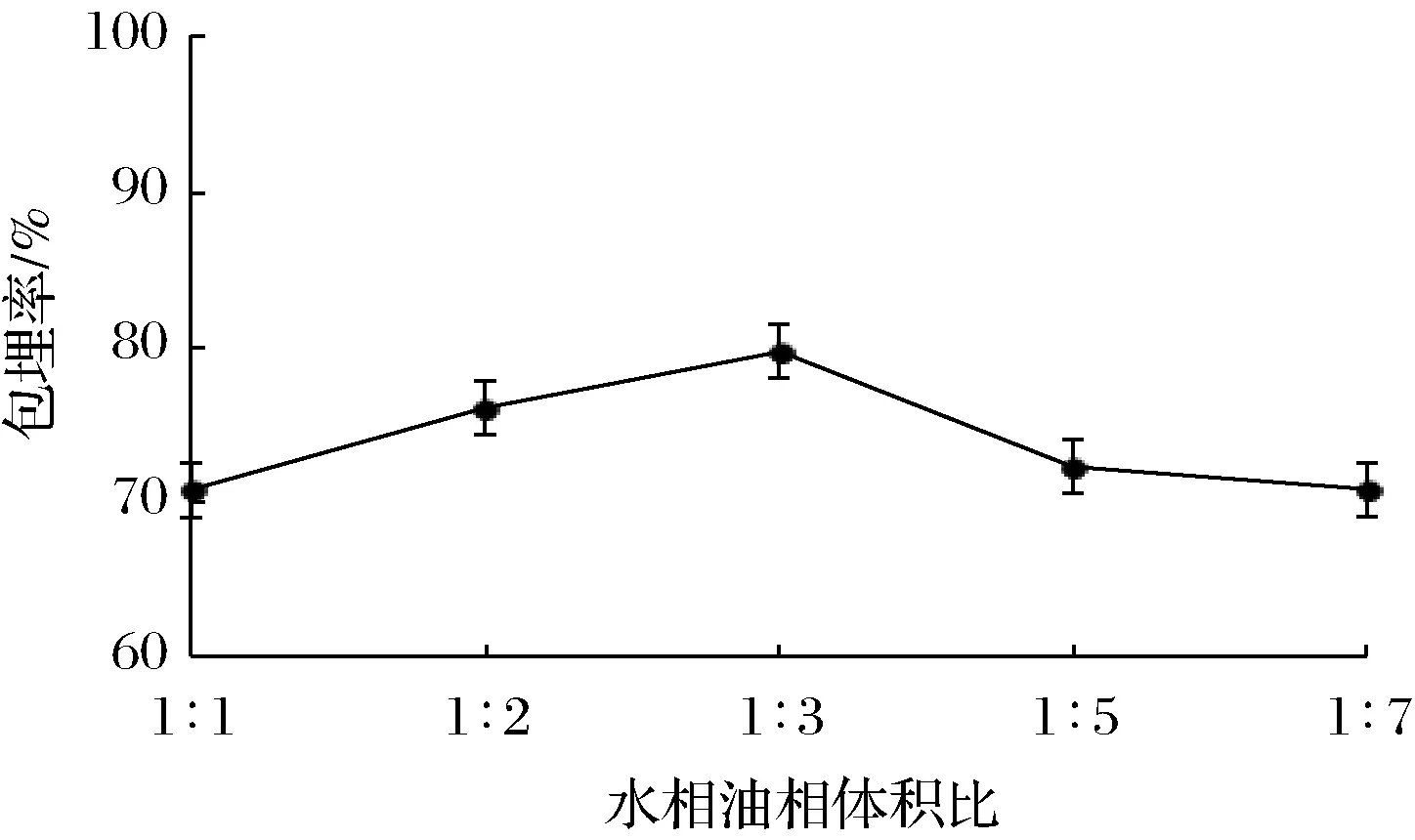
图4 V(水相)∶V(油相)对双歧杆菌微胶囊包埋率的影响
2.1.5 冰醋酸体积对湿胶囊包埋率的影响
由图5可知,随着冰醋酸体积的增加,双歧杆菌微胶囊的包埋率浮动很小,当冰醋酸体积为400 μL时包埋率最大。可能是因为微量的冰醋酸即可引发CaCO3的解离,但当体积<400 μL时,还有部分碳酸钙未被解离,这就造成了包埋率偏低;当冰醋酸继续增加时,溶液的pH降低,对微胶囊囊壁造成轻微的影响,间接影响了包埋率。综上所述,冰醋酸的最适体积为400 μL。
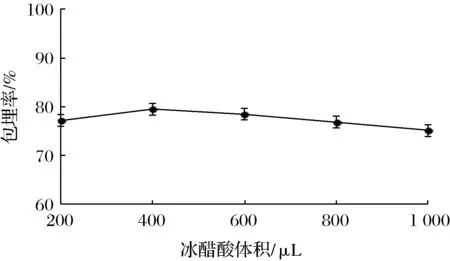
图5 冰醋酸体积对双歧杆菌微胶囊包埋率的影响
2.2 响应面试验结果分析
2.2.1 响应面试验优化的结果
用Design-Expert.8.0软件处理表2中的数据,得回归方程:R1=79.5-0.98A+0.84B+1.63C-0.61AB+3.5AC-2.39BC-2.19A2-0.96B2-3.56C2。所得回归方程方差分析如表3所示。
2.2.2 响应面试验交互作用分析
运用 Design-Expert.8.0 软件对各因素之间的交互作用进行模型图分析,m(乳清蛋白)∶m(海藻酸钠),m(CaCO3)∶m(海藻酸钠),V(水相)∶V(油相)与包埋率之间的相互作用,结果表明各因素对双歧杆菌微胶囊包埋率的影响程度为V(水相)∶V(油相)>m(乳清蛋白)∶m(海藻酸钠) >m(CaCO3)∶m(海藻酸钠)。

表2 响应曲面试验结果

表3 回归方程方差分析
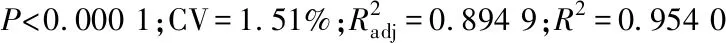
2.2.3 验证试验结果
通过软件优化数值分析得出双歧杆菌微胶囊制备的最佳工艺,为方便操作,将其修正成m(乳清蛋白)∶m(海藻酸钠)= 2∶1,m(CaCO3)∶m(海藻酸钠)=1∶2,V(水相)∶V(油相)=2∶5。理论上双歧杆菌微胶囊包埋率可达80.15%,在此条件下进行验证试验,平行3次。实际得到的双歧杆菌微胶囊包埋率为80.11%,与最佳提取工艺的理论值差别较小,说明该模型优化的最佳提取工艺具有较高的应用价值。
2.3 双歧杆菌湿、干胶囊理化性能的测定
2.3.1 表征分析结果
最优条件下湿胶囊为不透明微黄色颗粒状,用显微镜观察干胶囊的表面,发现出现皱缩状态,且因其粒径较小和保存不完善而造成轻微的粘连;将湿胶囊分散到无菌生理盐水中可发现其形态圆润、大小较为均一。单因素试验时发现直径约为2.8 cm的搅拌子制作出的微胶囊粒径均一性差,分析可能是由于其直径较小而使得搅拌时作用力弱;后续实验均采用直径约3.5 cm的搅拌子,此问题得以改善。
2.3.2 耐胃酸实验结果
如图6所示,未被包埋的菌悬液被模拟胃液侵蚀1 h后,其活菌数迅速下降至国际标准以下,放置2 h后再测量其活菌数,又下降了3个对数级,菌活力几乎丧失殆尽。湿润微胶囊和冻干微胶囊的活菌数也出现下降,但幅度较小,2 h后活菌数仍在1×106CFU/mL以上,说明此微胶囊性能良好,对胃酸有一定的抵御能力。湿润微胶囊活菌数的下降幅度略小于冻干微胶囊,这可能是因为冻干微胶囊的囊壁在冻干后皱缩,影响了微胶囊的囊壁结构。
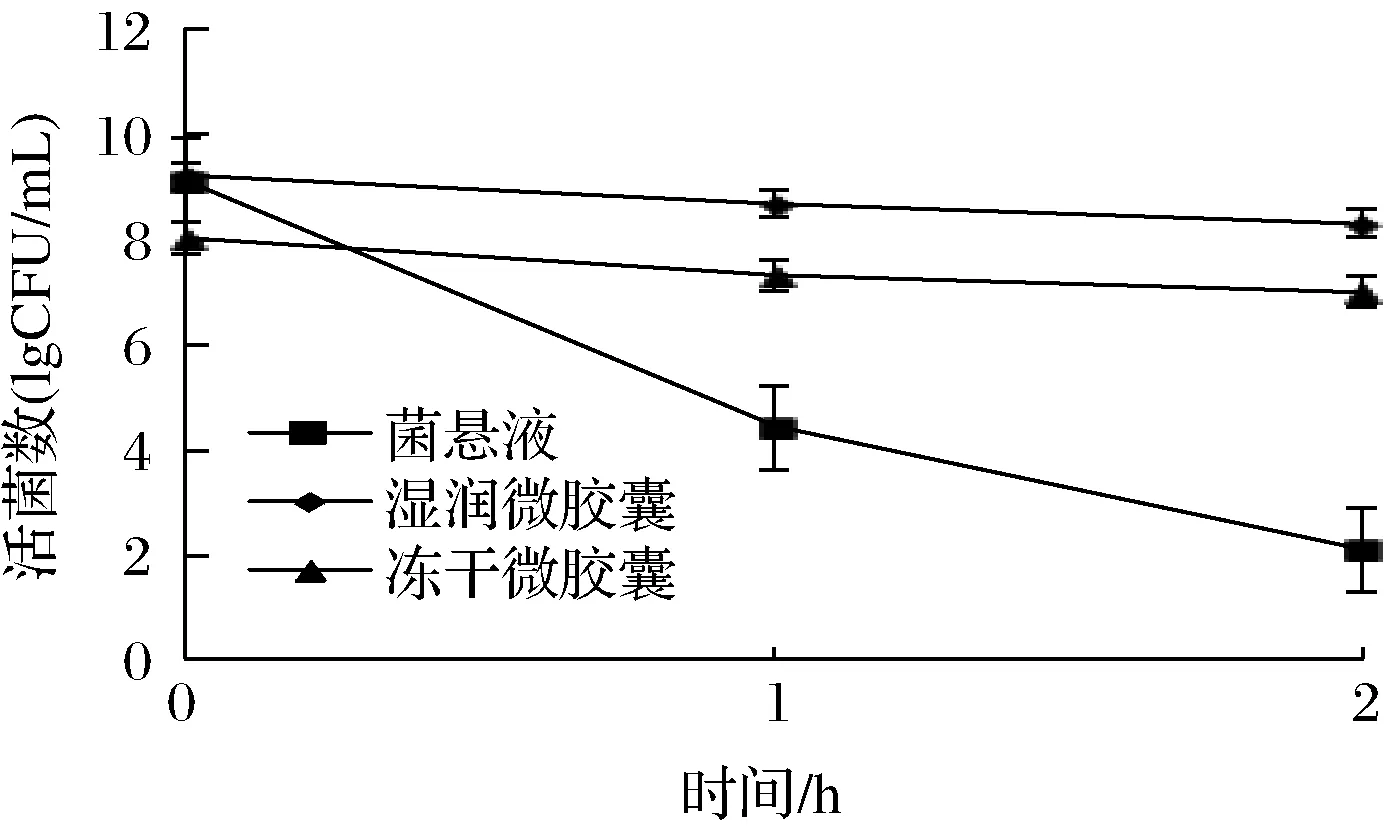
图6 菌悬液和微胶囊在人工模拟胃液中活菌数的变化
2.3.3 耐胆盐实验结果
如图7所示,菌悬液、湿润微胶囊和冻干微胶囊在模拟胆盐溶液中37 ℃水浴3 h后活菌数均有所下降。其中菌悬液中活菌数下降的最多,湿润微胶囊次之,冻干微胶囊最少。这是因为微胶囊的囊壁缓冲了胆盐对菌体的伤害,且冻干微胶囊温度较低。此外,三者在胆盐的作用下活菌数下降均不显著,这可能是因为胆盐主要起分解脂肪的作用,双歧杆菌菌体和微胶囊壁材对其并不敏感。
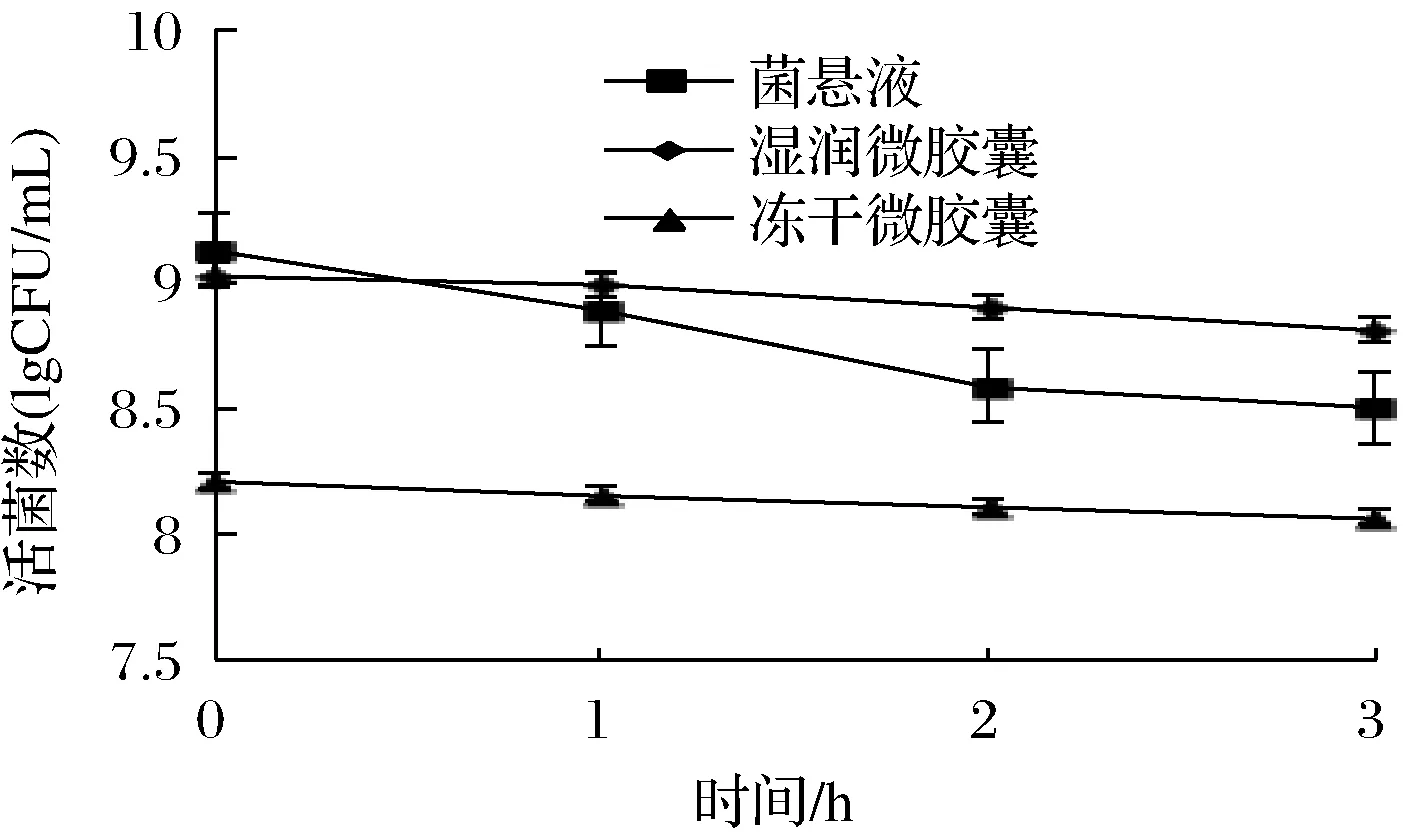
图7 菌悬液和微胶囊在人工模拟胃液胆盐溶液中活菌数的变化
2.3.4 肠道释放性实验结果
如图8所示,菌悬液的吸光度随着时间的增加,变化不明显,湿润微胶囊和冻干微胶囊30~60 min内吸光度有个飞跃过程。分析可能是菌悬液从始至终一直未改变液体状态,所以吸光度没有明显的变化,后期有轻微的上浮是因为菌体破裂,内容物释放。冻干微胶囊前期的涨幅没有湿润微胶囊大,可能是因为它相较于湿胶囊来说有一个吸水膨胀崩解过程。由吸光度的变化情况可得,湿胶囊与人工模拟肠液接触60 min,干胶囊接触90 min后大部分菌体可被释放。
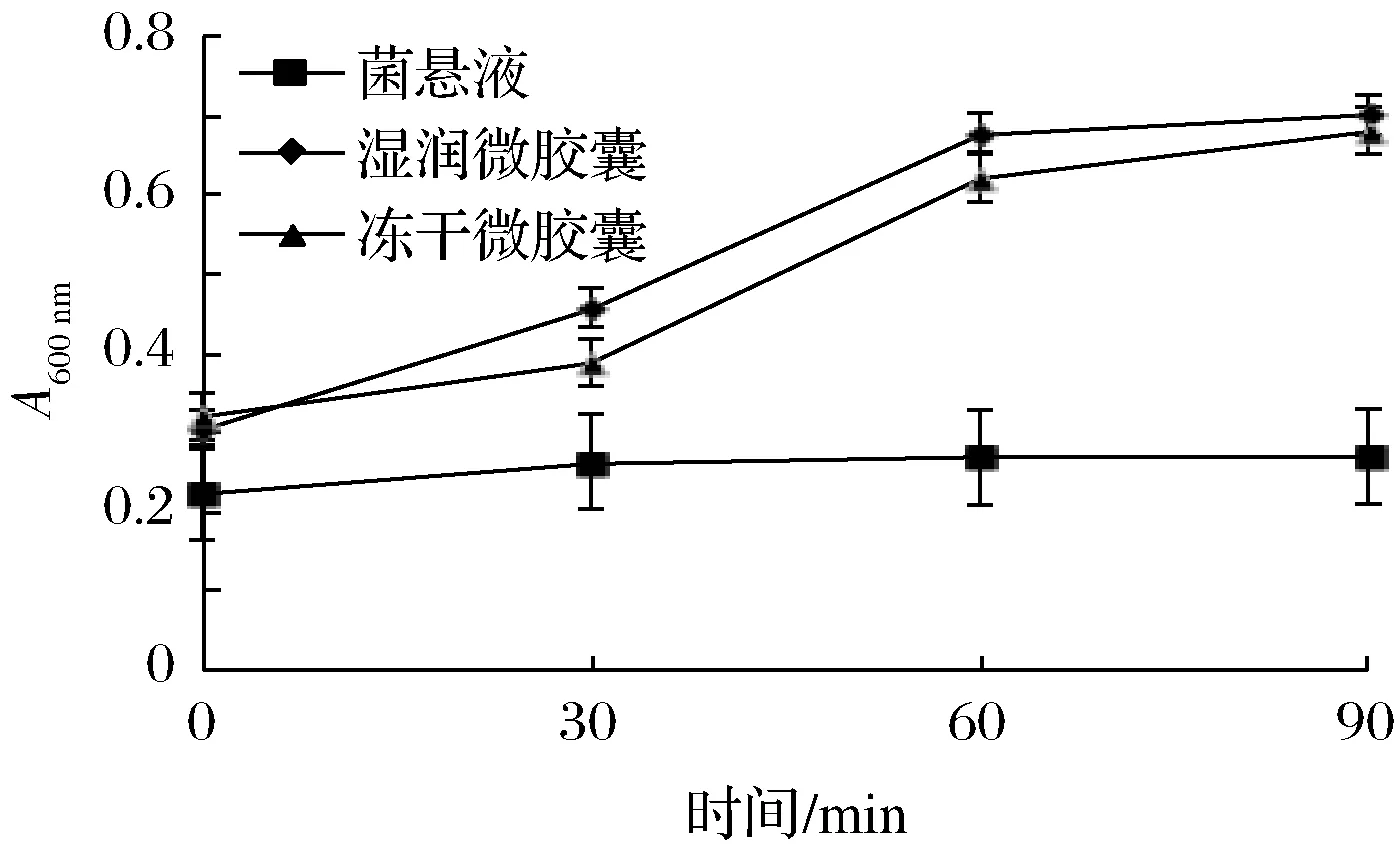
图8 菌悬液和微胶囊在人工模拟肠液中活菌数的变化
2.3.5 模拟消化道体系实验结果
如图9所示,在经过模拟消化道体系实验后,菌悬液、湿润微胶囊以及冻干微胶囊的活菌数都有较大的损失。但湿润微胶囊和冻干微胶囊的最终活菌数均已达到国际标准。冷冻干燥过程会对菌体和微胶囊结构造成不可逆的损伤,实际生产中可考虑添加多种冻干保护剂,复配使用,以减弱低温带来的伤害。
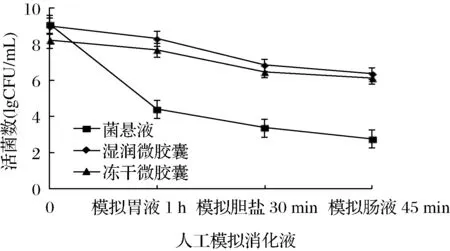
图9 菌悬液和微胶囊在人工模拟消化道体系中活菌数的变化
3 结论
本文采用内源乳化法制作双歧杆菌微胶囊。通过单因素试验和响应面法优化了其制备工艺,以包埋率为评价指标,得出双歧杆菌微胶囊的最佳工艺配比为:海藻酸钠质量分数2%,m(乳清蛋白)∶m(海藻酸钠)=2∶1,m(碳酸钙)∶m(海藻酸钠)=1∶2,V(水相)∶V(油相)=2∶5,冰醋酸400 μL,双歧杆菌微胶囊包埋率可达80.15%。进行验证试验,制作出双歧杆菌湿润微胶囊包埋率为80.11%,说明相关数据具有代表性,该实验的最佳条件有较高的应用价值。
本文还对双歧杆菌湿润微胶囊和冻干微胶囊进行耐胃酸、胆盐、肠道释放性和消化道体系实验,以双歧杆菌菌悬液为对照组。结果表明,游离的双歧杆菌在模拟人体消化液的作用下有较高的死亡率,而制作出的双歧杆菌湿润微胶囊和冻干微胶囊的理化性能指标均达标,体现了对不利环境的良好耐受性,为今后益生菌产品的开发和相关研究提供了理论基础。

