基质辅助激光解吸电离飞行时间质谱检测实验动物病原菌效果初探
邢 进,刘 娜,冯育芳,张雪青,崔生辉,贺争鸣,赵德明,岳秉飞*
(1.中国食品药品检定研究院 实验动物资源研究所,北京 102629; 2.中国食品药品检定研究院 食品化妆品检定所,北京 100050; 3.中国农业大学动物医学院,北京 100193)
根据我国实验动物微生物检测国家标准,病原菌的检测一直依赖于分离培养和血清学鉴定,不仅需要检测人员具有较丰富的经验,效率和准确性方面都亟待改进。因此分子生物学方法,比如PCR、荧光定量PCR等已逐渐应用到实验动物病原菌检测当中。然而进行病原菌的PCR检测,但是需要对实验室实行严格的分区和污染控制。基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)依靠激发微生物生成的蛋白质谱与专有数据库进行比较,以实现对微生物的鉴定。其具有操作简单、高效、准确等诸多优势,已经成为微生物鉴定的一种快速而可靠的工具[1]。目前国内外应用MALDI-TOF MS方法鉴定微生物效果的研究已广泛开展,其中与实验动物相关的病原菌主要有金黄色葡萄球菌[2-3]、肺炎链球菌[4]、乙型溶血性链球菌[5]、绿脓杆菌[6]、志贺菌[7]、小肠结肠炎耶尔森氏菌[8]、棒状杆菌[9-10]、巴斯德杆菌[11-12]、皮肤真菌[13]等。然而尚缺乏针对实验动物病原菌整体鉴定效果的研究,本研究采用德国布鲁克公司的Biotyper微生物质谱检测系统对相关菌株进行鉴定,初步评价MALDI-TOF MS方法对实验动物病原菌的检测效果。
1 材料和方法
1.1 实验材料
1.1.1 标准菌株
40株标准菌株,购自美国标准物质保藏中心(ATCC)、中国医学菌种保藏中心(CMCC)和中国兽医微生物菌种保藏管理中心(CVCC)。见表1。
1.1.2 分离菌株
384株实验动物分离菌株包括沙门氏菌4株、金黄色葡萄球菌21株、绿脓杆菌32株、嗜肺巴斯德杆菌315株、多杀巴斯德杆菌2、肺炎链球菌1株、肺炎克雷伯杆菌3株、产酸克雷伯杆菌1株、志贺菌1株、牛棒状杆菌2株、辛氏鲍特杆菌1株和嗜水气单胞菌1株。其中金黄色葡萄球菌、肺炎链球菌、牛棒状杆菌、绿脓杆菌和辛氏鲍特杆菌各有1株国际实验动物科学理事会(ICLAS)国际比对菌株。
1.2 主要试剂与仪器
哥伦比亚血琼脂培养基(Oxiod,CM0331),脱纤维羊血(北京路桥),厌氧袋和厌氧盒(三菱MGC AnaeroPack),Nuclease-Free Water(Promaga,P1193),PCR反应试剂(TAKARA,R010 A),细菌生化鉴定板(BD phoenix,448505,448008),甲酸(J&K,299272),基质溶液(Bruker IVD HCCA,8255344)。16Sr DNA扩增引物FD1∶5’-AGAGTTTGATCCTGGCTCAG-3’,RP2∶5’-ACGGCTACCTTGTTACGACTT-3’[14](上海生工)。布鲁克微生物快速鉴定系统(Bruker MALDI Biotyper IVD)、A2级生物安全柜(NUAIR-NU-437-400S)、核酸提取仪(Qiagen QIAcubeHT)、超微量紫外分光光度计(Implen NanoPhotometer)、恒温培养箱(Thermo IGS180)、全自动细菌鉴定仪(BD phoenix100)、PCR仪(ABI Veriti96)。
1.3 实验方法
1.3.1 菌株的培养
所有受试菌株接种于5%哥伦比亚血琼脂培养基,沙门氏菌、金黄色葡萄球菌、绿脓杆菌、志贺菌、克雷伯杆菌和啮齿类柠檬酸杆菌置36℃培养24 h;巴斯德杆菌、链球菌、棒状杆菌、支气管鲍特杆菌和念珠状链杆菌置36℃培养48 h;耶尔森菌和嗜水气单胞菌至27℃分别培养48 h和24 h;空肠弯曲菌36℃厌氧培养48 h。初代培养物按相同条件传代一次,次代菌落用于生化、测序和MALDI-TOF MS鉴定。
1.3.2 菌株的验证
对所有受试的标准菌株和分离菌株使用BD phoenix 100进行生化鉴定,同时提取基因组DNA,用引物FD1/RP2扩增16S rDNA,产物经测序后经Genbank BLAST比对,验证所用菌株的准确性。
1.3.3 MALDI-TOF MS鉴定
根据布鲁克微生物快速鉴定系统操作规程,采用直接转移法制备待检样本。用一次性接种环挑取受试菌株单个菌落,直接涂抹于不锈钢MALDI MSP靶板圆孔中,每孔滴加70%甲酸溶液1 μL,室温下晾干。随后用2 μL基质溶液覆盖,自然晾干后上机鉴定。结果用Biotyper 3.0 database处理分析。
2 结果
2.1 受试菌株验证
40株标准菌株和384株分离菌株经生化和16S rDNA序列比对验证,所有菌株确定无误。
2.2 MALDI-TOF MS分析
2.2.1 标准菌株鉴定结果
标准菌株的质谱结果分值区间为1.532~2.546,鉴定正确率为90.0%(36/40)。对所有沙门氏菌只能鉴定到属水平,不能确定到种。其中鼠伤寒沙门氏菌CMCC50115被鉴定为啮齿类枸橼酸杆菌;假结核耶尔森氏菌CMCC53521被鉴定为小肠结肠炎耶尔森氏菌;志贺菌所有菌株全部有误,结果为埃希氏菌或Kosakonia;嗜肺巴斯德杆菌Heyl型被鉴定为艰难梭菌;支气管鲍特杆菌被鉴定为百日咳鲍特杆菌。
2.2.2 分离株鉴定结果
MALDI-TOF MS对实验动物病原菌分离株鉴定的准确率为80.0%(307/384)。沙门氏菌、金黄色葡萄球菌、绿脓杆菌、多杀巴斯德杆菌、肺炎链球菌等几种常规实验动物病原菌鉴定结果全部准确;不在国家标准中的牛棒状杆菌、辛氏鲍特杆菌和产酸克雷伯杆菌项目也都准确鉴定。1株实验用鱼需检测的嗜水气单胞菌鉴定准确(结果见表2)。
3株肺炎克雷伯杆菌分离株1株鉴定正确,1株鉴定为产酸克雷伯杆菌,另1株鉴定为新型隐球菌(Cryptococcusneoformans);志贺菌分离株为福氏志贺菌,与标准菌株类似,被鉴定为大肠杆菌。315株嗜肺巴斯德杆菌分离株的鉴定结果准确率为76.5%(241/315),具体鉴定结果见表3。利用这些分离菌株,重新构建了嗜肺巴斯德杆菌质谱数据库,提高了鉴定的准确率。
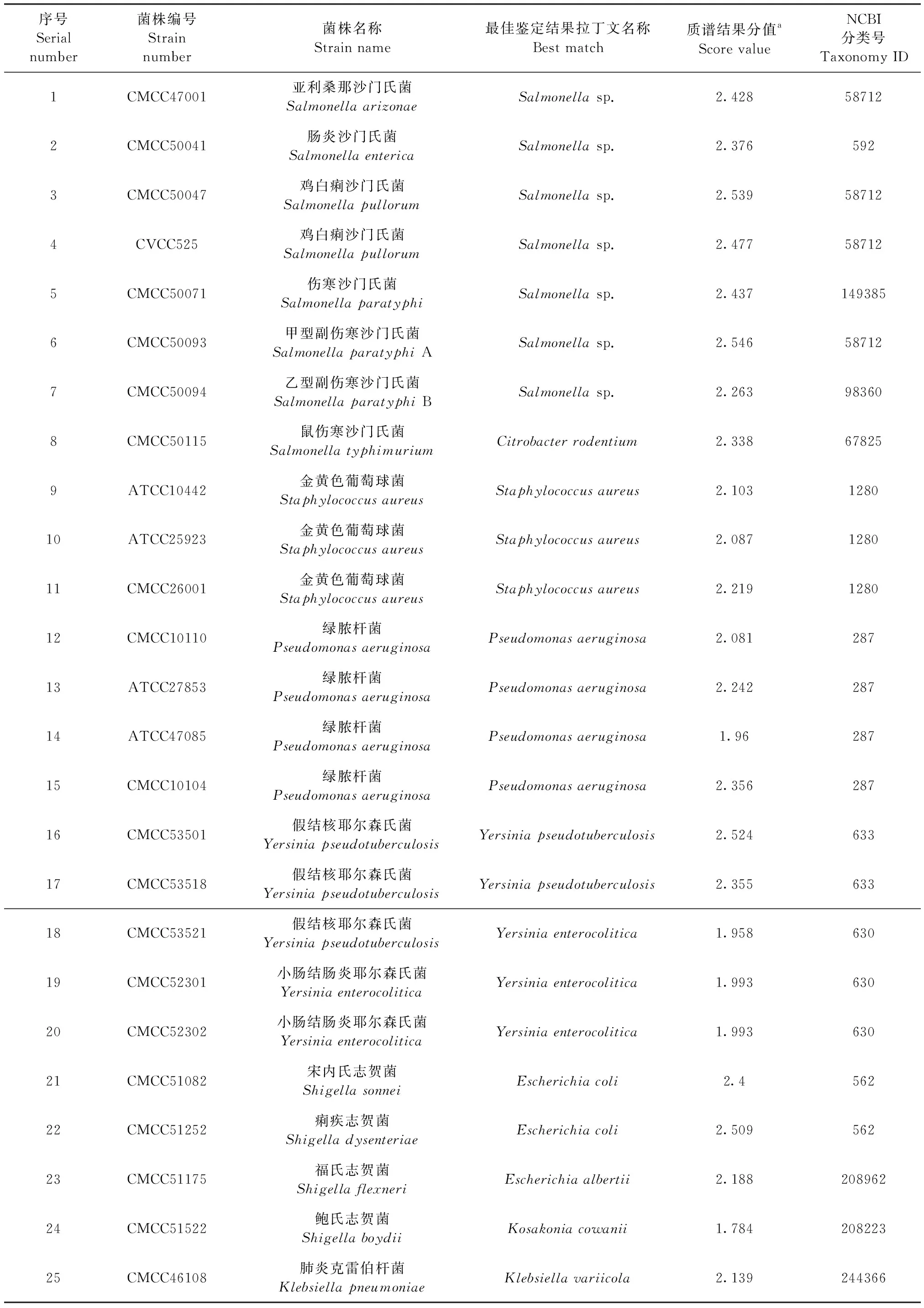
表1 标准菌种质谱结果
注:a:2.300~3.000极可能的菌种鉴定;2.000~2.299可靠的菌属鉴定,可能的菌种鉴定;1.700~1.999可能的菌属鉴定;0.000~1.699不可靠的鉴定。
Note. a, Identification of 2.300~3.000 highly probable species. 2.000~2.299 secure genus and probable species. 1.700~1.999 probable genus. 0.000~1.699 unreliable identification.

表2 分离株鉴定结果汇总

表3 嗜肺巴斯德杆菌鉴定结果

注:a: ATCC12555;b: ATCC 35149;c: 北京流行株。图1 嗜肺巴斯德杆菌ATCC12555、ATCC35149和北京流行株质谱峰图Note. a, ATCC12555. b, ATCC 35149. c, Beijing epidemic strains.Figure 1 MALDI-TOF MS spectrum of Pasteurella pneumophila ATCC12555,ATCC35149 and Beijing epidemic strains
3 讨论
本次研究所用菌株包括了大部分实验动物常见的可培养病原菌,还特别列入了几株国际实验动物科学理事会(ICLAS)检测目录中的细菌,用以评价质谱方法检测这些病原菌的效果。实验动物宿主涉及常规啮齿类、兔、鸡、鱼、犬、猴、猪等。
微生物质谱鉴定系统结果的可靠性依赖于相关菌株的基础数据库[15]。本次研究中,鼠伤寒沙门氏菌、志贺菌、假结核耶尔森氏菌、肺炎克雷伯杆菌、支气管鲍特杆菌和嗜肺巴斯德杆菌的标准菌株鉴定出现错误。特别是对志贺菌的鉴定全部有误,错误结果主要为与大肠杆菌的混淆,与报道一致[7],需要补充数据库才能加以区分。
本研究中使用了315株嗜肺巴斯德杆菌分离株,主要分离自北京地区的实验动物。嗜肺巴斯德杆菌在实验动物中感染率高,尚缺乏针对性的质谱鉴定研究。本结果显示,Bruker Biotyper系统及其原有数据库对嗜肺巴斯德杆菌鉴定准确率尚可,大部分菌株可鉴定到种,错误结果可鉴定到科水平。最新分类研究已将嗜肺巴斯德杆菌的Jawetz和Heyl生物型重新分类并命名为Rodentibacterpneumotropicus和Rodentibacterheylii[16]两种菌。通过分析二者质谱峰图(见图1),可见Heyl型与Jawetz型存在明显差异,前者在3900 m/z和7800 m/z两处的峰明显高于后者。北京地区流行株应属于Heyl型,其质谱峰图与Heyl型更为相近,与生化结果、PCR方法,以及分子分型[17]的鉴定结果相符。通过重新自定义数据库,即可快速区分嗜肺巴斯德杆菌Jawetz和Heyl生物型,即区分R.pneumotropicus和R.heylii,为二者的鉴别检测提供依据。鉴于伯杰细菌鉴定手册暂未改版,各种自动细菌鉴定系统对嗜肺巴斯德杆菌的分类也未做修改,检测结果仍定义为嗜肺巴斯德杆菌。
质谱检测方法与自动生化鉴定系统、PCR方法相比具有不可比拟的优势,不同品牌的质谱系统数据分析和统计方法各不相同,但都需要依靠庞大的专有数据库才能确保鉴定的准确性。因此对于实验动物病原菌的鉴定,还需在检测中不断收集更多的菌株补充和完善数据库。目前国产微生物鉴定质谱仪与进口品牌鉴定效果已无明显差距[15],相信随着本土菌株数据库不断丰富和完善,质谱检测将会逐步普及,并成为实验动物病原菌检测的重要手段。

