不同疗程电针对放射性脑损伤模型小鼠认知功能及海马神经元凋亡的影响*
王冬慧,武 鑫,孙宁宁,高剑峰
(1. 河南中医药大学基础医学院 郑州 450046;2. 河南中医药大学研究生院 郑州 450046)
近年来,随着癌症发病率的不断增高,放射线治疗成为了治疗肿瘤的一个重要手段,但放射线治疗所引起的脑部损伤已成为限制放疗的重要因素[1-2],临床研究表明放射线照射可引起学习记忆与认知功能受损,并且受损程度与照射剂量密切相关[3],因此探讨放射性脑损伤发病机制,以及电针干预对放射性脑损伤的防治具有重要意义。已有实验发现海马区是对放射线照射最敏感的区域,X 射线照射可造成神经元受损并引起脑退行性病变[4-5]。海马区神经元功能的损伤直接影响放射性脑损伤的程度和恢复过程。
有研究发现2.3Gy 的X 射线可损伤Long-Evans 大鼠学习记忆能力[6],本课题组发现不同剂量的X 射线照射后可不同程度地引起实验小鼠空间学习记忆能力的下降,主要表现为在旷场实验和Morris 水迷宫实验中受照射小鼠学习记忆功能受损,即8Gy 以上放射剂量即建立脑辐射损伤模型[7-8]。电针在头颈部肿瘤放疗后的辅助治疗中有广泛运用,如对放射线治疗后的口干、呕吐等症状具有明显改善效果[9-10]。电针对其他脑损伤的神经元凋亡具有一定抑制作用,对于阿尔茨海默病,电针通过抑制Bax同时上调Bcl-2可抑制阿尔茨海默病小鼠神经元凋亡,电针还可通过Notch3 信号通路抑制脑卒中小鼠海马区神经元凋亡[7,11-12]。因此,本实验采用电针干预“百会”、“风府”及双侧“肾俞”穴,观察不同疗程电针对放射性脑损伤小鼠海马区神经元凋亡的影响,从神经元凋亡的角度探讨不同疗程电针干预对放射线照射小鼠脑损伤的影响及作用机制。
1 材料与方法
1.1 实验动物及分组
1 月龄 SPF 级雄性 C57BL/6J 小鼠 50 只,购于北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2016-0006。将小鼠置于7:00-19:00 光照和19:00-7:00 黑暗的实验室,水食不限,饲养环境温度24℃,湿度为50%-60%。将小鼠随机分为对照组、放射线照射组(8Gy)、电针组1(1 周)、电针组2(2 周)和电针组3(3 周),每组10 只。本实验已通过河南中医药大学伦理审查,动物伦理审查批准编号为:DWLL16020034。
1.2 主要仪器与试剂
无菌针灸针(0.30 mm ×13.00 mm,苏州医疗用品厂);直线加速器(Varian Clinac 600 CD,Radiation Oncology Systems,SanDiego,CA,USA);图像分析系统Image-Pro plus6.0(Media Cybemetics Inc.USA,型号41N5100-44800);石蜡切片机(Leica,型号2235);曝光检测系统(Fujifilm,Tokyo,Japan);兔抗AIF 单克隆抗体(ab32516,abcam,USA);新物体识别(湖南百众生物科技有限公司,型号BZ-XX117);POD 凋亡试剂盒(11684817910,Roche);兔 抗 caspase-3 多 克 隆 抗 体(TA312442,ORIGENE,USA)。
1.3 造模与干预方法
X 射线照射方法:具体方法参考文献对放射线照射组、电针组1、电针组2、电针组3 进行造模[7]。按照0.01 ml·g-1剂量给与实验动物2%戊巴比妥钠,将实验动物麻醉,将小鼠俯卧置于放射平台进行X 线照射,照射剂量为8Gy,射线源距离脑99.5 cm。照射过程持续约10 min。造模结束后第二天进行电针干预,使用小鼠固定器对各组小鼠进行固定,对电针组小鼠按照《实验针灸学》取穴方法进行针刺[13],回路1 取百会和风府;回路2取双侧肾俞。用针灸针刺入1mm左右,连接电针仪设置参数[8],电压1.5 V,频率10 Hz,波宽1 ms,针刺时间为30 min/次,每天1 次,依据分组连续针刺1周、2周和3周。
1.4 检测指标及方法
1.4.1 新物体认知实验
对照组与放射线照射组于造模后第2天进行新物体认知实验;电针组1(1周),电针组2(2周),电针组3(3周)分别于针刺7天、14天、21天进行新物体认知实验,具体方法参考文献[14-15]。第一天为适应期:将小鼠放入测试箱(40×40×40 cm3)内适应3 min,使其适应测试环境;第二天为训练期:将完全相同的物体A(OA)和物体B(OB)放入测试箱内一侧壁的左右两端,然后将小鼠背朝物体放入场地内同时保证小鼠与两物体距离相等,使其自由探索物体3 min。结束立即将小鼠放回到原来的鼠笼内。测试期:在训练期结束后90 min和24 h分别进行测试。测试时将一个完全不同的物体C(OC)替代物体B,然后将小鼠按照同样的方法刚入测试箱内,使其探索物体3 min。在训练期和测试期,分别记录实验对象对OA、OB 以及OC 的探索时间。将小鼠对OC 的探索时间记为TN;对OA 的探索时间记为TF,将认知指数(RI,recognition index)RI =[TN/(TF+TN)×100%]作为衡量实验对象的认知能力的指标。录像记录整个实验过程。
1.4.2 细胞凋亡相关指标的检测
各组小鼠于新物体认知实验后取材,制备石蜡切片。采用3.5%水合氯醛,0.01 ml·g-1麻醉动物,打开胸腔暴露心脏,穿刺针刺入左心室后剪开右心耳,用PBS液30 ml 灌注约10 min 直至右心耳流出液体逐渐清亮后改用4%多聚甲醛灌注,牵拉动物四肢有僵硬感或尾巴翘起为灌注成功,断头并于冰床上取脑,经4%多聚甲醛固定后常规石蜡包埋,切片(厚约4μm)并贴附于载玻片上,65℃烤箱过夜干燥备用。
(1)TUNEL染色检测DNA断裂情况
石蜡切片脱蜡至水,3%蛋白酶K 消化组织,PBS清洗后加入TUNEL 检测液后室温下孵育60 min,PBS清洗后加入 POD 转换剂 37℃下 20 min,PBS 清洗后DAB染色。TUNEL 阳性细胞核染成棕黄色,每张切片选5 个高倍视野观察记录,计算凋亡指数[AI=(阳性细胞数/总细胞数)×100%],计算平均数进行统计。
(2)免疫组化检测caspase-3 和AIF 细胞凋亡相关指标

图1 不同疗程电针对各组小鼠新物体认知功能的影响(,10只鼠/组)
梯度酒精、二甲苯脱蜡至水,柠檬酸盐缓冲液(pH 6.0)进行抗原修复。山羊血清30 min 封闭非特异性抗原,滴加caspase-3(1∶50)和AIF(1∶50)一抗,PBS 液冲洗后,滴加相对应二抗,室温下孵育,显色用DAB 显色液及ABC Elite 试剂盒。树胶封片并拍照留存,检测海马区免疫阳性细胞的平均光密度值MOD。
1.5 统计学方法
实验数据采用GraphPad Prism 6.0 软件进行统计分析,新物体认知实验结果采用重复测量方差分析进行处理,其它实验结果采用单因素方差分析结合Tukey's两两比较进行检验。以P <0.05为差异有统计学意义。数据均以均数±标准差()表示。
2 实验结果
2.1 不同疗程电针对各组小鼠认知功能的影响
本实验采用新物体认知检测放射线照射对海马区认知功能的影响以及不同疗程电针干预的作用。具体实验流程见图1A。实验结果表明放射线照射可显著损伤小鼠新物体认知能力,其中在两个测试点,与对照组比较,放射线照射组小鼠探索新物体OC 时间均显著减少(P< 0.01,P< 0.001),而与放射线照射组比较,电针1、2 和3 组小鼠在90 min 时探索新物体时间均显著增加(P <0.05,P <0.05,P< 0.01),同时在24 h 测试点时探索新物体时间均显著增加(P<0.01,P< 0.01,P< 0.05);而在24 h 测试点,与对照组比较,放射线照射组小鼠的认知指数明显下降(P<0.05),电针1、2 和3 组小鼠认知指数均不同程度升高(P<0.05,P< 0.01,P< 0.05)。
2.2 不同疗程电针对各组小鼠海马区神经元凋亡的影响
海马区被公认为是参与调节认知及学习记忆的中心核团。因此,我们用TUNEL法检测各组小鼠海马区神经元凋亡数目,TUNEL 阳性细胞呈深棕色,并可见细胞核固缩,细胞形态不规则,即凋亡细胞。实验结果显示与对照组比较,放射线照射组小鼠海马区神经元凋亡数量显著升高(P<0.01),说明随着放射线照射可诱导小鼠海马区神经元凋亡。而与放射线照射组比较,电针各组神经元凋亡数量均有所减少,其中电针组2 和电针组3 具有显著性差异(P< 0.01,P<0.05);不同电针组比较发现,与电针组1 比较,电针组2 表达明显增加(P< 0.05);电针组3 与电针组2 比较,差异无统计学意义。实验结果见图2。
2.3 不同疗程电针对各组小鼠神经元细胞凋亡因子表达的影响
2.3.1 各组小鼠海马区caspase-3的表达
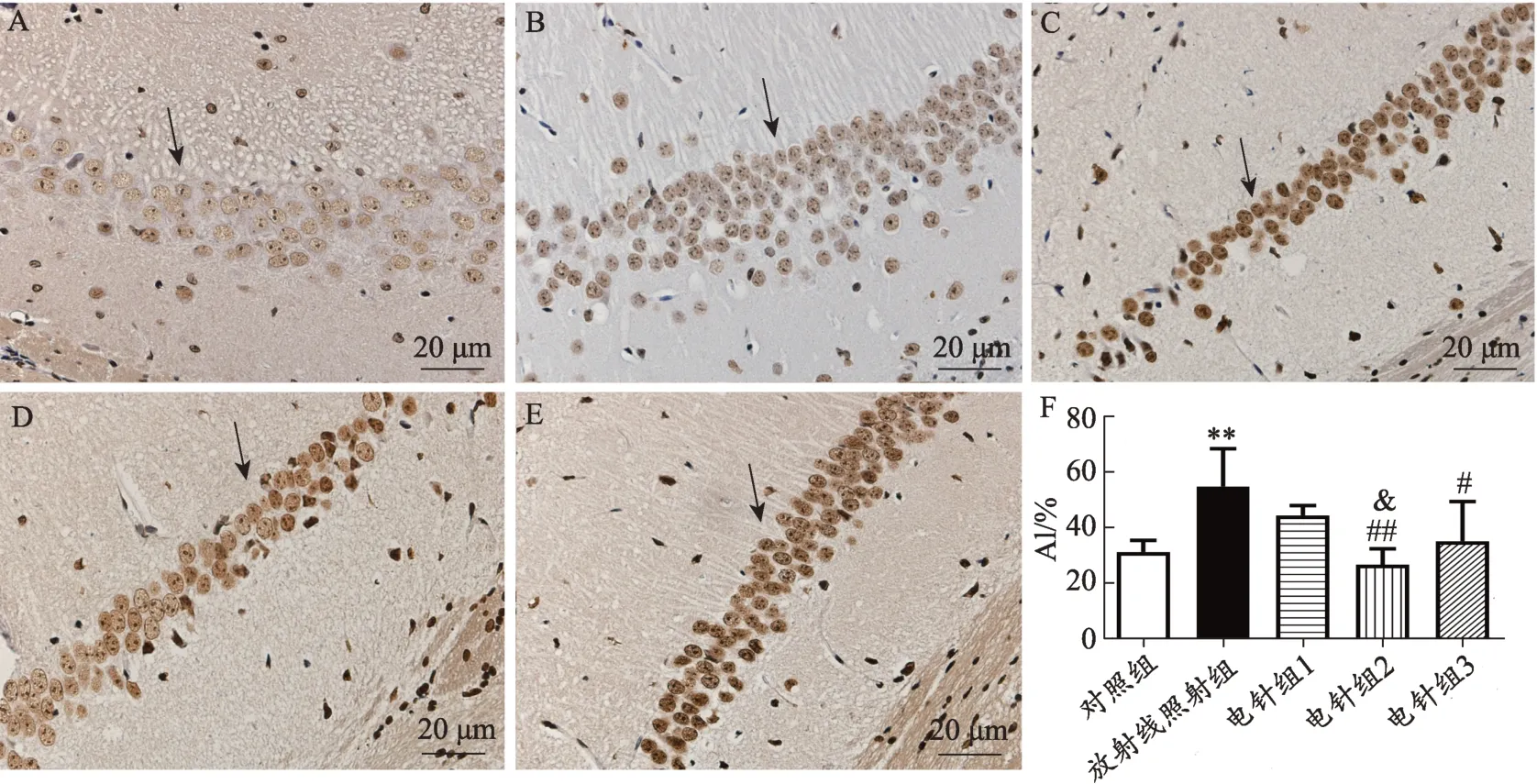
图2 不同疗程电针对各组小鼠海马区神经元凋亡的影响(TUNEL法,,10只鼠/组,SP染色400倍)

图3 不同疗程电针对各组小鼠海马区caspase-3表达的影响(免疫组织化学法,,10只鼠/组,SP染色400倍)
各组小鼠海马区神经元caspase-3 表达检测结果显示caspase-3 阳性细胞呈棕褐色,主要表达于细胞质。其中与对照组比较,放射线照射组小鼠海马区神经元caspase-3表达显著增加(P<0.01)。而与放射线照射组比较,电针组2和电针组3小鼠海马区caspase-3 表达显著减少,并存在显著性差异(P< 0.01,P<0.05);与电针组 1 比较,电针组 2 表达明显增加(P<0.001);电针组3与电针组2比较,差异无统计学意义。实验结果见图3。
2.3.2 各组小鼠海马区AIF的表达
各组小鼠海马区神经元AIF 表达检测结果显示AIF 蛋白表达阳性细胞呈棕黄色,并且主要表达在细胞核内。实验结果表明与对照组比较,放射线照射组小鼠海马区神经元AIF 表达显著增加(P<0.001);而与放射线照射组比较,电针各组小鼠海马区AIF 表达显著减少(P< 0.001,P< 0.01,P< 0.01);不同电针组比较发现,与电针组1 比较,电针组2 和电针组3 表达显著增加(P< 0.01,P< 0.01),电针组2 与电针组3 差异无统计学意义。实验结果见图4。这一实验结果与caspase-3表达结果具有一致性,说明放射线照射可诱导海马区神经元凋亡,而不同疗程的电针干预具有一定的改善作用,其中电针2周和电针3周效果显著。

图4 不同疗程电针对各组小鼠海马区AIF表达的影响(免疫组织化学法,,10只鼠/组,SP染色400倍)
3 讨论
学习记忆是大脑的一种高级神经活动,海马区被认为与空间学习记忆、物体认知和情感恐惧记忆密切相关[16,17]。此外研究发现海马区对放射线较为敏感[18],因此有研究认为海马区是X 射线照射导致行为学改变的关键调节区域,海马区神经元的凋亡、突触数目的下降、血脑屏障的损伤等可能与脑区放射线照射后的认知及学习记忆功能改变有关[19-21]。本实验前期行为学检测发现不同剂量X 射线照射可不同程度损伤小鼠的空间学习记忆功能。在本实验中我们利用新物体认知实验检测不同疗程电针干预对放射性脑损伤小鼠认知功能的作用,结果发现电针1 周、2 周和3周均显著增加小鼠探索新物体时间,并且认知指数较放射线照射小鼠显著提高。上述实验结果说明放射线照射损伤了海马依赖性学习记忆及认知能力,而电针干预可显著改善放射线照射所导致的认知功能损伤。
细胞凋亡又被称为细胞程序性死亡,参与调节分化及正常细胞的更新,并与多种疾病密切相关[22-24]。本实验利用TUNEL 法检测不同疗程电针干预对放射线照射后小鼠海马区神经元凋亡的影响。实验结果表明给予放射线照射可诱导神经元凋亡,而电针2 周和3周显著减少神经元凋亡数量。这一实验结果与前期行为学结果相符,说明放射线照射所引起的认知功能和学习记忆功能下降与海马区神经元凋亡所致的海马区功能受损相关,而电针干预可通过抑制神经元凋亡改善放射线所致的整体认知行为损伤。caspase-3 被认为是细胞凋亡信号通路中的主要效应因子之一,是细胞遭受到各种损伤后启动凋亡信号通路的执行蛋白,也是研究细胞凋亡的常用指标[24]。caspase-3属于半胱氨酸蛋白酶家族,直接参与并执行细胞凋亡程序。因此本实验将其作为检测指标,实验结果表明给予放射线照射处理可诱导海马区神经元内活化caspase-3蛋白表达水平的增加,与对照组比较具有显著性差异。这一实验结果说明放射线照射可诱导caspase-3 信号通路介导的神经元凋亡。而给予电针干预后,caspase-3 表达均有所下降,其中电针2 周和3周与放射线照射组比较具有显著性差异,说明不同疗程电针干预可不同程度的抑制caspase-3的表达,从而发挥抗放射线损伤的作用。此外,除了caspase-3参与介导细胞凋亡过程外,线粒体也在其中起到了决定性的作用[25-26]。凋亡诱导因子AIF 是位于线粒体膜间隙的一类黄素蛋白,其不依赖于caspase-3 信号通路直接介导细胞凋亡。研究发现AIF既具有细胞凋亡活性又具有氧化还原酶活性,细胞在受到凋亡的刺激后,AIF 会从线粒体易位到细胞核,并且与细胞核中的染色体结合使其发生凝集断裂,同时也可破坏细胞骨架蛋白、核蛋白等,最终引起细胞凋亡[27-29]。而在本实验中,实验结果发现与对照组比较,给予放射线照射可导致神经元细胞内AIF的表达显著增加。这一结果表明放射线照射不但可以通过caspase-3 通路诱导细胞凋亡,同时也可以诱导非caspase-3 途径的AIF 释放,从而促使神经元凋亡增加、数目减少以及功能受损,最终导致了整体行为学的改变。而给予不同疗程电针干预均显著抑制放射线照射所诱导的AIF表达及神经元凋亡。
综上所述,不同疗程电针干预可通过抑制caspase-3 和AIF 的表达,减少海马区神经元细胞的凋亡,从而从整体水平改善放射线照射小鼠的认知及学习记忆功能,其中电针2 周及3 周作用效果较显著。放射性脑损伤是神经系统肿瘤放疗后出现的严重并发症之一,其具体发病机制尚不明了[30]。本实验研究结果提示放射线照射可通过caspase-3 和AIF 两条途径诱导小鼠海马区神经元凋亡,致使神经元细胞数目以及功能均受到损伤,而给予不同疗程的电针干预可不同程度的改善上述损伤作用,其中电针2周和电针3周作用最为显著。因此,在今后的预防和治疗放射性脑损伤时,抑制凋亡因子的释放以及保护线粒体功能具有重要的临床意义,为临床合理采用电针防治放射性脑损伤提供了理论依据。

