拟南芥14-3-3蛋白GRF9调控番茄根系响应水分胁迫的生理机制①
章丽丽,李光杰,陆玉芳,施卫明*
拟南芥14-3-3蛋白GRF9调控番茄根系响应水分胁迫的生理机制①
章丽丽1,2,李光杰1,陆玉芳1,施卫明1*
(1 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2 中国科学院大学,北京 100049)
采用35S启动子控制General Regulatory Factor 9 () 在两个转基因番茄株系(E2,E7)中高效表达,以野生型番茄WT、转基因番茄E2和E7三个株系为试验材料,在水培条件下用20% 聚乙二醇(PEG 6000)模拟干旱胁迫,探究了拟南芥14-3-3蛋白GRF9能否增强番茄根系响应水分胁迫的能力。结果表明:①在干旱胁迫下,野生型番茄和转基因番茄的根系形态指标均受到不同程度的抑制,WT、E2和E7三个番茄材料相对总根长的受抑制程度分别为43%、28%、30%,相对根表面积的受抑制程度分别为46%、33%、35%,相对根体积的受抑制程度分别为47%、32%、29%,相对根直径的受抑制程度分别为29%、21%、22%。②在响应干旱胁迫时,转基因番茄根系蔗糖含量比野生型番茄高20%,根系干物质量比野生型番茄高23%。③在干旱胁迫时,转基因番茄根系质膜H+-ATPase酶活性较高,具有较强的分泌质子的能力,其根系泌酸量比野生型番茄高35%。因此,GRF9能够促进番茄根系蔗糖含量的增加和干物质的累积、增强根系分泌质子的能力,这对于转基因番茄根系在总根长以及根表面积、根体积和根直径的生长以响应干旱胁迫的过程中具有重要作用。
番茄;;根系形态;质子分泌;干旱胁迫
农业是对水分需求较大的产业,水资源短缺是限制农业生产的最重要因子之一。番茄()是世界上种植面积较大的主要设施蔬菜作物和重要的经济作物,茎叶繁茂、蒸腾作用强、果实含水量达80% ~ 90%,其生长发育对水分的要求较高[1-3]。因此作物对水分胁迫的反应一直是研究的热点。研究发现,植物在进化过程中,已经拥有一些完善的适应水分胁迫的生物学机制[4-5]。根系是植物感知和承受环境水分胁迫的主要部位,调控根系生长是植物适应水分胁迫的其中一个重要的生理机制[6-8]。长期水分亏缺,根系在大小和形态分布上会做出适应性调整,对水分亏缺适应性强的植物一般会有较发达的根系,增强利用地下深层的水分,满足植株整体的需水要求[6-9]。
在拟南芥中已发现有15个14-3-3蛋白家族亚型,其中GRF9是拟南芥14-3-3蛋白家族中的一个成员[10-11]。GRF9能够调控拟南芥根系生长,通过激活根系质膜H+-ATP酶活性以及调控地上部碳水化合物向根系运输的方式促进拟南芥总根长和增强拟南芥根系对水分胁迫的适应能力[12-16]。但是,导入能否增强蔬菜作物番茄的根系对干旱胁迫的耐受性,尚不清楚。并且,如果转基因的番茄根系对干旱胁迫的耐受性确实有所提高,是否根系形态参数的根表面积、根体积和根直径均发生了相适应的改变,目前也不清楚。
因此,本次研究通过对比过表达番茄的两个转基因株系E2和E7以及野生型番茄WT三个番茄材料对20% 聚乙二醇(PEG 6000)模拟水分胁迫的根系响应过程,以探究的超量表达能否促进番茄根系总根长以及根表面积、根体积、根直径的共同生长以提高对水分胁迫的适应性。
1 材料与方法
1.1 供试植物材料
中蔬四号番茄(L. cvZhongshu No. 4)(WT),购自南京市金祥种业有限公司。构建受35S 启动子控制的植物表达载体,通过农杆菌介导的方法[17],将基因导入WT番茄,获得转基因番茄(E2、E7)。
选取饱满的WT、E2和E7三个番茄材料的种子在自来水中浸泡15 min,用75% 酒精浸泡30 s,用纯净水冲洗;再用2%(/)的NaClO溶液剧烈振荡灭菌15 ~ 20 min,用纯净水冲洗;置于(30±1) ℃培养箱黑暗萌发。
1.2 试验设计
水培试验:将发芽后的番茄种子转移至带有网眼的塑料托盘中,托盘置于装有5 L 0.5 mmol/L CaCl2溶液的周转箱中至番茄子叶展开,周转箱内的溶液用1/5 Hoagland营养液替换。于人工气候室内,待长出一片真叶后,将番茄苗转移至含有1 L 1/2 Hoagland营养液的塑料罐中(每块植物板上5个孔,每孔1株幼苗,共5株幼苗一个塑料罐)培养,溶液pH为6.0,每2 d更换一次营养液。待长出2 ~ 3片真叶(共培养18 d),将每个品种分成两组,加入含20% PEG6000的1/2 Hoagland营养液作为水分胁迫处理组(LW),不含PEG6000的1/2 Hoagland营养液作为对照组(CK),处理6 d。试验重复3次。
植物生长的人工气候室条件为相对湿度70%,光照、温度昼夜循环:16 h光照、25 ℃,8 h 夜晚、22 ℃,光照强度200 ~ 250 μmol photons/( m·s)。
1.3 测定项目和方法
1.3.1 DNA、RNA提取及PCR、Real-time PCR鉴定 植物DNA、RNA均提取自整株番茄幼苗,DNA采用CTAB法提取,参考王关林和方宏筠[18]的方法。PCR所用引物用Primer 5设计(F段序列为5′-AAGAGCGTGACACTTTCG-3′;R端序列为5′-CAGCAGCAGTAGTAGCAATC),扩增产物大小为474 bp。RNA提取以及Real-time PCR反应参考Li等[19]的方法。表1中的引物均是用Primer 5 设计,选用番茄中表达较强的“house-keep”基因作为基因表达量的对照。
1.3.2 根系形态参数测定 用WinRHIZO根系分析仪(WinRHIZO,Regent,Canada)扫描分析总根长、根表面积、根体积和根直径[21]。将正常水分培养(CK)下的各株系番茄根系的各项形态指标的绝对值定义为100%,则水分胁迫(LW)下各株系番茄根系的各形态指标变化的相对抑制率=(1–处理组各形态指标/对照组各形态指标)×100%。
1.3.3 植物干物质量测定 番茄植株地上部和根系分离后,105 ℃杀青30 min,70 ℃烘干至恒重。
1.3.4 蔗糖含量测定 称取0.1 g植物干样粉末,加入8 ml 80% 乙醇,80 ℃水浴30 min后取上清液0.9 ml,加入0.1 ml 2 mol/L NaOH沸水浴10 min,冷却后加入1 ml 0.1% 间苯二酚和3 ml 10 mol/L HCl 80 ℃水浴1 h,冷却后用紫外/可见光分光光度计进行比色测定[22]。
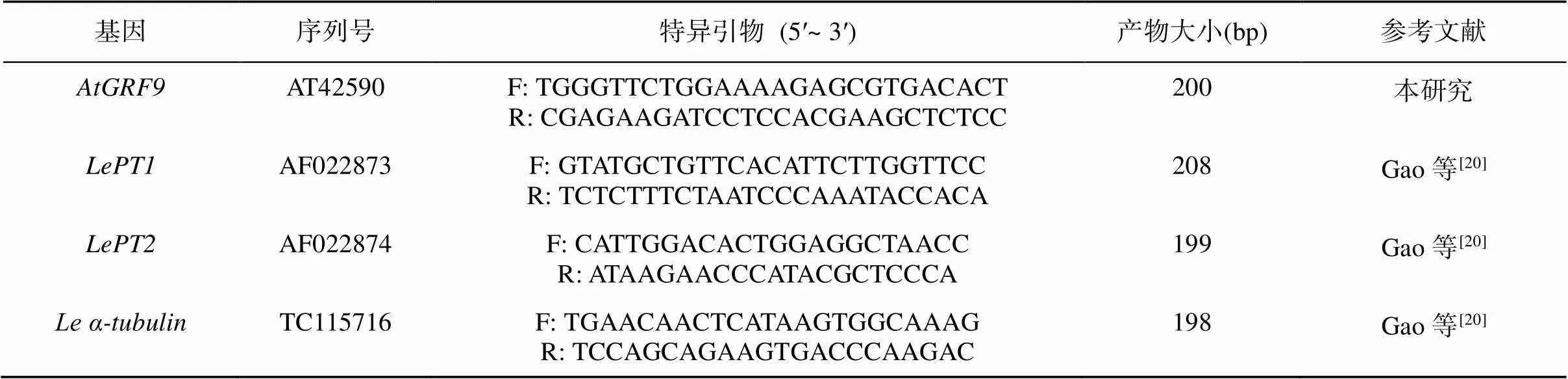
表1 本次试验用的引物
1.3.5 根系泌酸量测定 处理6 d后的番茄幼苗培养6 h后的营养液回收,用0.1 mmol/L NaOH滴定,根据消耗的NaOH量计算质子分泌量[23]。
1.3.6 根系质膜H+-ATPase酶活性测定 质膜H+- ATPase酶的提取和质膜H+-ATPase酶活性参考Zhang等[24]和Shen等[25]的方法。
1.4 数据处理与分析
采用Excel 和SPSS 20 软件进行数据处理和统计分析,LSD法进行差异显著性检验。
2 结果
2.1 转基因AtGRF9番茄植株的确认及其转录水平的验证
基因的cDNA通过农杆菌介导方法导入中蔬四号番茄获得转基因株系[17],通过加代获得T2代纯合系的转基因株系E2和E7。用PCR技术鉴定转基因植物为导入的番茄,结果如图1A所示,转基因番茄植株的基因组中含有基因片段。此外Real-time PCR可以检测是否在转基因番茄中正常表达。本研究将培养18 d的番茄苗液氮冷冻、研磨、提取RNA后,用Primer 5设计的阅读框的一对引物F: TGGGTTCTGGAAAAGAGCGTGACACT;R:CGAGAAGATCCTCCACGAAGCTCTCC 对试验材料进行鉴定,如图1B所示,拟南芥基因没有在野生型番茄WT中表达,但同时在E2和E7两个转基因番茄品种中有高效表达量,说明能够在番茄中表达。
2.2 水分胁迫对番茄根系形态的影响
如图2所示,水分胁迫处理6 d后,番茄根系总根长、根表面积、根体积和根直径的生长均受到了不同程度的抑制,但转基因番茄两个株系的抑制程度明显低于野生型番茄,WT、E2和E7三个番茄材料总根长的相对抑制率分别为43%、28%、30%,根表面积的相对抑制率分别为46%、33%、35%,根体积的相对抑制率分别为47%、32%、29%;根直径的相对抑制率分别为29%、21%、22%。可见,基因在维持转基因番茄响应干旱胁迫下的根系大小和形态指标上具有重要作用。

(*表示同一处理不同株系番茄根系间差异达P<0.05显著水平,n=9)
2.3 水分胁迫对番茄地上部和根系干物质量及蔗糖含量的影响
在模拟干旱胁迫条件下,各株系番茄地上部和根系的生长均受到了一定程度的抑制。从图3A和图3B中可以看出,野生型番茄受水分胁迫影响较为严重,地上部干物质量下降了34%,根系干物质量下降了27%;而转基因番茄地上部干物质量仅下降19%,根系干物质量仅下降14%。
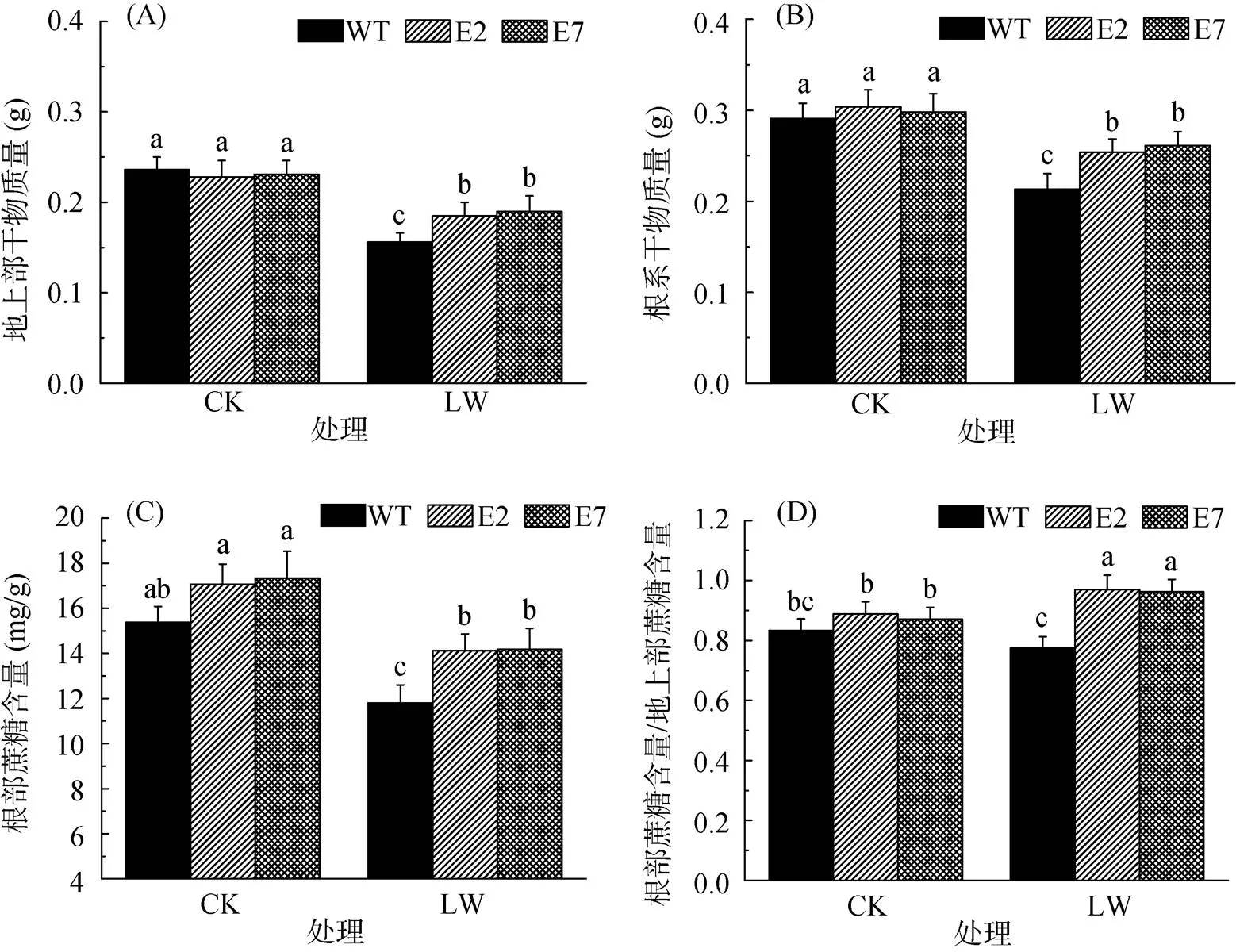
(柱图上方不同小写字母表示处理间差异达P<0.05显著水平(n=9),下同)
进一步比较WT、E2和E7番茄根系蔗糖含量以及根系和地上部蔗糖含量的比值(图3C和3D),转基因番茄在水分胁迫下其根系蔗糖含量相比野生型显著高出约20%,同时转基因番茄根系和地上部蔗糖含量比值在水分胁迫下上升了10%,而野生型却下降了7%,但3个株系地上部蔗糖含量无显著差异。这些结果说明,GRF9能够促进番茄根系蔗糖含量的增加、干物质的积累。
2.4 水分胁迫对番茄根系泌酸量和质膜H+-ATP酶活性的影响
图4A和4B显示,在模拟干旱胁迫下,转基因番茄根系质子泌酸量和根系质膜H+-ATP酶活性受水分胁迫的抑制程度较小,分别抑制了18% 和20%,而野生型番茄受到较为严重的抑制,分别抑制了33% 和30%。转基因番茄的泌酸量和质膜H+-ATP酶活性分别比野生型高33% 和27%。说明GRF9能够促进番茄根系质子分泌,维持根系较好地生长以提高对水分胁迫的耐受性。
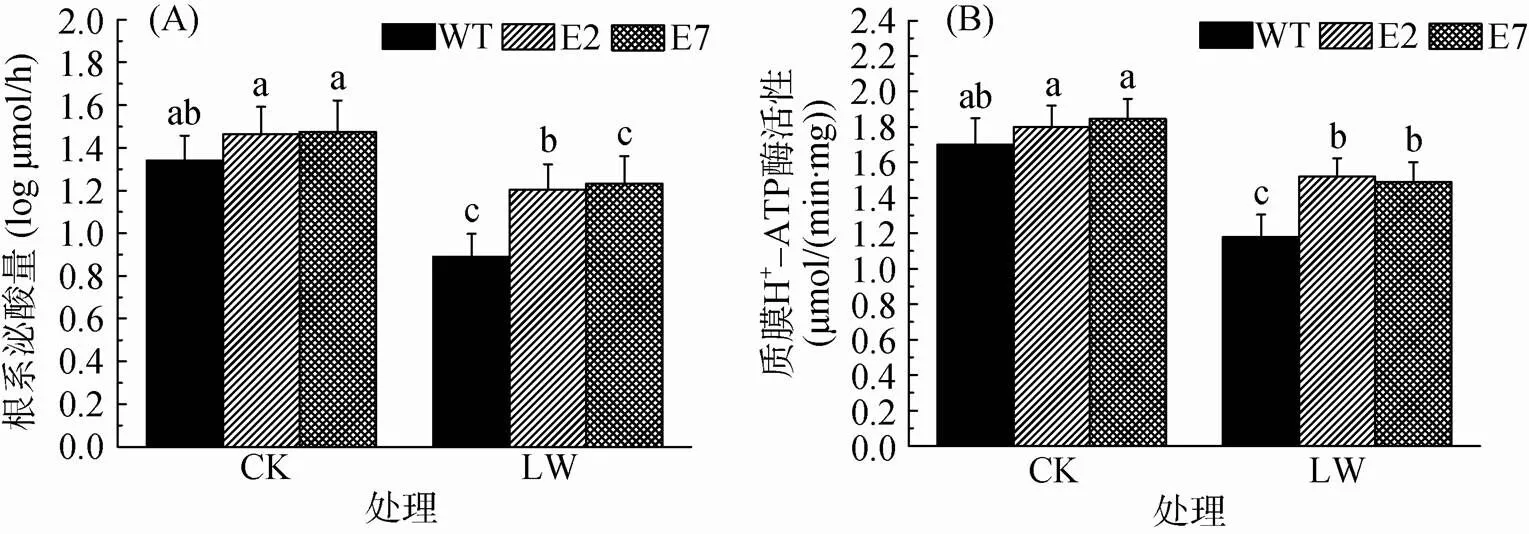
图4 水分胁迫下各株系番茄根系的泌酸量和质膜H+-ATP酶的活性
3 讨论
番茄是世界上种植面积较大的主要设施蔬菜和重要的经济作物,也是我国主要的设施蔬菜之一,尤其在新疆等地加工番茄也形成区域化布局、产业化生产[26-27]。番茄生长发育对水分的要求较高[1-3]。然而,我国水资源匮乏,约一半的国土面积为干旱和半干旱地区[27-28]。由于水分短缺造成的干旱,严重影响了植物的生长发育,造成作物减产[29-30],因此,提高以番茄为代表的作物的抗旱能力成为现代植物育种工作急需解决的关键问题。根系是植物重要的组成部分,是植物吸收养分和水分的重要器官,能够最先感知植物生长的土壤环境变化[8,14,31-33]。研究认为,对干旱敏感的作物,其根系生长受抑制程度会比耐干旱品种明显,抗旱品种具有较为发达的根系,因而在筛选作物耐旱品种时,常常把干旱胁迫下作物根总长、根表面积、根体积和根直径这些根系形态指标的变化作为选种的参考依据[2,8,33-35]。虽然拟南芥过表达株系的总根长在10% PEG8000 模拟的干旱胁迫下,相比野生型拟南芥、拟南芥突变体而言,表现出较强的生长能力[12];但目前并不清楚该基因是否可以在模式蔬菜番茄中起作用,同时也不清楚GRF9是否能够使根系形态方面的根表面积、根体积和根直径也发生适应性的变化以满足植物对水分的需求。在本研究中,正常水分培养(CK)下,3个株系(WT、E2、E7)总根长的绝对值分别为528、497、504 cm,根表面积绝对值分别为36.2、33.7、34.1 cm2,根体积绝对值分别为0.213、0.188、0.183 cm3,根直径绝对值分别为0.257、0.250、0.248 mm。图2结果表明,20% PEG6000模拟的干旱胁迫处理6 d后,转基因番茄的两个株系(E2、E7)不仅总根长的生长能力大于野生型,而且根系的根表面积、根体积和根直径的生长受抑制程度也明显比野生型番茄小。说明GRF9减缓了干旱胁迫对番茄根系在总根长、根表面积、根体积和根直径生长的抑制作用。相比野生型番茄,转基因番茄根系的总根长、根表面积、根体积和根直径在响应水分胁迫的生长中更有优势。
植物为了促进根系生长,会适当减弱地上部的生长将光合作用产生的碳水化合物转运到根系作为补偿来适应干旱胁迫[14,36]。研究认为14-3-3蛋白通过与其他互作蛋白相互作用参与植物中很多的新陈代谢过程,调控植物生长发育,提高植物适应环境胁迫的能力[15,37]。利用转反义技术减少14-3-3蛋白和在拟南芥中表达,致使拟南芥叶片中的淀粉累积增加,而蔗糖含量减少[38]。14-3-3蛋白对蔗糖磷酸合成酶的调控,使得植物偏向于将地上部光合作用产生的碳水化合物通过韧皮部向下运输给根系,为根系在干旱胁迫下的生长提供能源物质,有助于植物根系扩大吸收面积,吸收更多的水分适应干旱胁迫的环境[12,32,36,39-40]。图3A和3B中,野生型和转基因番茄的地上部和根系干物质量均受到了水分胁迫的影响,但转基因番茄的根系干物质量依然高于野生型番茄。通过进一步研究不同处理下各株系番茄地上部和根系蔗糖含量的变化,结果显示(图3C和3D),GRF9增加了番茄根系蔗糖含量,使得根系蔗糖含量占比地上部蔗糖含量高于正常水分培养下的番茄。本研究推测,GRF9可能像在拟南芥中一样,参与调控番茄地上部光合作用产物向根系运输,为根系响应水分胁迫的生长提供能源物质[12,15]。
另外,植物细胞酸化生长学说认为细胞的伸长是由质子酸化引起细胞壁疏松而诱发的,而植物根系的生长需要依赖于根系细胞的伸长[41]。植物中的14-3-3蛋白通过与质膜H+-ATP酶自抑制区的结合建立一个高活性不稳定的ATPase:14-3-3蛋白复合体,以激活质膜H+-ATP酶的活性,质膜H+-ATP酶转运质子促使根系能够向细胞外分泌更多的质子,参与根系生长[42]。本试验发现,GRF9能够提高番茄根系质膜H+-ATP酶的活性,尤其是在水分胁迫下,其活性比同一处理下的野生型番茄高25%。因而,干旱胁迫下的转基因番茄相比野生型番茄根系有较强的分泌质子的能力,转基因番茄根系泌酸量高出野生型33%(图4A和4B),有利于转基因番茄根系的伸长。
4 结论
拟南芥14-3-3蛋白GRF9如同在拟南芥中一样,通过影响番茄根系的蔗糖含量以及调控根系质膜H+-ATP酶活性,使得转基因番茄根系的生长能力显著高于野生型。另外,GRF9也通过促进根系的总根长、根表面积、根体积和根直径,提高番茄植物对干旱胁迫的适应能力。作为模式蔬菜的抗旱品种,该转基因番茄在节水农业中的应用值得后续进一步探讨。但干旱对植物形态和生理指标的影响很复杂,GRF9能否通过其他途径提高番茄对干旱胁迫的抗性还需要进一步研究。
[1] Mu L, Fang L. Changes in tomato fruit quality and antioxidant enzyme activities under deficit irrigation and fertilizer application in a solar greenhouse in northwest China[J]. Communications in Soil Science & Plant Analysis, 2016, 47(10): 1329–1341.
[2] 刘朝霞, 余焰文, 陈艳秋, 等. 水分胁迫对苗期番茄叶片保护酶活性和植株形态的影响[J]. 北方园艺, 2015(23): 1–5.
[3] Nuruddin M M, Madramootoo C A, Dodds G T. Effects of water stress at different growth stages on greenhouse tomato yield and quality[J]. Hortscience, 2003, 38(7): 1389–1393.
[4] Neumann P M. Coping mechanisms for crop plants in drought-prone environments[J]. Annals of Botany, 2008, 101(7): 901–907.
[5] Davies W J, Zhang J. Root signals and the regulation of growth and development of plants in drying soil[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1991, 42: 55–76.
[6] 沈融, 章建新, 古丽娜, 等. 亏缺灌溉对大豆根系生长和养分积累及产量的影响[J]. 大豆科学, 2011, 30(1): 62– 66.
[7] Kato Y, Okami M. Root growth dynamics and stomatal behaviour of rice (L.) grown under aerobic and flooded conditions[J]. Field Crops Research, 2010, 117(1): 9–17.
[8] 高世斌, 冯质雷, 李晚忱, 等. 干旱胁迫下玉米根系性状和产量的QTLs分析[J]. 作物学报, 2005, 31(6): 718– 722.
[9] 唐文帮, 邓化冰, 肖应辉, 等. 两系杂交水稻C两优系列组合的高产根系特征[J]. 中国农业科学, 2010, 43(14): 2859–2868.
[10] Mayfield J D, Folta K M, Paul A L, et al. The 14-3-3 proteins μ and υ influence transition to flowering and early phytochrome response[J]. Plant Physiology, 2007, 145(4): 1692–1702.
[11] Roberts M R. 14-3-3 proteins find new partners in plant cell signaling[J]. Trends in Plant Science, 2003, 8(5): 218–223.
[12] He Y C, Wu J J, Lv B, et al. Involvement of 14-3-3 protein GRF9 in root growth and response under polyethylene glycol-induced water stress[J]. Journal of Experimental Botany, 2015, 66(8): 2271–2281.
[13] Mayfield J D, Paul A L, Ferl R J. The 14-3-3 proteins of Arabidopsis regulate root growth and chloroplast development as components of the photosensory system[J]. Journal of Experimental Botany, 2012, 63(8): 3061–3070.
[14] Gowda V R P, Henry A, Yamauchi A, et al. Root biology and genetic improvement for drought avoidance in rice[J]. Field Crops Research, 2011, 122(1): 1–13.
[15] Comparot S, Lingiah G, Martin T. Function and specificity of 14-3-3 proteins in the regulation of carbohydrate and nitrogen metabolism[J]. Journal of Experimental Botany, 2003, 54(382): 595–604.
[16] Palmgren M G. Plant plasma membrane H+-ATPases: Powerhouses for nutrient uptake[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 2001, 52: 817–845.
[17] Gao N, Shen W S, Cao Y, et al. Influence of bacterial density during preculture on Agrobacterium-mediated transformation of tomato[J]. Plant Cell, Tissue and Organ Culture, 2009, 98(3): 321–330.
[18] 王关林, 方宏筠. 植物基因工程[M]. 北京: 科学出版社, 2002.
[19] Li G J, Xu W F, Kronzucker H J, et al. Ethylene is critical to the maintenance of primary root growth and Fe homeostasis under Fe stress in Arabidopsis[J]. Journal of Experimental Botany, 2015, 66(7): 2041–2054.
[20] Gao N, Su Y H, Min J, et al. Transgenic tomato overexpressing ath-miR399d has enhanced phosphorus accumulation through increased acid phosphatase and proton secretion as well as phosphate transporters[J]. Plant and Soil, 2010, 334:123–136.
[21] 孙志国, 刘冉, 吴昊, 等. 保水缓释肥对盐胁迫下水稻生长和光合特性的调控[J]. 土壤学报, 2016, 53(3): 757– 767.
[22] Stitt M, Lilley R M, Gerhardt R, et al. Metabolite levels in specific cells and subcellular compartments of plant- leaves[J]. Methods in Enzymology, 1989, 174: 518–552.
[23] Du J Y, Xie J, Yue L X. Modulation of TRPM2 by acidic pH and the underlying mechanisms for pH sensitivity[J]. Journal of General Physiology, 2009, 134(6): 471–88.
[24] Zhang R, Liu G, Wu N, et al. Adaptation of plasma membrane H+-ATPase and H+pump to P deficiency in rice roots[J]. Plant and Soil, 2011, 349(1/2): 3–11.
[25] Shen H, Chen J, Wang Z, et al. Root plasma membrane H+-ATPase is involved in the adaptation of soybean to phosphorus starvation[J]. Journal of Experimental Botany, 2006, 57(6): 1353–1362.
[26] 康亚龙, 景峰, 孙文庆, 等. 加工番茄连作对土壤理化性状及微生物量的影响[J]. 土壤学报, 2016, 53(2): 533–542.
[27] 孟超然, 颜林, 张书捷, 等. 干旱区长期膜下滴灌农田耕层土壤盐分变化[J]. 土壤学报, 2017, 54(6): 1386–1394.
[28] 关中美, 郝成元. 我国干旱半干旱地区脆弱生态系统及其退化成因[J]. 生态经济, 2013(9): 158–162.
[29] 武慧平, 朱铭强, 张盼盼, 等. 土壤含水量对温室樱桃番茄生长发育及果实品质的影响[J]. 干旱地区农业研究, 2012, 30(4): 32–36.
[30] 侯建伟, 段玉, 张君, 等. 内蒙古阴山北麓旱农区马铃薯间作模式的生产力与水分利用[J]. 土壤, 2018, 50(1): 79–85.
[31] 李文娆, 张岁岐, 丁圣彦, 等. 干旱胁迫下紫花苜蓿根系形态变化及与水分利用的关系[J]. 生态学报, 2010, 30(19): 5140–5150.
[32] Baluska F, Mancuso S, Volkmann D, et al. Root apex transition zone: a signaling-response nexus in the root[J]. Trends in Plant Science, 2010, 15(7): 402–408.
[33] 于建光, 吴一凡, 贺笑, 等.不同条件育秧提高水稻秧苗抗逆性的研究[J]. 土壤, 2017, 49(2): 289–294.
[34] 降云峰, 马宏斌, 刘永忠, 等. 玉米抗旱性鉴定指标研究现状与进展[J]. 山西农业科学, 2012, 40(7): 800–803.
[35] 马廷臣, 余蓉蓉, 陈荣军, 等. PEG-6000模拟干旱对水稻幼苗期根系的影响[J]. 中国生态农业学报, 2010, 18(6): 1206–1211.
[36] Sharp R E, Poroyko V, Hejlek L G, et al. Root growth maintenance during water deficits: physiology to functional genomics[J]. Journal of Experimental Botany, 2004, 55(407): 2343–2351.
[37] Roberts M R, Salinas J, Collinge D B. 14-3-3 proteins and the response to abiotic and biotic stress[J]. Plant Molecular Biology, 2002, 50(6): 1031–1039.
[38] Schenk H J, Jackson R B. Rooting depths, lateral root spreads and below- ground/ above- ground allometries of plants in water- limited ecosystems[J]. Journal of Ecology, 2002, 90(3): 480–494.
[39] Petricka J J, Winter C M, Benfey P N. Control of Arabidopsisroot development. Annual Review of Plant Biology, 2012, 63(1): 563–590.
[40] Cotelle V, Meek S E M, Provan F, et al. 14-3-3s regulate global cleavage of their diverse binding partners in sugar-starved Arabidopsis cells[J]. The Embo Journal, 2000, 19(12): 2869–2876.
[41] Rayle D L, Cleland R E. The Acid Growth Theory of auxin-induced cell elongation is alive and well[J]. Plant Physiology, 1992, 99(4): 1271–1274.
[42] Borch J, Bych K, Roepstorff P, et al. Phosphorylation- independent interaction between 14-3-3 protein and the plant plasma membrane H+-ATPase[J]. Biochemical Society Transactions, 2002, 30(4): 411–415.
Involvement of Arabidopsis GRF9 in Tomato Root Growth and Response Under Polyethylene Glycol Induced Water Stress
ZHANG Lili1,2, LI Guangjie1, LU Yufang1, SHI Weiming1*
(1 State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2 University of Chinese Academy of Sciences, Beijing 100049, China)
In order to improve water stress tolerance of tomato () plants, an expression vector containing an arabidopsis 14-3-3 protein,General Regulatory Factor 9 () cDNA driven by a cauliflower mosaic virus 35S promoter was transferred into tomato plants. Tomato wild-type (WT), two lines of GRF9-overexpressing tomato plants (E2, E7) were treated with 20% polyethylene glycol (PEG6000) to induce water stress under hydroponic culture conditions. Results showed: 1) The degree of water stress tolerance of transgenic tomato plants was found to be significantly greater than that of wild-type tomato plants as measured by root architecture development. The relative inhibition ratio-s of total root length of three lines tomato plants (WT, E2, E7) were 43%, 28% and 30%, respectively; the relative inhibition ratio of root surface area of three lines tomato plants (WT, E2, E7) were 46%, 33% and 35%, respectively; the relative inhibition ratio of root volume of three lines tomato plants (WT, E2, E7) were 47%, 32% and 29%, respectively; the relative inhibition ratio of root diameter of three lines tomato plants (WT, E2, E7) were 29%, 21% and 22%, respectively. 2) GRF9 favored the accumulation of sucrose in transgenic tomato (E2, E7) roots, and the root dry weight was 23% higher than that of WT. 3) In addition, GRF9 enhanced the activity of plasma membrane H+-ATPase in transgenic tomato (E2,E7) roots, and the root proton secretion was 35% higher than that of WT. Taken together, all the results indicated that under PEG-induced water stress, GRF9 is involved in enhancing proton secretion and accumulating more sucrose in the root to guarantee greater root architecture development on total root length, root surfaces area, root volume and root diameter. Therefore, Arabidopsis GRF9 plays an important role for tomato plants response to water stress.
;; Root architecture; Proton secretion; Water stress
Q945.12
A
10.13758/j.cnki.tr.2020.01.011
章丽丽, 李光杰, 陆玉芳, 等. 拟南芥14-3-3蛋白GRF9调控番茄根系响应水分胁迫的生理机制. 土壤, 2020, 52(1): 74–80.
江苏省青年基金项目(BK20151053) 和中国科学院南京土壤研究所知识创新工程领域前沿项目(ISSASIP1604)资助。
章丽丽(1989—),女,浙江绍兴人,博士研究生,主要从事植物营养生理生化与分子遗传方面的研究。E-mail:llzhang@issas.ac.cn

