不同水稻品种磷利用效率与耐铝性的关系研究①
胡安永,赵学强,沈仁芳,马建锋,3
不同水稻品种磷利用效率与耐铝性的关系研究①
胡安永1,2,赵学强1,沈仁芳1,马建锋1,3*
(1土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2中国科学院大学,北京 100049;3冈山大学植物科学与资源研究所,日本冈山 710-0046)
铝毒和磷缺乏是酸性土壤上作物生产的主要限制因子。本研究中我们探究了5个粳稻和5个籼稻品种的磷利用效率和耐铝性之间的相互关系。结果表明,粳稻品种的耐铝性显著高于籼稻品种。对于耐铝性强的水稻品种,施加磷肥后地上部生物量显著增加,而铝敏感的品种对磷肥响应较小,这可能是由于其耐铝性差而酸性土壤中的铝毒导致根系结构和功能受损,从而影响养分的吸收和利用。不同水稻品种的耐铝性和磷吸收效率呈正比而与磷利用效率呈反比,且粳稻的地上部磷浓度及磷吸收效率高于籼稻,但磷利用效率则低于籼稻。这些结果对于酸性土壤中筛选耐铝和磷高效利用的水稻品种具有重要意义。
粳稻;籼稻;耐铝性;磷吸收效率;磷利用效率;水稻
铝毒和磷缺乏通常共存于酸性土壤中并严重抑制作物的生长和发育。铝毒是酸性土壤中限制作物生产的主要限制因子。土壤pH < 5时,土壤溶液中的Al3+会明显抑制植物根系发育及其功能,从而阻碍了根系水分和养分的吸收,导致作物减产[1-3]。据估计,世界上多达50% 的潜在耕地是酸性土壤[4-5]。
磷缺乏是农业生产中另一个主要限制因子,此外,由于酸性土壤中的金属阳离子(Al3+,Fe3+)对磷的固定作用,以及磷有机复合体的形成[6],再加上磷离子以扩散而非集流的方式在土壤中流通,使得世界上30% ~ 40% 耕地的有效磷含量不能满足植物正常生长发育的需要[7]。更为严峻的是,磷肥的主要来源磷矿石,是一种非可再生资源且在世界范围内濒临枯竭[8]。因此,从可持续发展角度考虑,针对酸性土壤磷的有效性低这一问题,我们应该考虑如何筛选磷高效的作物品种。作物磷高效包括更高的磷吸收效率,即植物通过调整根系构型或者增加根系有机酸的分泌增加外部磷的吸收,另一方面,在磷吸收较低情况下增加内部磷的利用效率以保证作物产量[9]。然而,在长期的进化过程中植物是否已经同时具有耐铝和磷高效的遗传特性目前研究较少。先前关于磷和铝的报道大多数只是对同一物种的两个品种进行比较研究,以说明耐铝的品种磷高效或者磷高效的品种更耐铝。例如,施磷条件下磷高效的大豆品种更耐铝[10-11],他们认为磷高效大豆品种在施磷条件下耐铝性强不仅仅是因为铝磷直接的螯合作用,而主要原因则与其具有更高的磷效率以及铝耐性和酸耐性有重要关系。铝毒存在下,耐铝的小麦和柑橘能够吸收更多的磷,且根系和茎秆中磷浓度更高[12-13]。
然而,作物磷高效既包括吸收效率,还有利用效率。因此,对于耐铝性强的品种是具有更高的磷吸收效率还是利用效率仍不是十分清楚。水稻()是非常重要的粮食作物,世界上超过1/2的人口都以水稻为主要食物来源[14-15]。此外,我国酸性土壤面积较大,且这些地区主要以种植水稻为主,因此研究酸性土壤中水稻磷和铝之间的相互关系对农业生产具有重要的指导意义。本研究中,我们随机选择了10个不同基因型的水稻品种,通过土培和水培试验研究了不同水稻品种耐铝性和磷效率之间的关系。
1 材料与方法
1.1 植物材料和生长条件
随机选择10个不同基因型的水稻品种,其中包括5个粳稻(Wuyunjing7、Nipponbare、Nanjing46、Oochikara、Koshihikari),还有5个籼稻(Yangdao6、Zhonghan35、Yangfuxian2、Kasalath、IR26)。水稻种子用10% H2O2消毒10 min,用去离子水冲洗3次后黑暗条件下浸泡24 h,然后在去离子水湿润的滤纸上催芽24 h。随后,水稻幼苗转移至盛有0.5 mmol/L CaCl2(pH 4.5)的浮板上培养3 d。
选择生长一致的水稻幼苗(5 d)转移至修改后的木村B营养液中。该营养液包含NH4NO3(0.5 mmol/L),NaH2PO4·2H2O (0.2 mmol/L),KCl (0.55 mmol/L),CaCl2·2H2O (0.36 mmol/L),MgSO4·7H2O (0.55 mmol/L),FeSO4·7H2O-EDTA (20μmol/L),H3BO3(50 μmol/L),MnCl2·4H2O (9 μmol/L),CuSO4·5H2O (0.3 μmol/L),ZnSO4·7H2O (0.7 μmol/L),Na2MoO4·2H2O (0.5 μmol/L),pH为5.0。8 d后,生长13 d的水稻幼苗分别用来进行土培和水培试验。
1.2 水培和土培试验
水培试验选择生长13 d的水稻幼苗进行如下处理,+P:0.2 mmol/L NaH2PO4·2H2O;–P:0.01 mmol/L NaH2PO4·2H2O,营养液中其他成分同上,且均加入AlCl3·6H2O 使溶液中Al3+浓度为50 μmol/L,pH为5.0。水稻幼苗生长在人工生长室,此生长室为光照14 h,黑暗10 h,温度为 (25±2) ℃,相对湿度为65% ± 5%,光强为300 μmol/(m2·s)。水稻在生长室中培养处理25 d,期间每两天更换一次营养液,每个处理重复3次。
土培试验在有自然光的玻璃温室中进行(26 ℃,光照14 h)。所用酸性土壤为第四纪红黏土,其基本理化性质如下,pH:4.64,碱解氮:37.14 mg/kg,有效磷:0.19 mg/kg,有效钾:51.83 mg/kg,可交换性铝:470.75 mg/kg。试验处理如下,+P:P 50 mg/kg土;–P:P 0 mg/kg土,所有处理均施 N 330 mg/kg 土,施K 210 mg/kg 土,土培试验氮磷钾施用量分别为尿素、过磷酸钙和氯化钾经换算所得纯氮磷钾量。水稻在酸性土壤中生长40 d且每个处理均设置3个重复。
1.3 相对根伸长测定
选择生长5 d的长势一致的水稻幼苗,分别在0.5 mmol/L CaCl2(pH 4.5) 且有无30 μmol/L Al (AlCl3·6H2O)的溶液中处理24 h。用尺子量取10个水稻品种处理前后的根伸长,每个品种选择20条根测定。相对根伸长计算如下:(+Al根伸长/-Al根伸长)×100。由于不同水稻品种根伸长差异很大,因此,相对根伸长这一指标能很好地用来比较不同水稻品种之间的耐铝性差异。
1.4 样品收集
经过不同处理后,水培试验分别收集根系和地上部。土培试验由于根系难以取样则只收集了不同品种的地上部。所有植物样品用去离子水冲洗干净后,105 ℃ 杀青30 min,然后75 ℃ 烘干至恒重。
1.5 植物样品磷浓度测定
所有烘干后的样品经粉碎研磨后,用于测定其磷浓度。称取约0.3 g植物样品进入50 ml玻璃管,然后加入4 ml H2SO4过夜,样品经180 ℃消煮溶解后加H2O2至样品完全消解至澄清。消解液经适当稀释后用钼蓝比色法进行P的测定。
1.6 磷吸收效率和利用效率的计算
磷吸收效率=/RDW,:水稻植株总磷含量(mg);RWD:根系干重(g)
磷利用效率= SDW/P,SDW:地上部干重(g),P:地上部磷含量(mg)。
1.7 数据分析
土培和水培试验过程中,不同处理盆栽随机放置且每天调换位置。数据计算与分析采用Microsoft Excel 2010和SPSS 20.0。数据之间的差异性以及相关性分别用Duncan检验和Pearson相关分析。
2 结果与分析
2.1 不同水稻品种间耐铝性差异比较
铝毒对植物最直接的影响就是抑制根系的伸长,微摩尔的铝处理几分钟或者几小时便能观察明显的抑制现象。因此,相对根伸长是反映植物耐铝性最重要的参考指标[16]。本研究中,我们用相对根伸长这一指标比较了粳稻和籼稻的耐铝性差异(图1)。结果表明,粳稻的相对根伸长显著大于籼稻,表明粳稻的耐铝性要显著高于籼稻。其中,Yangfuxian2、Kasalath和IR26在所有品种中的耐铝性最差。

(每个图柱表示10次重复的平均值,小写字母不同表示各处理间存在显著性差异(P<0.05),Duncan 检验)。
2.2 不同水稻品种在水培和土培试验中的生长状况
对于土培试验,在不施加磷肥条件下,不同水稻品种的地上部生物量都很低(图2A)。当施加磷肥后,不同水稻品种的地上部生物量都显著增加,但Yangfuxian2、Kasalath和IR26改善效果较小。水培试验结果表明,籼稻品种在高磷条件下地上部生物量较低磷条件均明显增加,然而粳稻品种,特别是Wuyunjing7、Nanjing46和Oochikara在高磷和低磷条件下的生物量差异不显著(图2B)。水培条件下不同水稻品种根系生物量基本不受磷的影响(图2C)。
2.3 不同水稻品种在水培和土培试验中的植株磷含量变化
土培试验不施加磷肥或水培试验低磷条件下,不同水稻品种地上部磷含量没有显著差异(图3A、3B)。土培试验施加磷肥后,水稻地上部磷含量显著增加,但耐铝性差的Yangfuxian2、Kasalath和IR26增加较小(图3A)。水培试验增加溶液磷浓度,水稻地上部磷含量也显著升高,且粳稻品种的磷含量要高于籼稻品种(图3B)。水培试验中粳稻和籼稻品种在低磷和高磷条件下的根系磷含量差异均较小(图3C)。
2.4 不同水稻品种磷吸收和利用效率
根据我们的结果,土培试验 +P以及水培试验(-P或+P)条件下,籼稻的磷利用效率总体上要大于粳稻(图4B ~ 4D)。然而土培试验-P条件下,不同水稻品种的磷利用效率没有显著差异(图4A),这可能是由于本研究中酸性土壤中有效磷含量非常低,不足以满足水稻正常生长发育的需求,因此不同水稻品种间磷利用效率无显著差异。
水培试验低磷条件下不同水稻品种的磷吸收效率没有显著性差异,但是高磷条件下粳稻的磷吸收效率要明显大于籼稻品种(图4E)。
2.5 水稻耐铝性和磷吸收及利用效率的关系
结果表明,除了土培试验-P条件下水稻相对根伸长与磷利用效率无相关关系外(图5A),其他处理下的水稻相对根伸长与磷利用效率呈显著负相关关系(图5B ~ 5D)。然而,不同水稻的相对根伸长与水培试验-P 和 +P 条件下的磷吸收效率呈正相关关系(图5E、5F)。
3 讨论
3.1 不同水稻品种在酸性土壤上的响应
酸性土壤占世界耕地面积的35% 和潜在耕地的50%[4,17]。大多数酸性土壤中会存在很多阻碍植物正常生长和发育的限制因子,其中铝毒和磷缺乏通常是最重要的限制因素[2]。磷作为植物必需的大量营养元素在植物的生长和发育过程中发挥着重要作用。它不仅是植物中很多重要化合物的组成成分,如核酸、蛋白质和磷脂,而且在植物光合作用、呼吸作用以及很多酶促反应中扮演着非常重要的角色[18]。因此,植物细胞内磷的动态平衡对于其正常的生理和生化过程是非常重要的。本研究结果表明,土培试验施加磷肥后水稻地上部生物量显著增加(图2A),这是由于本试验所用酸性土壤中有效磷非常低,施加磷肥后会增加水稻对磷的吸收利用而显著增加生物量,这也说明酸性土壤中磷对于植物的重要作用。
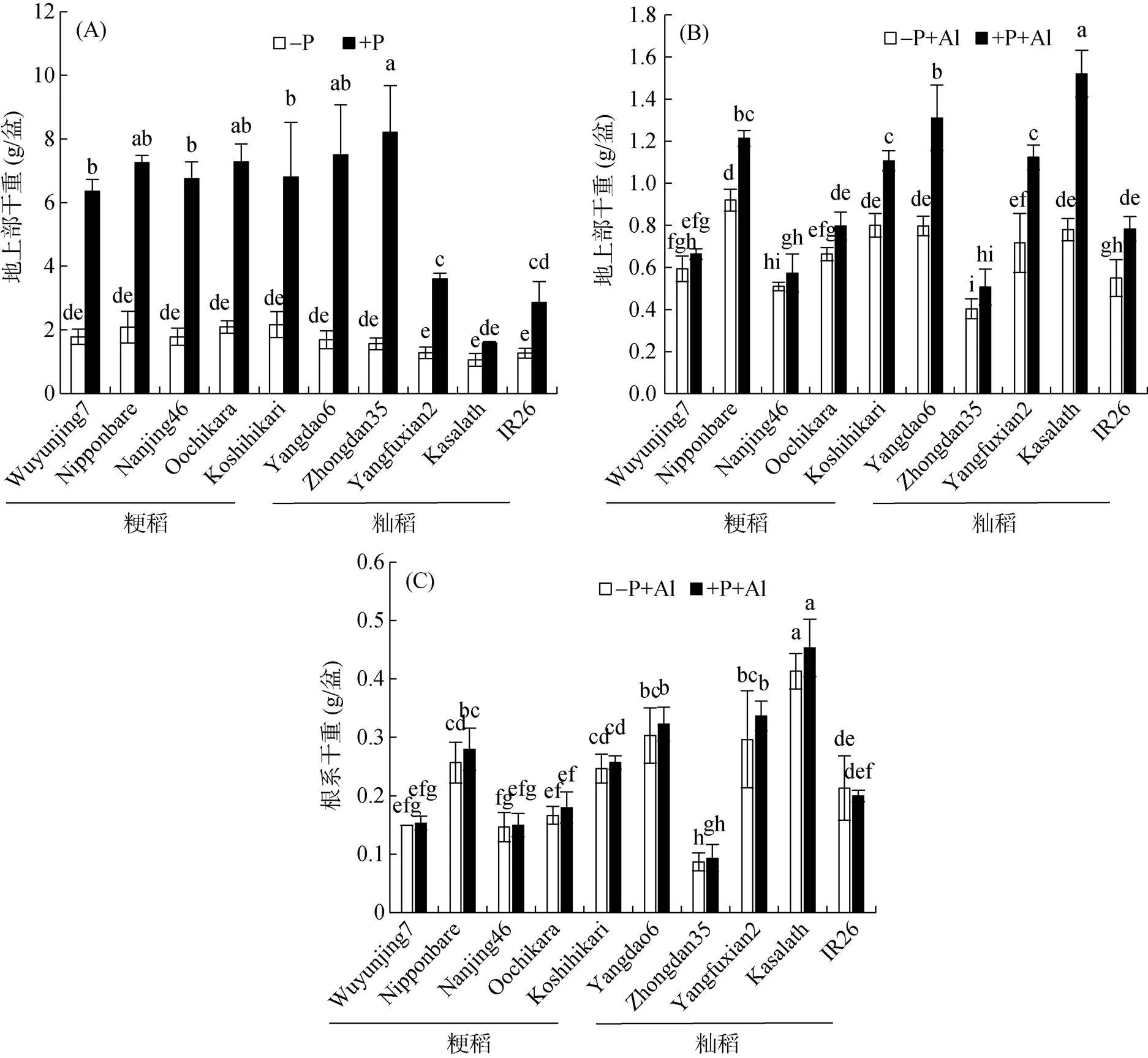
(A:土培试验;B、C:水培试验;每个图柱表示3次重复的平均值,小写字母不同表示各处理间存在显著性差异 (P<0.05,Duncan 检验);下图同)
相对于其他品种,Yangfuxian2、Kasalath和IR26在施加磷肥后生物量的增加更小(图2A)。因此,我们猜测这是否由于这3个品种的磷效率很低所导致。然而,先前有研究报道,Kasalath和IR26被认为是磷高效的水稻品种,特别是Kasalath[19]。但是,根据我们的水培试验结果,这3个品种在高磷下的地上部生物量比低磷显著增加,特别是Kasalath增加了接近两倍(图2B)。因此,我们认为这可能是由于Yangfuxian2、Kasalath和IR26的耐铝性最差从而导致施加磷肥后生物量增加较少。铝毒不仅会影响这3个品种的根伸长,在酸性土壤中生长时,还有可能影响它们的根系构型(根表面积和体积),从而影响根系对水分和养分的吸收利用,所以即使施加磷肥也对其改善效果较小。本研究结果表明,在酸性土壤中,施加磷肥能够显著改善耐铝性强的水稻品种的生长,如粳稻品种。然而,对于铝敏感性的水稻品种,可能首先需要通过采取措施降低酸性土壤中的铝浓度以解决铝离子对根系的毒害,之后再去考虑植物对养分的吸收和利用。
3.2 不同水稻品种耐铝性和磷效率关系
先前研究表明,磷高效的大豆品种具有更强的耐铝性[10, 20]。磷高效大豆品种具有更发达的根系,而且这些根系位于有效磷更高和铝毒害更小的土壤表层,因此,它可以保证植物从土壤表层更有效地吸收磷而维持其正常生长发育的磷需求。然而,之前研究并没有明确是磷吸收效率还是利用效率与耐铝性存在关系。本研究结果表明,耐铝性与磷利用效率呈显著负相关关系,而与磷吸收效率则呈显著正相关关系。此外,籼稻的磷利用效率要明显高于粳稻,而粳稻的磷吸收效率则比籼稻更高。有研究报道,耐铝性强的小麦(ET8)比铝敏感性小麦(ES8)吸收更多的磷且地上部磷含量更高[12]。耐铝性较强的甜橙植株根、茎和叶中磷含量和磷吸收更高,这可能是由于甜橙植株能够更有效地获取和吸收磷[13]。胡枝子和豇豆的研究中也发现相似的结果[21-22]。这些结果表明,植物体内磷的高效吸收和积累可能是其增强耐铝性的重要原因。本研究结果表明,粳稻品种具有更高的耐铝性、地上部磷含量以及磷吸收效率;而籼稻品种对铝更加敏感,地上部磷含量低但磷利用效率更高(图3、图4)。

图3 不同水稻品种在 –P和 +P下的磷含量


(A、B:土培试验;C ~ F:水培试验)
铝毒和磷缺乏是酸性土壤中作物生长发育的主要限制因子。粳稻的耐铝性强于籼稻,其磷吸收效率也高于籼稻但利用效率则低于籼稻。水稻耐铝性与磷吸收效率呈正比而与磷利用效率呈反比(图5)。本研究对于在酸性土壤中筛选既耐铝又磷高效的水稻品种并深入研究其机理具有重要的指导意义。
[1] Ma J F, Chen Z C, Shen R F. Molecular mechanisms of Al tolerance in gramineous plants[J]. Plant and Soil, 2014, 381(1/2): 1–12.
[2] Kochian L V, Hoekenga O A, Piñeros M A. How do crop plants tolerate acid soils? Mechanisms of aluminum tolerance and phosphorous efficiency[J]. Annual Review of Plant Biology, 2004, 55: 459–493.
[3] Liu J, Piñeros M A, Kochian L V. The role of aluminum sensing and signaling in plant aluminum resistance[J]. Journal of Integrative Plant Biology, 2014, 56(3): 221-230.
[4] Von Uexküll H R, Mutert E. Global extent, development and economic-impact of acid soils[J]. Plant and Soil, 1995, 171(1): 1–15.
[5] Bot A J, Nachtergale F O, Young A. World soil resources report[R]. FAO, Rome, 2000, 111 P.
[6] Raghothama K G, Phosphorus and plant nutrition: An overview. Sims J T, Sharpley A N. Phosphorus: Agriculture and the Environment[C]. Madison: American Society of Agronomy, 2005: 355–378.
[7] Schachtman D P, Reid R J, Ayling S M. Phosphorus uptake by plants: From soil to cell[J]. Plant Physiology, 1998, 116: 447–453.
[8] Vance C P, Ehde-Stone C, Allan D L. Phosphorus acquisition and use: Critical adaptations by plants for securing a nonrenewable resource[J]. New Phytologist, 2003, 157(3): 423–447.
[9] Kimani J M, Tongoona P, Derera J. Breeding dynamics of rice () for enhanced adaptation and grain quality[J]. Scientific Research and Essays, 2013, 8(27): 1258–1272.
[10] Liao H, Wan H Y, Shaff J, et al. Phosphorus and aluminum interactions in soybean in relation to aluminum tolerance: Exudation of specific organic acids from different regions of the intact root system[J]. Plant Physiology, 2006, 141: 674–684.
[11] Liang C Y, Piñeros M A, Tian J, et al. Low pH, aluminum and phosphorus coordinately regulate malate exudation through GmALMT1 to improve soybean adaptation to acid soils[J]. Plant Physiology, 2013, 161: 1347–1361.
[12] Iqbal T. A split-root experiment shows that translocated phosphorus does not alleviate aluminium toxicity within plant tissue[J]. Plant and Soil, 2014, 384(1/2): 21–36.
[13] Yang L T, Jiang H X, Tang N, et al. Mechanisms of aluminum-tolerance in two species of citrus: Secretion of organic acid anions and immobilization of aluminum by phosphorus in roots[J]. Plant Science, 180(3): 521–530.
[14] Chauhan B S, Johnson D E. Ecological studies on echinochloa crus-galli and the implications for weed management in direct-seeded rice[J]. Crop Protection, 2011, 30(11): 1385–1391.
[15] Rose T J, Impa S M, Rose M T, et al. Enhancing phosphorus and zinc acquisition efficiency in rice: A critical review of root traits and their potential utility in rice breeding[J]. Annals of Botany, 2013, 112(2): 331–345.
[16] You J F, He Y F, Yang J L, et al. A comparison of aluminum resistance among Polygonum species originating on strongly acidic and neutral soils[J]. Plant and Soil, 2005, 276(1/2): 143–151.
[17] Ryan P R, Tyerman S D, Sasaki T, et al. The identification of aluminium-resistance genes provides opportunities for enhancing crop production on acid soils[J]. Journal of Experimental Botany, 2011, 62(1): 9–20.
[18] Kamerlin S C L, Sharma P K, Prasad R B, et al. Why nature really chose phosphate[J]. Quarterly Reviews Biophysics, 2013, 46(1): 1–132.
[19] Wissuwa M, Yano M, Ae N. Mapping of QTLs for phosphorus-deficiency tolerance in rice (L.)[J]. Theoretical and Applied Genetics, 1998, 97(5/6): 777–783.
[20] Zhao J, Fu J B, Liao H, et al. Characterization of root architecture in an applied core collection for phosphorus efficiency of soybean germplasm[J]. Chinese Science Bulletin, 2004, 49(15): 1611–1620.
[21] Sun Q B, Shen R F, Zhao X Q, et al. Phosphorus enhances Al resistance in Al-resistant Lespedeza bicolor but not in Al-sensitive L. cuneate under relatively high Al stress[J]. Annals of Botany, 2008, 102(5): 795–804.
[22] Jemo M, Abaidoo R C, Nolte C, et al. Aluminum resistance of cowpea as affected by phosphorus-deficiency stress[J]. Journal of Plant Physiology, 2007, 164(4): 442–451.
Correlation Between Phosphorus-use Efficiency and Aluminum Tolerance in Different Rice Varieties
HU Anyong1,2, ZHAO Xueqiang1, SHEN Renfang1, MA Jianfeng1,3*
(1 State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2 University of Chinese Academy of Sciences, Beijing 100049, China; 3 Institute of Plant Science and Resources, Okayama University, Gangshan 710-0046, Japan)
Both aluminum (Al) toxicity and phosphorus (P) deficiency are limiting factors of crop production on acid soil. In the present study, The correlation between P-use efficiency and Al tolerance in five japonica and five indica rice varieties was investigated. Aluminum tolerance of japonica varieties was significantly higher than those of indica varieties. The shoot dry weight of Al-resistant varieties increased significantly after P application in acid soil, but that of Al-sensitive varieties did not respond to P application. This difference in P-increased growth is probably due to Al-damaged root structure and function in Al-sensitive varieties, resulting in decreased uptake and utilization of nutrients from soil. We found that P-use efficiency was negatively correlated to Al tolerance, while P-uptake ability was positively correlated with Al tolerance. Furthermore, japonica varieties had a higher shoot P concentration and P-uptake ability compared with indica varieties, but had a lower P-use efficiency. These results provided a valuable insight into screening rice varieties with high Al tolerance and P-use efficiency in acid soils.
Japonica; Indica; Al tolerance; P uptake efficiency; P-use efficiency; Rice
Q945
A
10.13758/j.cnki.tr.2020.01.007
胡安永, 赵学强, 沈仁芳, 等. 不同水稻品种磷利用效率与耐铝性的关系研究. 土壤, 2020, 52(1): 47–53.
国家重点基础研究发展计划(973计划)项目(2014CB441000)和中国科学院战略性先导科技专项(XDB15030302,XDB15030202)资助。
胡安永(1988—),男,山东济南人,博士研究生,主要从事水稻营养元素互作机制研究。E-mail: ayhu@issas.ac.cn

