酮康唑抑制氧化亚油酸代谢物介导的外周炎性疼痛机制*
黄文涛,程璐,张耕,胡松
(武汉市第一医院药学部,武汉 430022)
组织损伤导致炎症递质的释放,这些炎症递质使外周伤害感受器敏感并激活,从而导致对背角神经元的传入攻击。瞬时受体电位香草酸亚型-1(transient receptor potential vaniuoed 1,TRPV1)受体是配体门控的阳离子通道,在某些伤害感受器上表达,被有害刺激如热激活,并介导炎性热痛觉过敏[1-2]。在组织炎症过程中,TRPV1活性受多种递质调节,如花生四烯酸代谢物、缓激肽、神经生长因子(nerve growth factor,NGF)和前列腺素[3-5]。激活的一类内源性递质TRPV1由氧化亚油酸代谢产物(oxidized linoleic acid metabolites,OLAM)组成,即9-和13-羟基-10E,12Z-十八二烯酸(9-HODE和13-HODE)及其代谢产物(9-氧自由基和13-氧自由基)。亚油酸为不饱和脂肪酸,在生物体内金属离子作用下氧化,可以转变为γ-亚麻酸,并继而生成为花生四烯酸。研究报道OLAM是,在炎症条件下合成的,如动脉粥样硬化和类风湿关节炎[6-8],慢性胰腺炎患者血清中OLAM含量显著增加[9]。此外,一些研究小组还检测OLAM在内皮细胞、巨噬细胞和中性粒细胞[10-11],以及在组织炎症过程中激活的细胞类型。然而,研究发现OLAM能够激活外周组织和脊髓背角的TRPV1[12]。重要的是,由于不知道OLAM在组织炎症期间是否促进外周TRPV1的激活,所以对这个系统的认识存在差距。酮康唑可通过干扰细胞色素P450酶的活性,抑制真菌细胞膜主要固醇类——麦角固醇的生物合成,造成真菌细胞膜损伤并改变其通透性,造成重要的细胞内物质外漏而杀伤真菌细胞[13]。
1 材料与方法
1.1实验动物 除了一组野生型和TRPV1基因敲除为C57BL/6小鼠外,其他动物组为雄性Sprague-Dawley(SD)大鼠。实验动物均购自南方医科大学实验动物中心,实验动物生产许可证号:SCXK(粤)2016-0041;实验动物使用许可证号:SYXK(粤)2016-0167。动物在实验前至少饲养7 d,每日17:00~18:00喂食,不论前日饲料有无剩余,均加入当日相应量饲料,大鼠自由饮水。每日明暗时间各为12 h,室温保持在22~25 ℃,相对湿度约50%。
1.2试药 酮康唑注射液(深圳市思美泉生物科技有限公司,批号:2016-0523,规格:每支15 g);亚油酸(linoleic acid,LA,深圳市思美泉生物科技有限公司,批号:2016-1185);抗9-HODE抗体(南京碧云天生物技术有限公司,批号:11252589);抗13-HODE抗体(南京碧云天生物技术有限公司,批号: 001240762);弗罗因德佐剂(CFA,北京恒业中远化工有限公司,批号:2017-08656)。
1.3仪器 贝克曼免疫分析仪(美国贝克曼公司);501型超级恒温器(重庆浩为试验仪器有限公司);24孔聚D-赖氨酸包被板(南京碧云天生物技术有限公司);尼康TE 2000 U显微镜(日本尼康公司)。
1.4三叉神经节(trigeminal ganglion,TG)培养 使用培养1 d的大鼠TG。从正常大鼠中分离TG,用聚D-赖氨酸/层粘连蛋白包被的玻璃盖玻片电镀,置于10%胎牛血清(fetal calf serum,FBS)和100 ng·mL-1NGF中。将3只大鼠的TGs按文献[14]所述方法培养,并置于24孔聚D-赖氨酸包被板上,每孔8000个细胞。培养液在24 h后替换,48 h后再次替换。所有实验均在神经元培养第5天进行。
1.5钙成像 荧光成像法测量感觉神经元钙的蓄积。TG培养物与钙敏感染料Fura-2AM在Hanks改良缓冲液中孵育。用显微镜进行荧光检测。利用MetaFaulor软件对数据进行收集和分析。钙离子流入的净变化通过减去细胞内钙[Ca2+]i水平计算接触到激动剂后达到的[Ca2+]i值。细胞用载体或酮康唑(30 μmol·L-1)进行预处理,15 min后再加入LA(1 mmol·L-1),酮康唑组增加2 min。每个实验结束时,应用LA后,给予250 mmol·L-1氯化钾溶液。双波长激发(340/360 nm)的比值超过0.03被认为是对钙离子流入的积极反应。
1.6脂质提取物的制备 大鼠注射CFA 20 h后,在颈部注射载体或酮康唑9.5 mg·kg-1,皮下注射。注射药物4 h后,处死动物,用6 mm穿孔器收集炎症后足组织。将组织切成小块,转入抗山羊IgG抗体(HBSS)中,37 ℃洗涤,平衡30 min。然后将组织转移到含有载体或酮康唑(150 μmol·L-1)的新鲜HBSS缓冲液中,37 ℃下孵育1 h。在氮气(N2)环境下,干燥样品,再悬浮在HBSS中,并应用于培养的感觉神经元,以确定降钙素与基因相关肽(calcitonin gene related peptide,CGRP)释放。
1.7CGRP释放分析和放射免疫测定 用培养5 d的TG在HBSS溶液中进行实验。在最初的清洗和收集之后,这些神经元在发炎的皮肤上亲脂萃取物之前的15 min,给予媒介物或TRPV1拮抗剂(I-RTX)前处理15 min。收集递质,并在贝克曼免疫分析仪上进行CGRP的放射免疫分析。所有实验重复3次。
1.8行为测定
1.8.1痛阈值的测定 将抗9-HODE抗体和抗13-HODE抗体各25 μg的混合物50 μL,或热变性抗体50 μL,注射到发炎24 h的大鼠后足。注射后15, 30,60 min,测量大鼠热阈值。为了研究酮康唑对CFA热痛觉过敏的影响,在注射CFA造模前30 s,在同侧后足注射酮康唑1次,24 h后注射酮康唑1次。在第2次注射酮康唑后1 h,用热板法测定痛阈值。
1.8.2非综合行为时间的测定 ①大鼠注射CFA造炎症模型前30 s及注射CFA后24 h,对侧足内分别注射载体或酮康唑(相同剂量),1 h后测量热痛觉过敏。②将LA(10,100或1000 μg)或载体(50 μL)足底注射到正常和炎症模型大鼠后足中,每2 min记录一次伤害性反应,直至15 min。③在野生型和TRPV1KO小鼠进行同样实验,方法同上。记录动物非综合行为时间。
1.8.3伤害性行为时间的测定 大鼠后足注射CFA造炎症模型,24 h后进行以下实验。①大鼠后足皮下注射辣椒碱(50 mg·kg-1)或载体,1 h后注射LA 1000 μg。②大鼠足底注射抗9-和抗13-HODE抗体混合物(每种25 μg)或非特异性山羊IgG,,10 min后注射LA 1000 μg。③大鼠在给予LA(1000 μg)前30 min,足底注射酮康唑(4 μg)或载体。记录大鼠出现伤害性行为的时间。

2 结果
2.2OLAM通过抑制CYP减少炎症性热痛觉过敏作用 结果见图1A和1B。CFA显著诱导热痛觉过敏,在24 h效果仍然明显。注射HODE抗体(图1A),在足底注射后30 min,热痛觉过敏明显逆转,热变性抗体(图1B)无明显逆转。在未发炎足中热潜伏期接受两种抗体的混合物 (图1C)或变性抗体(图1D)没有变化。
与媒介物组比较(图2A和2B),足底注射酮康唑1 h后,发炎足明显减少炎性热痛敏。这种效果是注射酮康唑后的外周调节作用在侧后肢,对炎症足无影响。
2.2酮康唑抑制内源性TRPV1的释放受体激动剂 培养的TG神经元在使用递质进行预处理后,随后进行LA刺激,[Ca2+]i增长3倍,至0.156±0.01。酮康唑预处理后,[Ca2+]i为(0.027±0.01),消除LA对 [Ca2+]i增强的影响(P<0.005)。

①与空白组比较,P P
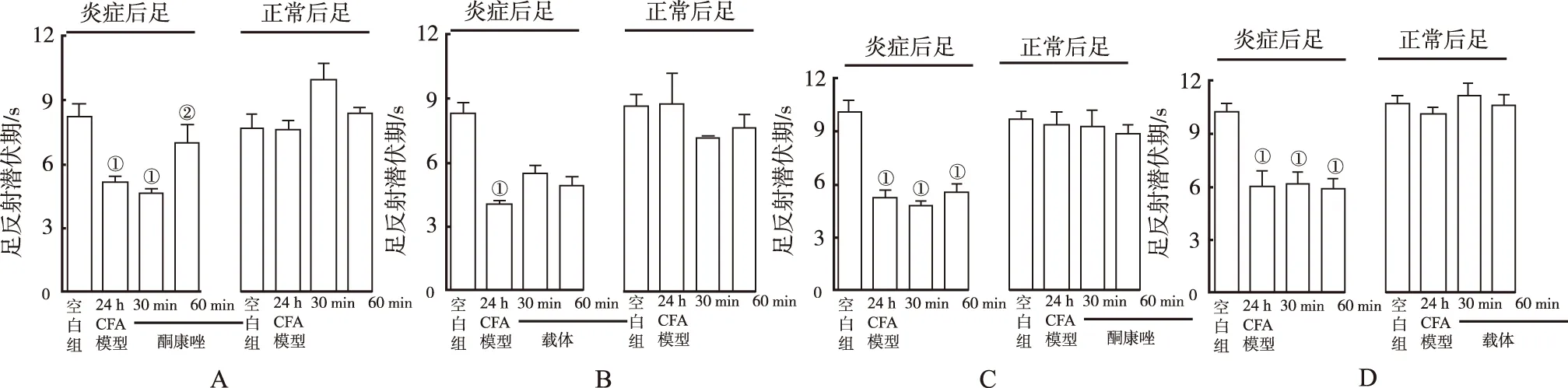
①与空白组比较,P
再悬浮的提取物培养TG引起CGRP的释放增至(980.39±21.04)%,与I-RTX共同处理提取物的CGRP释放减弱至(200.31±10.01)%,CFA/酮康唑+递质处理提取物的CGRP释放减弱至(498.03±13.02%)。
2.3炎症过程中亚油酸诱发的不良反应具有TRPV1依赖性 与递质组比较,正常大鼠后足注射LA后,自发性伤害性反应行为的时间增加不显著。在CFA炎症模型建立后24 h,足底注射LA产生剂量依赖的伤害性镇痛效应。见表1。
表1 CFA对TRPV释放的影响


组别与剂量自发性伤害性反应行为的时间/s正常 递质组0.39±0.04 LA 1000 μg组3.31±0.01CFA炎症模型组 递质组45.03±3.02 LA 10 μg组58.91±5.23 LA 100 μg组78.39±9.04 LA 1000 μg组148.92±13.42F28.459P<0.05
在CFA炎症模型中,注射LA,非综合行为时间为(59.39±10.04)s,而使用CPZ预处理,非综合行为时间为(20.31±8.01)s,可显著减少被唤起的非综合行为(t=12.113,P<0.05)。野生型小鼠CFA炎症模型中,注射LA后,非综合行为时间为(42.39±8.10)s;而在基因敲除TRPV1小鼠中,仅注射递质,非综合行为时间为(5.31±0.41)s,注射LA后,非综合行为的时间为(20.13±5.72) s,显著延长(F=51.263,P<0.05)。
2.4抗HODE抗体抑制LA诱导的疼痛 递质组大鼠伤害性行为时间为(2.11±0.10) s,递质+LA组为(37.02±4.13) s,抗IgG+LA组为(43.28±5.10) s,抗9-HODE+抗13-HODE +LA组伤害性行为时间下调至(12.03±4.13)s,差异有统计学意义(F=40.902,P<0.05)。
2.5酮康唑抑制LA诱导疼痛 递质组大鼠伤害性行为时间为(2.45±0.14) s,递质+LA组为(36.42±6.13) s, 酮康唑+LA组伤害性行为时间下调至(11.28±4.10) s,差异有统计学意义(F=69.132,P<0.05)。
3 讨论
酮康唑属于咪唑类抗真菌药,对真菌麦角甾醇等固醇的生物合成具有抑制作用;对真菌细胞膜具有损伤,可改变其通透性,引起胞内重要物质漏失;同时也可抑制真菌的三酰甘油和磷脂的生物合成,抑制氧化和过氧化酶的活性,致过氧化物在胞内过度积聚,造成真菌亚细胞结构变性和坏死。亚油酸的氧化代谢物在炎症条件下升高,如动脉粥样硬化、类风湿关节炎和慢性胰腺炎[15]。9-HODE、13-HODE及其代谢物是内源性TRPV1激动剂,本研究通过其在炎症热痛觉过敏中的作用,扩大对OLAMs的认识。因此,OLAM不仅可以介导感觉神经元对热刺激的急性反应[16],而且还可以参与慢性炎症的发生。由于酮康唑是一种广泛作用的氧化酶抑制剂,可以抑制发炎皮肤释放内源性TRPV1激动剂,抑制CFA诱导的热痛觉过敏,抑制外源性亚油酸对诱发自发性伤害行为的作用。
本研究发现,外源性亚油酸会在注射到发炎部位时触发自发的行为,但不能控制后爪组织。这种影响与亚油酸呈剂量相关。并且用抗9-HODE和抗13-HODE抗体的预处理可以显著降低亚油酸的影响,使这些递质对自发的不良行为产生影响。而这种免疫化实验并没有完全阻止亚油酸的综合效应。这种不完全的敲除可能是由于非HODE OLAMs的形成,例如,9-OXOODE或13-对非OLAM机制,或抗体量不足。事实上,基因芯片研究已经指出在注射CFA后,CYP上调[17],包括CYP3A1,一种表达在TRPV1+神经元的酶。本研究发现,酮康唑具有抗痛觉过敏作用。酮康唑的这种作用是外周介导的,因为注射到对侧后肢没有效果。这种效应归因于OLAM的抑制作用。酮康唑阻断亚油酸诱导培养神经元中[Ca2+]i升高,并显著降低亚油酸诱导的大鼠行为[18]。
酮康唑抑制内源性TRPV1激动剂从炎症组织中释放。然而,由于酮康唑抑制多种氧化酶,包括CYP,其生化作用机制需要进一步研究。因此,酮康唑在损伤部位药理作用,表明它可能作为新型外周活性镇痛剂的原型。OLAMs在外周炎性热痛觉过敏中发挥作用,并且提示氧化酶,如CYP同工酶在OLAM合成中起重要作用。抗OLAM抗体减少CFA诱导的热痛觉过敏和亚油酸诱发的伤害性镇痛行为的发现有力地支持OLAM在组织炎症过程中旁分泌功能,因为抗体不太可能通过血管膜。鉴定表达这些酶的细胞类型和驱动OLAM合成的特异性异构体可为新型镇痛药物的开发提供潜在的靶点。
综上所述,氧化亚油酸代谢物对周围的炎症性产生痛觉,而CYP酶在调节OLAM对炎症性热痛觉过敏的作用方面起着至关重要的作用。

