稻草-狐尾藻生态治理模式下狐尾藻的生长适应性研究
唐红琴, 董文斌, 李忠义, 肖润林, 韦彩会,蒙炎成, 朱小娇, 何铁光*
(1.广西农业科学院 农业资源与环境研究所,广西 南宁 530007; 2.中国科学院 亚热带农业生态研究所,湖南 长沙 410125;3.大长江环境工程技术有限责任公司,湖北 武汉 430223)
随着我国畜禽养殖业的集中化、规模化发展,产生了大量的畜禽粪便以及尿液等养殖废弃物,化学需氧量、氨氮、磷等主要污染物排放量日益增多,畜禽养殖污染问题日益严峻,虽然利用固液分离、化学降解和微生物处理等传统的生物工程技术能够有效的处理这些养殖废水,但其投资成本高,氮磷去除效果不佳,且其副产物又存在二次污染的风险[1].水生植物常被用于养殖废水的生态处理,主要利用其生长繁殖快、净化效果好、及其可回收利用等优点[2-3].狐尾藻(Myriophyllumspicatum)属小二仙草科的多年生沉水植物.C4光合作物,其适应性强.它能较快高效地除去水体中的氮、磷等富营养化元素,具有适应强、生物量积累较快和耐污能力较强等特点,目前已作为一种低廉高效的处理手段,替代传统生物工程技术,逐渐被广泛应用于养殖废水处理中[4].近年来,中国科学院亚热带农业生态研究所针对养殖废水治理问题,建立了一套稻草-狐尾藻生态治理技术[5-7],其主要利用稻草-狐尾藻在养殖废水中能够降解COD、吸纳氮磷的原理,具有净化效果好、工程投资少、运行成本低的特点,并且可产生一定经济效益,该项技术已逐渐在各地推广应用[8].然而,狐尾藻对养殖废水的处理作用是建立在其能够正常生长的基础之上,因此研究狐尾藻在稻草-狐尾藻生态治理模式下的生长适应性就显得很有必要.唐红琴等[9]在本试验的前期试验结果,表明了无稻草条件下,狐尾藻处理各级养殖废水中的COD、SS、NH3-N、TN和TP的效果最好、效率最高,而覆盖稻草中,除COD和SS浓度升高外,其余指标均降至最低浓度.相比较而言,无稻草覆盖的狐尾藻处理废水效率更高,效果更好.狐尾藻在不同浓度的养殖废水中均能正常生长,其耐污能力强,适应性好,可治理禽畜养殖废水[10],李远航等[8]从生态效益而言,利用稻草—狐尾藻生态治理技术对COD、TN、NH4+-N和TP的年减排量分别可达到53.0 t/万头、29.1 t/万头、25.4 t/万头和1.1 t/万头.工程在正常运行条件下,还通过水产养殖、青饲料利用等途径每年可产生直接经济效益1.2万元/万头.罗开武等[11]利用稻草—狐尾藻治理养殖废水方案进行猪场废水治理,通过4级狐尾藻湿地净化后,NH3-N浓度为2 mg/L,降低了98%;TP浓度为4.7 mg/L,降低了92%;COD浓度为11 mg/L,降低了93%.本研究针对畜禽养殖业养殖废水急需治理的现实需求,开展稻草-狐尾藻生态治理养殖废水的模拟试验,取养猪场5级排污池的废水,研究对狐尾藻生长适应性的影响,为狐尾藻在治理养殖废水的应用推广提供理论依据.
1 材料与方法
1.1 试验材料
狐尾藻用清水洗净其附着物,剪取健壮狐尾藻顶枝(长约20 cm),移栽至清水中培养备用.分别采集养猪场内5级滤池入口废水作为试验原水,各级养殖废水污染物指标见表1.
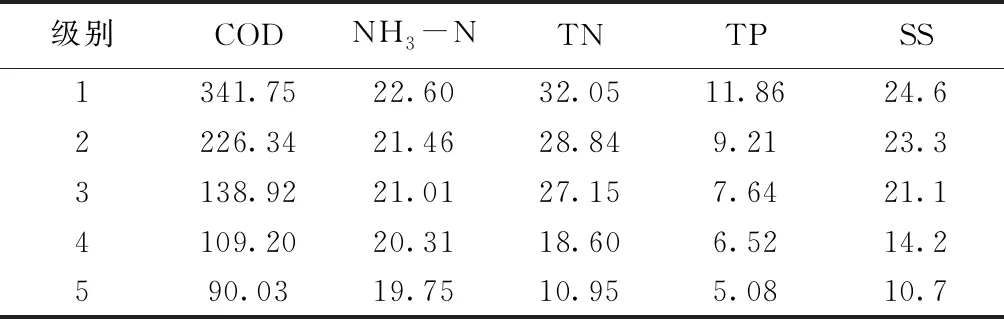
表1 各级养殖废水污染物指标(mg/L)
1.2 试验设计
试验于2016年9月14日在广西农业科学院内进行,将养殖废水倒入PVC桶(宽60 cm×高50 cm),在桶高40 cm处划定标准水位线.稻草覆盖量为500 g/桶,将对应的1级~5级池水设为处理1~处理5,养猪场排放的第1级水设为处理1,将5级不同浓度的猪场废水分别倒入桶中,至水面与标准水位线平齐.每级废水各倒入3桶,做3次重复试验.以同样水量的清水作为对照(CK).将预培养的狐尾藻顶芽(约20 cm)插入各级养殖废水中,每桶20株.分别于试验9月19日(5 d)、10月10日(27 d)、10月24日(41 d)、11月6日(54 d)、11月15日(63 d)和12月6日(84 d),测量狐尾藻的株高、生物量等生长性状指标,并采样测定狐尾藻叶绿素含量、丙二醛含量和超氧化物歧化酶等生理指标.试验过程中及时加清水至标准水位线,补充因蒸发而消耗的水分,使水量保持不变.对照桶放入清水.试验时间为2016年9月~12月.
1.3 测定项目与方法
狐尾藻叶绿素含量测定采用乙醇丙酮混合法[12],狐尾藻丙二醛(MDA)含量测定采用硫代巴比妥酸法[13],超氧化物歧化酶(SOD)活性测定采用邻苯三酚自氧化法[13],过氧化氢酶(CAT)活性测定用高锰酸钾滴定法[14].
1.4 数据处理
利用Microsoft Excel 2013进行数据处理和图表制作.
2 结果与分析
2.1 对狐尾藻生长性状的影响
2.1.1 对狐尾藻株高的影响
由图1可见狐尾藻株高在不同浓度养殖废水的动态变化情况.在第27 d之前,各处理养殖废水中的狐尾藻株高增长幅度较缓慢,而在27 d~40 d的时间里,各处理的单株株高呈现快速增长态势,第40 d后,株高增长幅度相对变缓.至试验结束时,各处理狐尾藻平均单株株高基本相当,在56.5 cm~66.0 cm之间,CK狐尾藻的株高均显著低于各处理,增长幅度也较缓慢,第84 d时,其平均单株株高为32.6 cm.试验结束时,各处理狐尾藻的株高排序为:处理1>处理3>处理2>处理4>处理5>CK.由本试验可知,在不同浓度废水中,狐尾藻的生长株高无明显规律性,但在稻草-狐尾藻模式下,与CK相比,稻草覆盖更能够有效促进狐尾藻生长.

图1 不同处理狐尾藻株高变化分析Fig.1 The change analysis of plant height of Myriophyllum spicatum under different treatments
2.1.2 对狐尾藻生物量的影响
由图2可以看出狐尾藻在各级养殖废水浓度下的变化情况.在第54 d之前,各级废水中的狐尾藻生物量呈现近线性增长,在54 d左右,其中处理2的生物量最高,达到1.699 kg/桶,各处理在第54 d的生物量情况为:处理2>处理3>处理1>处理5>处理4>CK,在54 d后,生物量开始趋于稳定,至试验结束时,各处理的生物量在1.334 kg/桶~1.795 kg/桶之间,CK最终生物量为0.681 kg/桶.由本试验可知,在不同浓度废水中,废水浓度越高,其生长相对较好,生物量较大.在前期,由于稻草的降解,对狐尾藻产生抑制,生长缓慢,约30 d后,稻草-狐尾藻系统的净化作用,废水浓度逐渐降低,狐尾藻逐渐适应废水环境,呈现快速增长趋势,总体而言,稻草-狐尾藻模式下,有利于促进狐尾藻的生长,增加生物量.
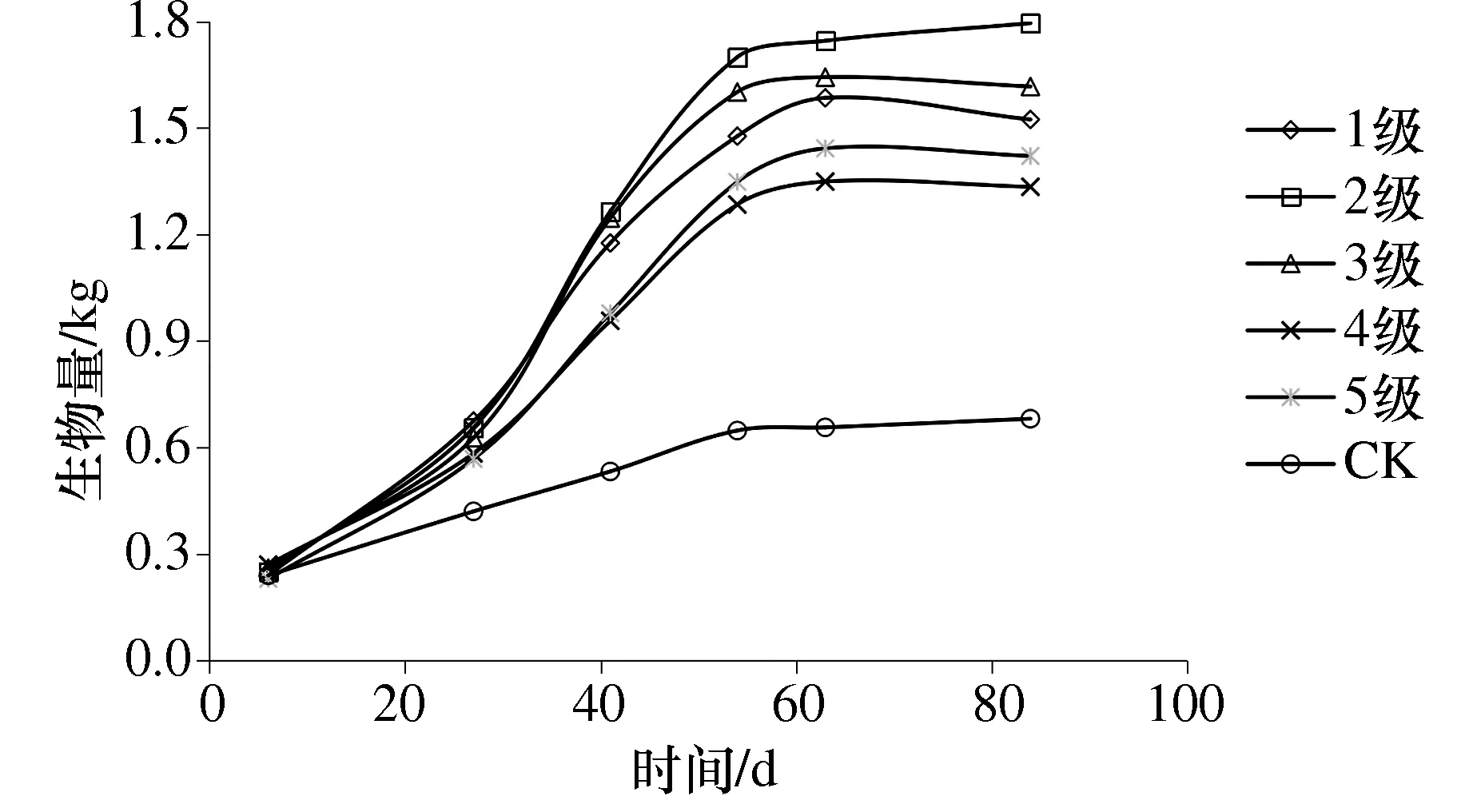
图2 不同处理狐尾藻生物量变化分析Fig.2 The change analysis of biomass of Myriophyllum spicatum under different treatments
2.2 对狐尾藻生理指标的影响
2.2.1 对叶绿素含量的影响
由图3可看出各级废水中对狐尾藻叶绿素含量的影响.各处理的狐尾藻叶绿素含量呈现先升高、后下降的趋势,在54 d之前,各处理叶绿素含量逐渐增加,增加幅度相近,在第54 d时,各处理叶绿素含量均达到最高值,其中处理3的叶绿素含量最高,达到2.456 mg/g FW,其中处理2在63 d左右才达到最大值,为2.110 mg/g FW,CK叶绿素含量均比各处理低,最大值为1.700 mg/g FW,在54 d时,叶绿素含量高低顺序为:处理3>处理5>处理1>处理4>处理2>CK.由此可见,在不同浓度废水中,狐尾藻的叶绿素含量变化无明显规律性,但在覆盖稻草的废水中,均能够较CK提高狐尾藻的叶绿素含量.

图3 不同处理狐尾藻叶绿素含量变化分析Fig.3 The change analysis ofchlorophyll content of Myriophyllum spicatum under different treatments
2.2.2 对MDA含量的影响
如图4所示,不同处理狐尾藻的MDA含量均呈现先上升后下降的趋势,在41 d之前,各处理MDA含量逐渐增加并达到峰值,此后降低,于63 d后趋于稳定,CK的MDA含量也均比各处理低.在41 d的时候,处理1的MDA含量最高,达到7.030 nmol/g FW,各处理MDA含量排序为:处理1>处理2>处理4>处理5>处理3>CK.在狐尾藻扦插入水中后,由于生长初期要适应养殖废水环境,MDA浓度不断增加,对狐尾藻产生胁迫效应,约生长一个半月后,狐尾藻逐渐适应废水环境,MDA浓度逐渐下降,并于63 d左右趋于稳定,其受到的胁迫效应基本解除,而在废水条件下,狐尾藻的MDA含量相较CK高,在废水环境中,废水对狐尾藻产生一定的胁迫影响.

图4 不同处理狐尾藻丙二醛(MDA)含量变化分析Fig.4 The change analysis of MDA content of Myriophyllum spicatum under different treatments
2.2.3 对SOD和CAT含量的影响
各处理狐尾藻的SOD值在试验期间的动态变化如图5所示,在试验63 d之前,虽然各处理SOD的变化有所波动,但总体增加,63 d后开始缓慢下降并趋于稳定,CK的SOD则相对比各处理低;各处理狐尾藻的CAT值在试验期间的动态变化如图6所示,其变化规律与SOD相近,更具规律性,整体为先升高,后降低.与CK相比,狐尾藻在扦插入废水中后,由于要适应废水环境,对胁迫效应产生防御机制,提高自身酶活性,有助于其维持酶促防御系统的稳定,减轻逆境的胁迫,同时,也说明狐尾藻在废水中受到胁迫效应时,能够提高酶活性,以适应胁迫环境.

图5 不同处理狐尾藻超氧化物歧化酶(SOD) 活性变化分析Fig.5 The change analysis of SOD activity of Myriophyllum spicatum under different treatments

图6 不同处理狐尾藻过氧化氢酶(CAT)活性变化分析Fig.6 The change analysis of CAT activity of Myriophyllum spicatum under different treatments
3 讨论
水体营养浓度过高,会对植物造成逆境胁迫,进而抑制其生长[15].狐尾藻扦插入各级废水中,初期由于废水浓度较高,其生长受到一定程度抑制,因此生长缓慢,随着狐尾藻逐渐生长,在此过程中,狐尾藻不停的吸收废水中的N、P养分,以及对稻草-狐尾藻系统中水体的净化作用,各级废水中的N、P浓度逐渐降低,达到狐尾藻适合生长的营养条件,则开始快速生长;在试验后期,狐尾藻生长缓慢且趋于稳定,株高趋于稳定,主要由于狐尾藻已开始以侧枝生长为主;而生物量趋于稳定,是由于部分狐尾藻在生长后期,根部腐烂甚至死亡,导致总生物量降低.无论狐尾藻的株高还是生物量的变化情况,稻草在稻草-狐尾藻生态治理系统中,起着降解COD、吸纳氮磷的作用,稻草覆盖能更快的净化水体,为狐尾藻的生长较快达到合适的营养环境.
在逆境胁迫中,细胞内固有自由基代谢平衡遭受破坏时,会产生大量氧自由基,而过量的氧自由基会引发或加剧膜脂过氧化作用,造成细胞膜系统损伤,干扰植物细胞的光合、呼吸及其他代谢过程,严重时会导致细胞死亡[16-18].MDA是常用膜脂过氧化指标,是植物器官衰老或在逆境条件下发生膜脂过氧化的产物之一,其数值的高低,表示细胞膜脂过氧化程度的大小和逆境条件下耐受的强弱,MDA升高通常是植物膜发生严重氧化损伤的标志,间接的表示膜受损情况,同时也会告诉机体需要进行更激烈的胁迫应答反应,保护机体[19-22].由于稻草在前期开始降解,各级废水的浓度相对较高,狐尾藻的生长受到营养盐胁迫,导致MDA前期较高,而随着稻草的降解和废水的不断净化,狐尾藻逐渐适应环境,胁迫减弱,MDA含量逐渐降低;而各级浓度废水中,浓度越高,其受到胁迫越严重,相对应的MDA值也越高.SOD和CAT是酶促防御系统的重要保护酶,当植物面临逆境胁迫时,体内酶促防御系统启动,SOD和CAT活性上升,有效消除不断产生的自由基,维持植株组织和细胞体内的代谢平衡[23].SOD和CAT的活性变化与MDA含量变化趋势相近,都呈现出先增加,后降低并趋于稳定的态势,其变化机理于MDA相似,即前期的狐尾藻受到营养盐胁迫时,SOD和CAT的活性降低,而随着胁迫逐渐减弱,SOD和CAT活性逐渐提高,并于后期趋于稳定.
4 结论
研究表明,稻草-狐尾藻生态治理污水体系中,前期稻草降解,导致水体污染物浓度的增加,对狐尾藻产生营养盐胁迫效应,抑制狐尾藻生长,但随着稻草的降解,以及稻草-狐尾藻对废水的净化,胁迫逐渐减弱,狐尾藻逐渐适应水体环境,因此,在稻草-狐尾藻生态治理模式下,能够更有利于狐尾藻的生长,也能够更快净化养殖废水,值得在畜禽养殖废水的治理和修复方面大力推广和应用.

