免疫亲和柱净化液相色谱柱后光化学衍生法测定调味品中黄曲霉毒素G2、G1、B2、B1
徐小存 胡银燕
摘 要:目的:建立免疫亲和柱净化液相色谱柱后光化学衍生法测定调味品中黄曲霉毒素B1、B2、G1、G2。方法:样品经甲醇-水(7+3)提取过滤,稀释后,滤液经免疫亲和柱净化,采用HPLC柱后光化学衍生-荧光检测器测定其含量。结果:黄曲霉毒素B1、G1、B2、G2检出限分别为0.12、0.28、0.04、0.12 μg·kg-1,
其相关系数均大于0.999 5,回收率為66%~97%,RSD小于10%。结论:该方法具有操作简单、快速、准确度高、灵敏度高等优点,适用于调味品中黄曲霉毒素的测定。
关键词:黄曲霉毒素;柱后光化学衍生;调味品;高效液相色谱;免疫亲和柱
Abstract:Objective: To establish a method for the determination of aflatoxin B1, B2, G1, G2 in condiment by immune-affinity column cleaning up and HPLC with post-column photochemical derivation. Methods: Samples were extracted with methanol-water (7+3) solution, the extractions were purified by immune-affinity column after filteration and dilution, separation of aflatoxin were measured by post-column photochemical instrument. Results: the limits of detection of aflatoxin B1、G1、B2 and G2 were 0.12, 0.28, 0.04, 0.12 μg·kg-1 respectively, the correlation coefficient of all aflatoxins was greater than 0.999 5, and the recovery rates were from 66% to 97%, RSD was below 10%. Conclusion: The method is easy, quick, precise and high-sensitive, which is suitable for the determination of aflatoxins in condiments.
Key words:Aflatoxins; Post-column photochemical derivation; Condiment; HPLC; Immune-affinity column
中图分类号:O657.7
黄曲霉毒素是一种天然毒素,它的产生与环境密切相关。调味品在日常生活中必不可少,在其加工、运输、存储过程中易发生霉变。为保证饮食安全,需建立黄曲霉毒素检测方法。目前黄曲霉毒素检测方法有薄层色谱法[1]、酶联免疫法[2]、液相色谱法[3]等。本文采用免疫亲和柱净化-光化学柱后衍生-液相色谱荧光法检测调味品中4种黄曲霉毒素。
1 材料与方法
1.1 材料与仪器
材料。72种调味品(花椒、辣椒)来自于江西省九江市、区、县各超市及集贸市场,包括散装及定型包装;黄曲霉毒素六合一免疫亲和柱(IAC-SEP);甲醇,购自国药集团化学试剂有限公司;玻璃纤维滤纸(直径11 cm);黄曲霉毒素总量标准品(美国SUPELCO,批号:LB96951);B1、B2、G1、G2分别为1.039、0.314、1.056、0.288μg·mL-1;实验用水经Water Purifer超纯水机制备,0.45 μm滤膜过滤后使用。
仪器。岛津LC-20AT高效液相色谱仪配荧光检测器,Coloversil HPLC Column 4.6 mm×250 mm,5 μm),购自美国CLOVER;光化学衍生器(型号:PHRED美国AURA);泵流操作架,购自北京中检维康技术有限公司;真空泵(型号:AP-01P VACUUM PUMP,天津奥特赛恩斯仪器有限公司);涡旋混匀器(型号:VORTEX-GENIE2,上海易扩仪器有限公司)。
1.2 实验方法
1.2.1 色谱条件
流动相:甲醇-水(45+55)在线混合;流速:1.0 mL·min-1;进样量:50 μL;柱温:35 ℃;检测波长:激发波长360 nm;发射波长440 nm。
1.2.2 样品前处理
(1)样品提取及稀释。准确称取调味品粉末2.5 g
于50 mL离心管中,加入1 g氯化钠,25 mL甲醇-水(7+3),混合均匀。定性滤纸过滤,准确移取10 mL滤液并加入20 mL纯水稀释,用玻璃纤维滤纸过滤,至滤液澄清,备用。
(2)样品净化。将免疫亲和柱连接于10 mL玻璃注射器下。准确移取20 mL样品提取液注入玻璃注射器中,将空气压力泵与玻璃注射器连接,调节压力使溶液以2 mL·min-1流速缓慢通过免疫亲和柱,直至2~3 mL空气流过柱体。以10 mL水淋洗柱子3次,弃去全部淋出液,并使2~3 mL空气通过柱体。准确加入1.0 mL甲醇洗脱,收集全部洗脱液于玻璃试管中,加入1.0 mL纯水,混匀,待测定。
1.2.3 标准曲线
标准储备液:用甲醇-水(1+1)将标准品稀释10倍,至黄曲霉毒素B1、B2、G1、G2浓度分别为103.9、31.4、105.6、28.8 ng·mL-1。将储备液逐级稀释到适宜的标准工作溶液,对标准工作液和样液在上述色谱条件下测定,进样量50μL,以保留时间定性,峰面积定量。
2 结果与分析
2.1 光化学柱后衍生效果
黄曲霉毒素B1、G1具有很强的荧光性,但接触水后易发生荧光淬灭现象,荧光性消失液相色谱难以检测,要用衍生的方法增强其熒光性。用光化学的方法对B1、G1进行衍生,B2、G2则不受衍生的影响,操作简单、实验重复性好,灵敏度高,适用于大批量样品的检测。
2.2 标准曲线及标准品图谱
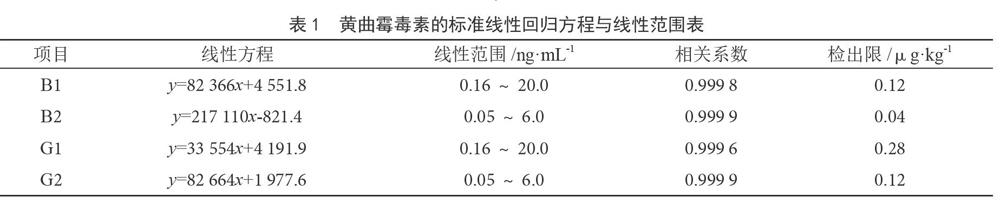
标准曲线见表1,标准溶液色谱图见图1。
2.3 方法检出限及定量限
将0.16 ng·mL-1的黄曲霉毒素B1标准品进样25 μL进行多次测定,其峰高均约为基线噪声高度的3倍,因此仪器检出限为0.08 ng·mL-1,方法检出限为0.12 μg·kg-1,黄曲霉毒素B2、G1、G2的仪器检出限依次为0.03、0.19、0.08 ng·ml-1,方法检出限依次为:0.04、0.28、0.12μg·kg-1。B1、B2、G1、G2方法定量限依次为0.4、0.13、0.9、0.4 μg·kg-1。
2.4 回收率和精密度实验
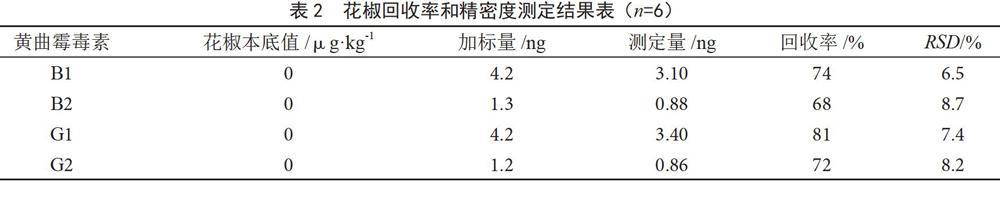
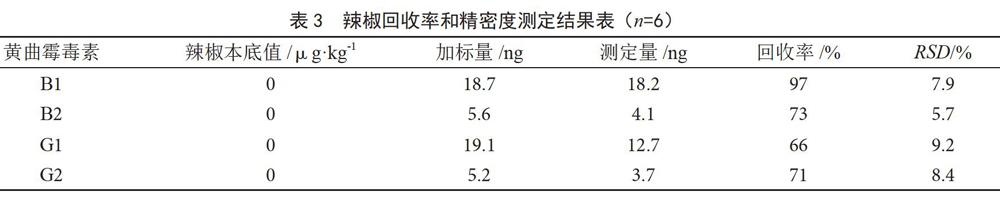
用不含黄曲霉毒素的花椒和辣椒样品作为空白样品进行加标回收实验,在样品中分别添加不同浓度的标准品后,按照样品前处理步骤进行前处理,按照1.2.1色谱条件测定其回收率。每个加标样品连续测定6次,结果见表2、表3。对被测组分含量小于0.1 mg·kg-1的样品,回收率范围应在66%~97%,花椒、辣椒回收率均符合要求,该方法精密度高,RSD<10%。
2.5 实际样品的测定
采用本法对72种调味品进行检测,样品图谱基本无干扰杂质峰,测定结果70种调味品均未检出黄曲霉毒素,其中有2种检出黄曲霉毒素B1,含量分别为2.7μg·kg-1、0.6 μg·kg-1,食品安全国家标准暂未对调味品花椒、辣椒中真菌毒素限量进行规定[4]。
3 结论
本方法采用免疫亲和柱净化-柱后光化学衍生-液相色谱荧光法测定了调味品中黄曲霉毒素,净化效果好,方法简单,适用于大批量样品中黄曲霉毒素的检测,同时该方法也满足我国对黄曲霉毒素限量的检测要求。
参考文献:
[1]张 鹏,赵卫东,张艺兵.高效薄层色谱法测定黄曲霉毒素B1、B2、G1、G2[J].分析化学,2000(3):392.
[2]王彩云,王政纲,云战友.酶联免疫法测定食品和饲料中的黄曲霉毒素[J].食品工程,2007(4):58-60.
[3]Ibá?ez-Vea M,Corcuera L A,Remiro R,et al.
Validation of a UHPLC-FLD method for the simultaneous quantification of aflatoxins, ochratoxin A and zearalenone in barley[J].Food Chemistry,2011,(1271):351-358.
[4]国家卫生和计划生育委员会 国家食品药品监督管理总局.GB 2761-2017食品安全国家标准 食品中真菌毒素限量[S].北京:中国标准出版社,2017.

