围孕期空气污染暴露与子代先天性甲状腺功能减退的关系:基于中国30 个省份的研究
黄丽燕,尚 丽,漆翠芳,杨文方,杨力仁,谢桂兰,王瑞奇,辛 娟,王珊珊,Mei Chun Chung
(1.西安交通大学第一附属医院妇产科,陕西 西安 710061;2.西安交通大学医学部公共卫生学院,陕西 西安 710061;3.北京大学医学部,北京100191;4.空军军医大学第一附属医院,陕西 西安 710032;5.美国塔夫茨大学医学院公共卫生与社区医学院,美国 波士顿 02111)
先天性甲状腺功能减退症(congenital hypothyroidism, CH)是由于先天性甲状腺激素产生不足或其受体缺陷导致的内分泌疾病[1]。据统计,2013-2015年我国新生儿中CH的年平均发病率约为4.13/万,在全球范围内处于较高水平[2]。研究表明,CH可能会对子代的智力和体格发育产生不利影响,严重时可能会导致智力发育迟缓[3]。 因此,早期识别及干预CH的高危因素由为重要。此前研究发现,母体甲状腺功能、碘含量和不良妊娠结局(早产、妊娠期糖尿病等)都可能影响子代甲状腺功能的发育[4]。但几乎没有研究报道过环境污染对CH发病风险的影响。且由于CH的人群发病率较低,往往难以获得足够数量的CH患儿作为样本,故基于大数据的生态学分析具有重要价值。因此,本研究基于中国30个省份的统计数据探索了母体围孕期空气污染暴露水平对CH发病率的影响,为临床中围孕期保健提供科学依据,并为进一步的个体研究提供研究方向。
1 方法
1.1 研究方法
本研究采用基于大数据的生态学研究设计,回顾性收集2014年10月1日至2015年9月31日中国30个省份(除西藏、香港、澳门及台湾外)的CH 年平均发病率。遵循空气污染对妊娠期效应的滞后性和累积性原则,对应收集2014年1月1日至2015年9月31日各省空气污染(PM2.5、PM10、NO2、SO2、CO和O3)的平均浓度作为围孕期空气污染的暴露水平,进而分析围孕期空气污染暴露对新生儿CH发病风险的影响。
1.2 统计指标
本研究所收集的研究指标主要包括CH发病率、空气污染水平和协变量因素。
1.2.1 CH的发病率
本研究回顾性收集了2014年10月1日至2015年9月31日我国30个省份的CH发病率。该资料基于以医院为基础的全国新生儿疾病筛查信息系统调查所得,先由各医院依照《新生儿疾病筛查技术规范(2010版)》收集样本并进行监测,确诊每个月的CH患儿后向当地筛查中心上报,再由各筛查中心汇总当地CH的发病情况,并逐级上报,最终由全国妇幼卫生监测办公室汇总并形成年度报告。
1.2.2 空气污染水平
遵循空气污染对妊娠期效应的滞后性和累积性原则,本研究回顾性收集2014年1月1日至2015年9月31日我国30个省份的PM2.5、PM10、NO2、SO2、CO和O3的平均浓度以反映围孕期的平均暴露水平。该数据包括O3的每日最大8h平均浓度和PM2.5、PM10、NO2、SO2及CO的24h平均浓度,最终通过加权合并法计算30个省份从2014年1月1日至2015年9月31日的平均空气污染暴露水平。
1.2.3 协变量因素
为降低由经济以及其他污染所引起的偏倚,本研究从《中国统计年鉴》中收集了2014和2015年各省份的人均国民生产总值以及废水中铅、汞和砷的暴露量,将其作为混杂因素纳入效应模型。
1.3 统计学方法
所有统计分析均采用SPSS 18.0软件进行,计量资料的描述采用均数±标准差()进行,采用Spearman秩相关进行非参数变量的相关性分析。根据CH发病率的中位数,将30个省份分为高发病区和低发病区,以此作为结局变量,以各项空气污染物的平均暴露水平作为自变量,同时纳入各省人均国民生产总值以及废水中铅、汞和砷的暴露量作为混杂因素,构建二项Logistics回归分析模型,计算围孕期单个污染物暴露对CH发病风险的效应。在此基础上,对于单一暴露有显著影响的污染物,同时纳入其他污染物暴露水平,建立双污染物模型,校验该污染物暴露对CH发病风险影响的稳定性,取P<0.05为差异有统计学意义。
2 结果
2.1 我国空气污染和CH 发病率的一般分布特征
2015 年我国通过新生儿筛查项目共确诊CH 患儿6 500例,发病率为4.31/万(1/2 322)。其中浙江省 (7.42 /万)和福建省(7.34 /万)的CH发病率最高,而西部地区CH发病率普遍偏低,新疆(1.88/万)的发病率最低。对于空气污染而言,NO2和O3在我国东部地区的暴露水平更高,而PM2.5、PM10、SO2和CO在中部地区的污染水平最严重,见表1。
2.2 CH 发病率和空气污染暴露水平的相关性分析
经分析,CH 发病率与PM2.5、NO2和O3的平均暴露水平之间存在显著的正相关性(相关系数分别为0.386,0.422,0.403,均P <0.05)。此外,PM2.5、PM10、S O2和C O 的暴露水平之间也存在显著的相关性 (P<0.05),见图1。
2.3 围孕期单个空气污染物的暴露水平对CH 发病风险的影响
经分析,若某地区 PM2.5的暴露水平上升1μg/m3,则该地区CH 发病率升高的风险将会增加0.102 倍(OR = 1.102, 95%CI: 1.001~1.213, P <0.05)。此外,围孕期NO2平均暴露水平的升高也会增加CH 的发病风险(OR = 1.211, 95%CI: 1.033~1.419, P <0.05)。但PM10、SO2、CO 和O3的暴露水平对CH 发病风险没有显著的影响(OR = 1.007、0.987、0.925、0.061,均 P>0.05),见图2。
表1 我国CH发病率和空气污染水平的分布()Table 1 Distribution of air pollution and the incidence of CH in China()
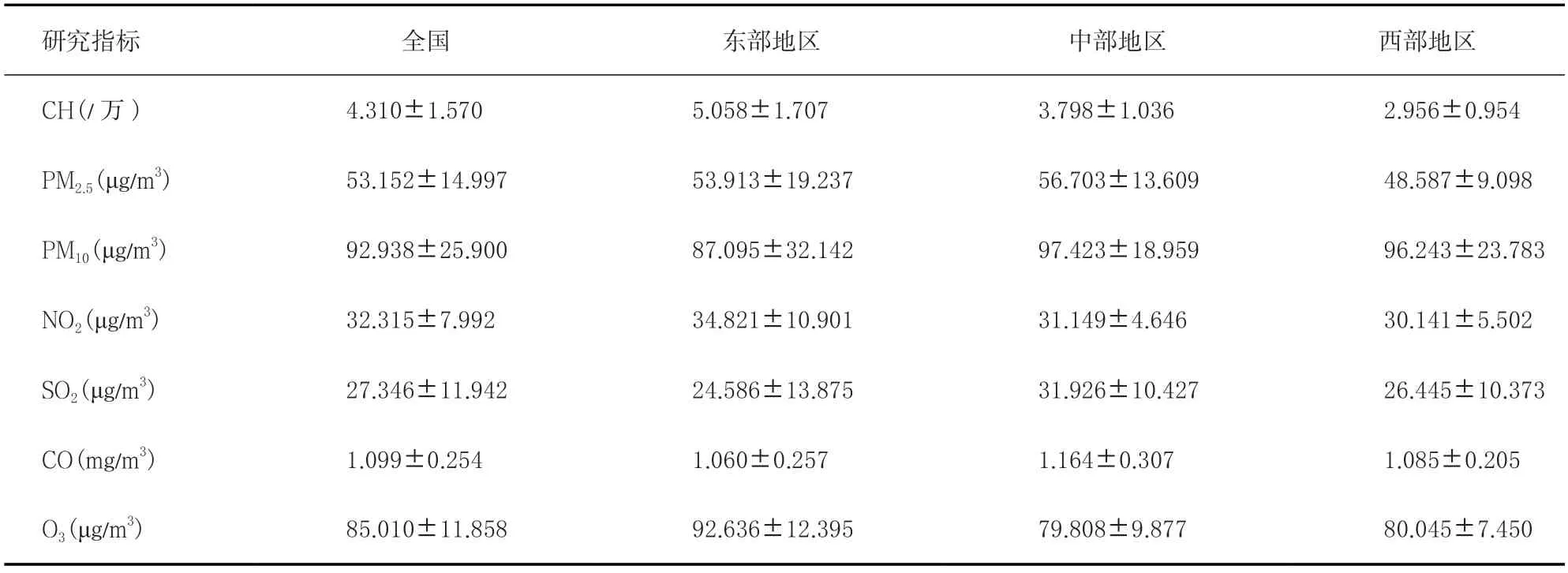
表1 我国CH发病率和空气污染水平的分布()Table 1 Distribution of air pollution and the incidence of CH in China()
研究指标 全国 东部地区 中部地区 西部地区CH(/万) 4.310±1.570 5.058±1.707 3.798±1.036 2.956±0.954 PM2.5(μg/m3) 53.152±14.997 53.913±19.237 56.703±13.609 48.587±9.098 PM10(μg/m3) 92.938±25.900 87.095±32.142 97.423±18.959 96.243±23.783 NO2(μg/m3) 32.315±7.992 34.821±10.901 31.149±4.646 30.141±5.502 SO2(μg/m3) 27.346±11.942 24.586±13.875 31.926±10.427 26.445±10.373 CO(mg/m3) 1.099±0.254 1.060±0.257 1.164±0.307 1.085±0.205 O3(μg/m3) 85.010±11.858 92.636±12.395 79.808±9.877 80.045±7.450

图1 CH 发病率和空气污染暴露水平的相关性分析Fig.1 Spearman correlation analysis among the incidence of CH and the exposure levels of air pollutants

图2 单个空气污染物模型中,围孕期空气污染暴露水平对CH发病风险的影响Fig.2 Effects of periceonceptional exposure to air pollution on the risk of CH in single-pollutant model
2.4 双污染物模型中空气污染暴露水平对CH 发病风险的影响
在双污染物模型中,分别调整了PM10、SO2、CO和O3后,围孕期PM2.5高暴露仍会显著增加CH的发病风险(OR = 1.585, 1.150, 1.345, 1.281, 均P <0.05),NO2的高暴露也会显著增加CH的发病风险(OR = 1.580, 1.264, 1.345, 1.209,均P<0.05),见图3。
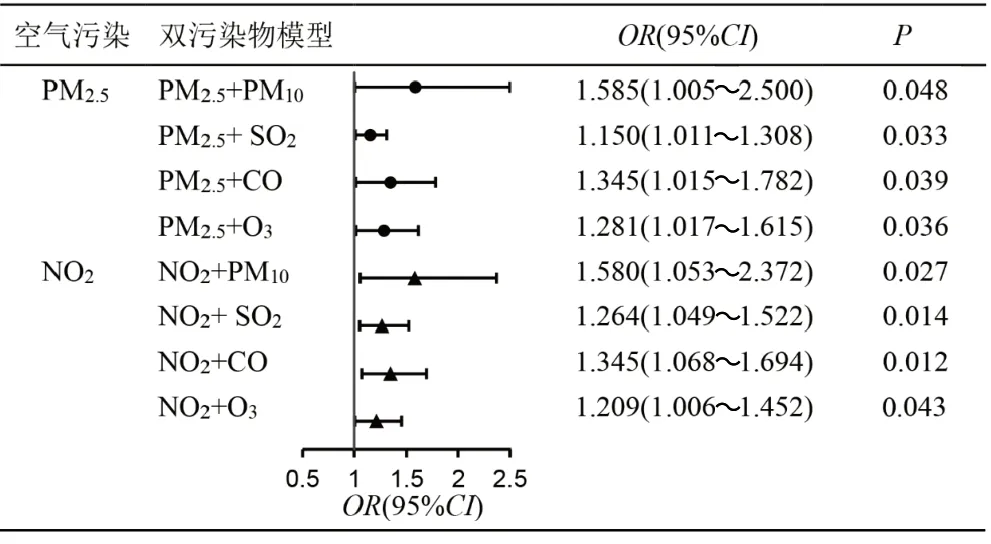
图3 双污染物模型中,围孕期PM2.5 和NO2 的暴露水平对CH发病风险的影响Fig.3 Effects of periceonceptional exposure to PM2.5 and NO2 on the risk of CH in two-pollutant models
3 讨论
3.1 子代甲状腺功能的发育
甲状腺激素是反应甲状腺功能的重要指标,其主要形式为甲状腺素(thyroxine, T4)和活性形式的三碘甲状腺原氨酸(triiodothyronine, T3),受促甲状腺激素(thyroid stimulating hormone, TSH)的调控并由甲状腺释放。在妊娠期的前3个月,胎儿的甲状腺功能还未发育完全,故该阶段胎儿体内的甲状腺激素主要来源于母体[5]。自妊娠中期开始,胎儿的甲状腺开始起作用,除了母体的供应,胎儿还能够产生自己的甲状腺激素供应。若胎儿期甲状腺激素合成不足或受体缺陷,则会导致先天性甲状腺功能低下,引发CH。CH 的发生与遗传、地域、不良妊娠结局和环境等因素密切相关[6]。研究发现,早产儿、过期产儿和低出生体重儿中CH的发病率更高[7]。而针对环境因素,目前的研究主要关注碘元素的暴露,并发现母体妊娠期碘缺乏和碘过量均对子代甲状腺功能的发育具有不良 影响[8]。但针对空气污染暴露对子代甲状腺功能发育的研究较少。
3.2 围孕期空气污染暴露对子代甲状腺功能的影响
本研究首次分析了围孕期空气污染暴露对CH发病风险的影响,并指出围孕期母体PM2.5和NO2高暴露会显著增加CH的发病风险。虽然尚未检索到空气污染与CH发病风险的其他报道,但也有少数研究分析了母体空气污染暴露对甲状腺相关激素水平的影响。国外的一项出生队列研究发现,围孕期暴露于PM2.5与脐带血中TSH和血清游离T4/血清游离T3水平存在显著的负相关,与本研究结果较为类似[9]。此外,Howe等[10]也发现孕早期及孕中期母体颗粒物的暴露与新生儿总甲状腺素的浓度升高相关,这可能是由于空气中的颗粒物会抑制T4和甲状腺素转运蛋白的结合所引起的甲状腺素代谢异常。且相关研究也发现孕早期及孕中期PM2.5的暴露会增加孕产妇发生低甲状腺素血症的 风险[11],而围孕期甲状腺素血症又会影响子代甲状腺功能的发育,这也从一定程度上支持了本研究的结论。
3.3 围孕期空气污染暴露影响子代甲状腺功能的机制分析
本研究结果在生物学途径上是可解释的。研究发现,PM2.5和NO2经呼吸道进入人体后,会穿过血管壁,进入血液,进而引起机体发生氧化应激和炎症反 应等[12],可能会进一步导致胎盘灌注减少。此外,PM2.5能结合胎盘生长因子的受体[13],可能干扰母体与胎儿之间营养物质与氧气的交换,从而影响胎儿器官的发育和功能的形成。因此,我们推测PM2.5暴露导致的胎盘灌注减少和胎盘功能改变可能通过干扰胎儿的营养、母体血液氧合等过程,从而导致胎儿子宫内器官和组织生长发育受限。此外,众多研究表明早产儿、低出生体重儿往往会有更高的CH发病风险,而围孕期空气污染高暴露又被认为是早产、低出生体重的危险因素,故不良出生结局也可能是围孕期空气污染暴露对CH的中介效应之一。
综上,本研究通过大数据分析初步发现围孕期暴露于PM2.5和NO2会显著增加子代发生CH的风险,但在PM10、CO和SO2中没有发现显著的影响。本研究初步探讨了空气污染对子代CH发病风险的影响,为临床中围孕期保健补充了科学依据,也为此后相关研究提供了新方向,但该结论仍需要通过基于个体的流行病学研究和实验室研究加以证实,同时进一步分析空气污染对子代甲状腺功能的可能作用机制。

