重组人生长激素治疗特发性矮身材儿童对骨代谢指标的影响
夏 雅,潘秋飞,吴安乐,张 宇
(温州市妇女儿童医院儿童保健科,浙江 温州 325000)
矮身材是指在相似环境下,儿童身高低于同种族、同性别、同年龄平均身高2 个标准差(standard deviation, SD)以下或低于第3 百分位数以下,每年生长速率低于5cm 的生长迟缓状态,常见于青春发育早期[1]。根据不同发病原因分为特发性矮身材(idiopathic short stature, ISS)、获得性矮身材。其中ISS多表现为儿童生长激素检查正常,身体比例正常,无内分泌、营养性及全身性疾病,无染色体异常状况,但身高低于同龄儿,青春期发育正常或延迟,甲状腺功能、肾上腺功能、肝肾功能、垂体核磁、四肢长骨片等基本正常,骨龄延迟[2]。临床治疗ISS 常给予营养补充、增强体育锻炼,部分患儿会给予重组人生长激素激素(recombinant human growth hormone, rhGH)或胰岛素样生长因子(insulin-like growth factor 1, IGF-1)、促性腺激素释放激素等,但应用较少[3]。 虽然多数ISS儿童生长激素水平检查正常,但仍有研究显示rhGH对ISS儿童具有较好的促进生长作用[4]。因此对于rhGH在ISS治疗中的作用是现代临床研究的热点。本研究通过在常规营养支持的基础上增加rhGH治疗,观察rhGH对ISS儿童骨代谢指标、甲状腺功能指标、生长发育指标、血糖相关指标的影响。
1 资料与方法
1.1 一般资料
选取2017年4月至2018年4月我院收治的ISS儿童40例。纳入标准:①出生时身高、体重正常,处于青春发育前期(女孩≤10岁,男孩≤12岁);②参照我国2005年儿童身高标准,身高低于同年龄、同性别正常均值2个SD以下(或在第3百分位数以下);③身材匀称;④无慢性器质性疾病;⑥无明显严重心理、情感障碍,摄食正常;⑥染色体检查正常;⑦骨龄正常;⑧生长激素激发试验结果显示生长激素峰值≥10ug/L。排除标准:①合并心肝肾功能障碍;②合并脑血管疾病; ③青春发育后期;④对本研究中使用的rhGH注射药物过敏。另选择同期于我院儿童保健科体检合格的青春发育前期健康儿童40例作为对照组,对照组儿童身高和体重均在同年龄、同性别正常均值±2SD以内。观察组儿童年龄4~12岁,平均(8.37±1.69)岁,男24例,女16例。对照组儿童年龄5~12岁,平均(8.42±1.83)岁,男21例,女19例。两组儿童年龄及性别比较无显著差异 (P>0.05)。本研究获医学伦理委员会批准,所有儿童及家属对本研究内容充分知晓,自愿签署知情同意书。
1.2 方法
1.2.1 干预方法
在常规营养支持下给予所有观察组ISS 儿童重组人生长激素注射液(国药准字:S20050025,10mg),rhGH使用剂量:0.15 IUkg·-1d·-1,每晚睡前30min经皮下注射,连续注射12个月。于治疗前、治疗3个月、6个月、12个月后分别检测患儿生长发育指标、血糖相关指标、甲状腺功能指标、骨代谢指标。
1.2.2 指标定义
①生长发育指标:包括身高标准差(height standard deviation, HtSDS)、体重、骨龄、生长速率。其中身高体重在我院儿童保健科直接测定,每次测量时测3次,取3次平均值;HtSDS =(患儿身高-同地区同性别及年龄正常儿童身高参考均值)/同地区同性别及年龄正常儿童身高参考均值[5];骨龄通过G-P图谱法测定;生长速率=(治疗后身高-治疗前身高)/治疗时间×12。②血糖相关指标:包括空腹血糖(fasting blood glucose,FBG)和胰岛素(insulin,INS)。检测方法为抽取患儿清晨空腹静脉血3mL,3 000r/min离心10min分离血清,采用葡萄糖氧化酶法测FBG,采用免疫化学发光法测INS。③甲状腺功能指标:包括促甲状腺激素(thyroid stimulating hormone,TSH)、游离三碘甲状腺原氨酸(free thyroxine 3, FT3)、游离甲状腺素(free thyroxine 4, FT4)、FT3/FT4。采用免疫化学发光分析法检测血清中TSH、FT3、FT4,计算FT3/FT4值。④骨代谢指标:包括骨源性骨碱性磷酸酶(bone alkaline phosphatase, BAP)、骨钙素(osteocalcin, OC)、血清I型前胶原氨基端前肽(serum type I procollagen carboxyl terminal propeptide, PINP)、25-羟基维生素D3[25-hydroxyvitamin D3,25-(OH)D3]、骨密度桡骨远端骨量。使用超声骨量测定仪,以桡骨远端超声速度(speed of sound, SOS)表示骨密度桡骨远端骨量,采用电化学发光法检测血清中PINP,采用免疫化学发光夹心法检测血清BAP、OC、IGF-1,采用免疫化学发光竞争法测定25-(OH)D3。对照组儿童于体检当日检测生长发育指标及骨代谢指标,方法同观察组。
1.3 观察指标
①观察组治疗前后及对照组体检当日生长发育指标;②观察组治疗前后血糖相关指标;③观察组治疗前后甲状腺功能指标;④观察组治疗前后及对照组骨代谢指标;⑤观察组治疗期间药物不良反应发生情况,包括局部皮肤红肿、糖耐量异常、头痛等。
1.4 统计学分析
通过SPSS 23.0软件进行数据分析,计量资料以 均数±标准差()来表示,两组比较采用独立样本t 检验,三组比较采用重复测量的方差分析。计数资料用例数(n)和率(%)表示。以P<0.05表示差异具有统计学意义。
2 结果
2.1 观察组治疗前后及对照组体检当日生长发育指标比较
治疗前观察组生长发育指标均明显低于对照组 (P <0.05)。观察组治疗12 个月后,组内HtSDS、体重、骨龄、生长速率差别具有统计学意义(F 值分别为2.730、9.510、6.010、52.250,均P <0.05)。进一步比较后发现,治疗3个月后,仅生长速率显著高于治疗前;治疗6个月后,HtSDS、骨龄、生长速率均明显高于治疗前;治疗12个月后,四个指标均高于治疗前,见表1。
表1 观察组治疗前后及对照组体检当日生长发育指标比较()Table 1 Comparisons of growth and development indexes before and after treatment in the observation group and on the day of physical examination in the control group()

表1 观察组治疗前后及对照组体检当日生长发育指标比较()Table 1 Comparisons of growth and development indexes before and after treatment in the observation group and on the day of physical examination in the control group()
注:*表示与对照组比较,P <0.05;a 表示与本组治疗前比较,P <0.05;b 表示与本组治疗3 月后比较,P <0.05;c 表示与本组治疗6月后比较,P <0.05。
组别 HtSDS 体重(kg) 骨龄(y) 生长速率(cm/y)观察组(n=40)治疗前 -2.62±0.79* 22.76±3.63* 6.16±1.45* 4.32±1.13*治疗3 月后 -2.51±0.58 23.12±3.51 6.57±1.18 5.47±1.38 a治疗6 月后 -2.32±0.36ab 23.58±3.57 6.92±1.05 a 7.62±1.64 ab治疗12 月后 -2.07±0.45abc 24.25±2.64 a 7.17±0.73 ab 7.66±1.58 ab F 2.730 9.510 6.010 52.250 P 0.046 <0.001 0.001 <0.001对照组(n=40) 0.23±0.52 25.83±2.32 7.54±0.52 6.63±2.42
2.2 观察组治疗前后血糖相关指标比较
治疗前观察组FBG、INS与对照组比较无显著差异(P >0.05)。观察组治疗12个月后,组内FBG、INS差别无统计学意义(F值分别为0.530、0.070,均P>0.05),见表2。
表2 观察组治疗前后血糖相关指标比较()Table 2 Comparisons of blood glucose relevant indexes of the children in the observation group before and after treatment()
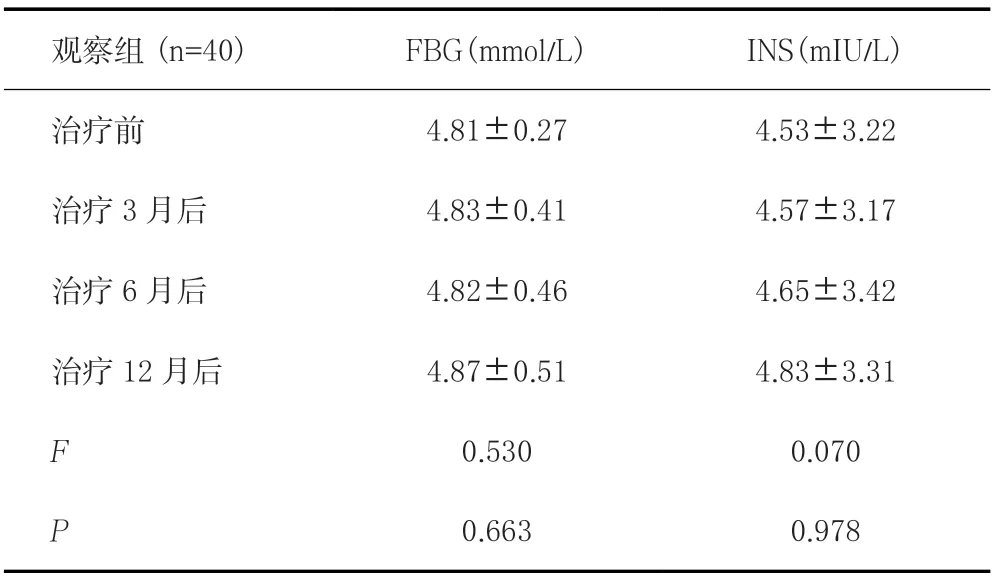
表2 观察组治疗前后血糖相关指标比较()Table 2 Comparisons of blood glucose relevant indexes of the children in the observation group before and after treatment()
观察组(n=40) FBG(mmol/L) INS(mIU/L)治疗前 4.81±0.27 4.53±3.22治疗3 月后 4.83±0.41 4.57±3.17治疗6 月后 4.82±0.46 4.65±3.42治疗12 月后 4.87±0.51 4.83±3.31 F 0.530 0.070 P 0.663 0.978
2.3 观察组治疗前后甲状腺功能指标比较
观察组治疗3月、6月、12月后TSH、FT3、FT4、FT3/FT4与治疗前比较均无显著差异(F 值分别为2.350、1.050、0.001、0.790,均P>0.05),见表3。
表3 观察组治疗前后甲状腺功能指标比较()Table 3 Comparisons of thyroid function indexes of the children in the observation group before and after treatment ()
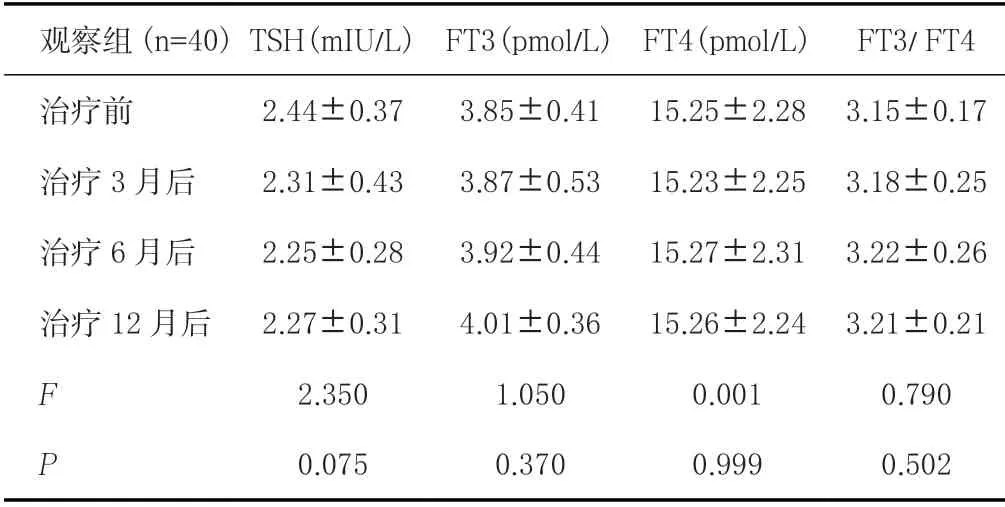
表3 观察组治疗前后甲状腺功能指标比较()Table 3 Comparisons of thyroid function indexes of the children in the observation group before and after treatment ()
观察组(n=40) TSH(mIU/L) FT3(pmol/L) FT4(pmol/L) FT3/ FT4治疗前 2.44±0.37 3.85±0.41 15.25±2.28 3.15±0.17治疗3 月后 2.31±0.43 3.87±0.53 15.23±2.25 3.18±0.25治疗6 月后 2.25±0.28 3.92±0.44 15.27±2.31 3.22±0.26治疗12 月后 2.27±0.31 4.01±0.36 15.26±2.24 3.21±0.21 F 2.350 1.050 0.001 0.790 P 0.075 0.370 0.999 0.502
2.4 观察组治疗前后及对照组骨代谢等指标比较
治疗前观察组骨代谢指标均明显低于对照组 (P <0.05),治疗后观察组BAP、OC、PINP、IGF-1在各时间点均与对照组差别无统计学意义,25-(OH)D3和SOS差别仍有统计学意义。另外,观察组治疗12个月后,BAP、OC、PINP、IGF-1、SOS组内差别均具有统计学意义(F 值分别为49.900、10.480、19.760、77.960、3.310,均P<0.05),25-(OH)D3差别无统计学意义(F = 0.660, P >0.05)。进一步比较后发现,治疗3个月、6个月、12个月后,BAP、OC、PINP、IGF-1随时间推移呈增高趋势,SOS则呈显著递减趋势,见表4。
表4 观察组治疗前后及对照组骨代谢指标比较()Table 4 Comparisons of bone metabolism indexes before and after treatment in the observation group and between the two groups()
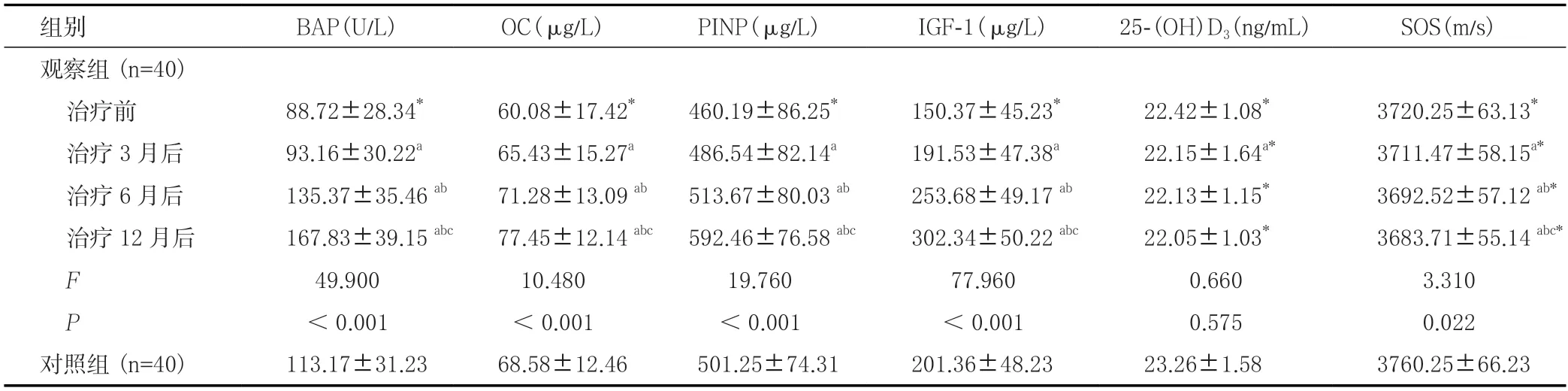
表4 观察组治疗前后及对照组骨代谢指标比较()Table 4 Comparisons of bone metabolism indexes before and after treatment in the observation group and between the two groups()
注:*表示与对照组比较,P <0.05;a 表示与本组治疗前比较,P <0.05;b 表示与本组治疗3 月后比较,P <0.05;c 表示与本组治疗6月后比较,P <0.05。
组别 BAP(U/L) OC(μg/L) PINP(μg/L) IGF-1(μg/L) 25-(OH)D3(ng/mL) SOS(m/s)观察组(n=40)治疗前 88.72±28.34* 60.08±17.42* 460.19±86.25* 150.37±45.23* 22.42±1.08* 3720.25±63.13*治疗3 月后 93.16±30.22a 65.43±15.27a 486.54±82.14a 191.53±47.38a 22.15±1.64a* 3711.47±58.15a*治疗6 月后 135.37±35.46 ab 71.28±13.09 ab 513.67±80.03 ab 253.68±49.17 ab 22.13±1.15* 3692.52±57.12 ab*治疗12 月后 167.83±39.15 abc 77.45±12.14 abc 592.46±76.58 abc 302.34±50.22 abc 22.05±1.03* 3683.71±55.14 abc*F 49.900 10.480 19.760 77.960 0.660 3.310 P<0.001 <0.001 <0.001 <0.001 0.575 0.022对照组(n=40) 113.17±31.23 68.58±12.46 501.25±74.31 201.36±48.23 23.26±1.58 3760.25±66.23
2.5 观察组治疗期间药物不良反应发生情况
观察组治疗期间出现2例皮肤红肿患儿(5.00%),1例头痛患儿(2.50%),2例空腹胰岛素、空腹血糖受损(5.00%),无其它不良反应。头痛、空腹血糖、胰岛素受损通过暂停用药可自行恢复正常。
3 讨论
3.1 ISS 发病原因及治疗
ISS的发生与遗传、儿童生长过程中机体营养状态、内分泌及代谢情况密切相关。目前ISS约占临床儿童矮身材60%~80%,常分为体质性生长、青春期延迟及家族性矮身材三种类型[6]。未经及时治疗的ISS患儿在生长发育过程中无法达到正常儿童的生长速度,机体各生长发育指标异常,其成年后身高甚至低于遗传身高。ISS治疗目的主要是提升患儿生长速度,最终提高其成年后身高。虽然ISS定义为生长激素检查正常的矮身材儿童,但治疗ISS时给予生长激素刺激仍可促进患儿生长。rhGH是利用大肠埃希菌分泌型基因表达技术合成的,在功能上与人自身分泌的生长激素基本一致[7]。通过给予外源性rhGH,可补充患儿机体内内源性生长激素分泌量,提高生长激素活性[8]。但给予rhGH后的副反应仍存在争议[9],鉴于rhGH可能会对机体其它代谢功能如糖脂代谢产生影响,或引起甲状腺功能紊乱,同时治疗后可能因生长过快导致骨骼改变以及患儿家庭经济承受能力有限等原因,rhGH治疗方法目前在临床上并未广泛应用。
3.2 骨代谢各指标意义
临床ISS患儿除身材矮小外,还可表现为较同龄、同性别儿童骨龄偏低、第二性征发育迟缓。骨骼发育正常是保证儿童身高发育正常的前提条件。因此ISS患儿常会出现骨代谢功能障碍,骨代谢相关指标水平分泌异常[10]。BAP是成骨细胞表面标志物,常用于评价成骨细胞活性及功能[11]。OC是由成骨细胞与成牙质细胞合成分泌的一种蛋白质,在调节机体骨钙代谢功能中起重要作用[12]。PINP是由成骨细胞合成分泌,可反映骨形成情况的指标[13]。IGF-1是IGF家族中的一种依赖生长激素的多肽,具有强促生长作用,在儿童生长发育过程中非常重要[14]。25-(OH)D3是机体内维生素D的主要存在形式,维生素D是人体骨骼发育的必备物质。
3.3 rhGH 治疗后骨代谢指标及其它代谢功能指标变化
本研究通过在ISS儿童常规营养治疗基础上给予rhGH注射治疗,观察患儿骨代谢、糖代谢、甲状腺功能、生长发育速度。骨代谢各指标检测结果显示,治疗3月、6月、12月后观察组BAP、OC、PINP、IGF-1随时间推移呈增高趋势,且较治疗前均明显升高。提示增加rhGH注射治疗后能明显改善ISS儿童机体多种骨代谢指标分泌异常情况。观察组治疗3月、6月、12月后 25-(OH)D3与SOS均呈降低趋势,分析其原因可能是由于骨骼生长加速,容易导致骨质疏松和维生素D缺乏,因此在给予rhGH后患儿25-(OH)D3与SOS降低。生长发育指标结果显示观察组患儿治疗3月、6月、12月后HtSDS、生长速率、体重、骨龄均呈升高趋势,且与治疗前相比在治疗12个月后升高明显。提示给予rhGH治疗后确实能明显促进ISS患儿生长。分析其原因,可能是由于rhGH能替代人体内生长激素,使肝脏分泌的IGF-1增加,成骨细胞增生速度加快,骨形成速度高于骨吸收速度,从而促进了骨骼生长[15]。另外,糖代谢与甲状腺功能各指标检测结果显示,治疗前、治疗后各时间点观察组FBG、INS、TSH、FT3、FT4水平变化不明显,同时治疗期间观察组各不良反应发生率也较低。提示rhGH注射治疗后不会对ISS儿童糖代谢、甲状腺功能产生影响,具有一定安全性。
综上所述,在常规营养支持基础上增加rhGH治疗能明显促进ISS患儿生长,改善多种骨代谢指标异常情况。同时本研究结果显示rhGH不会对患儿糖代谢、甲状腺功能产生明显不良影响,不良反应发生率也较低,表明rhGH治疗的安全性较高,具有一定临床应用价值。

