周期性饥饿再投喂对长蛸存活、生长以及肌肉脂肪酸和氨基酸的影响
宋旻鹏 汪金海 陈智威 李希豹 郑小东
(中国海洋大学海水养殖教育部重点实验室, 青岛 266003)
水生动物在经过一段时间的饥饿或营养不足后恢复摄食, 表现出超过其正常生长速度的现象,称为补偿生长[1,2]。补偿生长是水生动物营养生理学的重要组成部分, 根据恢复生长的程度可以将补偿生长分为不能补偿生长、部分补偿生长、完全补偿生长和超补偿生长四类[3], 关于其形成机制, 主要存在以下三种观点: (1)提高自身摄食量[4]; (2)提高食物转化率[3]; (3)既提高自身摄食量又提高食物转化率[5]。在实际生产中, 合理的利用动物的补偿生长可以有效提高饲料利用率、促进养殖动物生长、降低劳动成本以及减轻水体污染[6], 对推动科学养殖具有重要意义。目前, 水生动物的补偿生长研究, 已在贝类[7,8]、鱼类[9,10]、甲壳类[11,12]等水生动物中广泛开展。
长蛸(Octopus minor)又称八蛸、长腿蛸、章鱼等, 广布于我国南北沿海、朝鲜半岛以及日本沿海海域[13], 是我国重要经济蛸类。近年来, 许多研究人员已针对长蛸细胞生物学[14]、遗传学[15—17]、营养学[18]、胚胎发育[19]、增养殖[20]、摄食行为学[21]等方面开展过研究, 本课题组于2017年开展了生长期长蛸的补偿生长研究, 分析了在不同饥饿时间后恢复投喂对长蛸补偿生长的影响[4]。在补偿生长研究中, 周期性饥饿被认为是获得理想补偿生长效果的一种有效方法[6], 但关于长蛸生长期阶段的周期性饥饿胁迫后的补偿生长研究尚未见报道。在本研究中, 我们通过对生长期长蛸开展周期性饥饿再投喂实验, 研究其生长、存活, 以及肌肉脂肪酸和氨基酸含量变化, 探讨不同投喂模式对暂养长蛸的影响并制定出合理的投喂计划, 旨在为我国长蛸增养殖健康发展提供参考资料和理论支撑。
1 材料与方法
1.1 实验材料
本实验于2018年9—10月在山东马山集团育苗厂内开展。选取体质健壮、外观完好的健康长蛸[体重(94.29±9.35) g, 胴背长(53.25±5.25) mm]120只野生个体用于实验。实验期间采用肉球近方蟹[Hemigrapsus sanguineus, 体重(7.52±1.38) g]作为饵料。
1.2 实验方法
实验前驯养3d, 驯养期间对长蛸进行饱食投喂,驯养结束后开始实验。实验分为4组, 包括1个对照组和3个周期性饥饿再投喂组, 每组设置3个平行实验, 每个平行10只长蛸。实验设计如下:
对照组: 连续投喂24d;
S1F5组: 饥饿1d, 投喂5d, 持续4个周期;
S2F4组: 饥饿2d, 投喂4d, 持续4个周期;
S3F3组: 饥饿3d, 投喂3d, 持续4个周期;
实验于长方形水泥池(6 m×1 m×0.6 m)中进行,水深0.5 m, 采用经沙滤的自然海水, 盐度28—31 psu,水温19.8—22.2℃。自然光照, 持续充氧, 长流水养殖, 每日吸污1次, 每3d全换水1次。采用直径90 mm,长度700 mm的灰色PVC管为蛸巢。每日17:00投饵, 次日上午8:00清理并统计残饵。
在实验结束后, 分别统计各实验组长蛸的成活率和体重。每个实验组随机选取3只长蛸剖取肝脏测定肝体比, 并取其腕部肌肉于液氮中保存。
(1) 成活率(SR)、增重率(WG)、肝体比(HSI)、个体摄食量(FI)计算方法

其中:N1表示实验开始时个体数量,N2表示实验结束时个体存活数量;Wt1和Wt2分别表示实验开始和结束时个体体重;Wg表示个体肝脏体重,Wt表示个体体重;WS1表示投饵质量,WS2表示残饵质量。
(2) 肌肉脂肪酸含量测定方法
将长蛸肌肉样品冷冻干燥48h, 后使用研钵将肌肉样品研磨成粉末状。取长蛸肌肉样品100 mg,加入乙酰氯-甲醇溶液(1∶20) 2 mL, 80℃条件下水浴加热20min, 待样品冷却后, 加入1 mL正己烷萃取, 期间注意遮光处理。后使用气相色谱仪(HP6890 PLUS GC型)对提取的脂肪酸进行分析, 测量结果以脂肪酸标品(SIGMA公司生产)为参照, 通过归一法计算各个脂肪酸组分的百分含量。
(3) 氨基酸含量测定方法
称取长蛸肌肉干粉20 mg于安培瓶中, 加入10 mL 6 mol/L盐酸溶液, 充氮, 密封, 于110℃下水解24h,减压蒸干, 加入0.02 mol/L盐酸于10 mL容量瓶内定容。后取0.2 mL该溶液以及三乙胺、异硫氰酸苯酯各0.1 mL置于离心管中, 室温下静置1h, 加入400 mL正己烷, 震荡, 静置10min, 使用0.45 μm膜对下层溶液进行过滤, 将滤液置于氨基酸自动分析仪(SYKAM, S-433D)中以测定氨基酸组成。
1.3 数据分析
实验数据均采用平均值±标准差(Mean±SD)表示。使用SPSS 22.0软件统计, 进行ANOVA单因素方差分析和Duncan’s多重检验分析, 以P<0.05表示差异显著。
2 结果
2.1 周期性饥饿再投喂对长蛸生长性能的影响
在实验开始前, 各实验组长蛸起始体重差异不显著(P>0.05; 表 1)。周期性饥饿再投喂实验结束后, 各组长蛸终末体重差异显著具体情况如下: S1F5组长蛸终末体重(136.70±9.24) g显著高于对照组值(127.69±6.51) g (P<0.05), S3F3组长蛸终末体重(118.26±6.46) g显著低于对照组值(P<0.05), 而S2F4组终末体重(130.45±6.78) g与对照组值差异不显著(P>0.05; 表 1)。实验长蛸的成活率随饥饿时间增长逐渐降低, 但各实验组均与对照组差异不显著(P>0.05), 各组成活率分别为: 对照组(93.33±11.55)%、S1F5组(93.33±5.77)%、S2F4组(86.67±15.28)%、S3F3组(83.33±5.77)%。

表 1 周期性饥饿再投喂对长蛸生长性能的影响Tab. 1 Effects of periodical starvation-refeeding on growth performance of O. minor
2.2 周期性饥饿再投喂对长蛸增重率、肝体比、个体摄食量以及饵料效率的影响
图 1所示, 各组长蛸的增重率随饥饿时间的增长先上升后下降, S1F5组的增重率显著高于对照组,S3F3组显著低于对照组(P<0.05), 其中增重率值最高的为S1F5组(0.46±0.10), 最低的为S3F3组(0.26±0.06)。长蛸的肝体比随饥饿时间的增长呈现先升高后降低的趋势(图 1), 其中, S1F5组肝体比值显著高于对照组(P<0.05), S2F4组和S3F3组的肝体比值与对照组差异不显著(P>0.05)。具体排序为: S1F5组(0.070)>对照组(0.062)>S2F4组(0.059)>S3F3组(0.052)。
图 2所示, 实验长蛸的个体摄食量对饥饿时间的延长呈现上升趋势。其中, S1F5组、S2F4组以及S3F3组值均显著高于对照组(P<0.05)。其具体排序为: S3F3组(5.13±1.25) g>S2F4组(5.04±0.91) g>S1F5组(4.76±1.11) g> 对照组(3.34±0.81) g。与个体摄食量变化趋势不同, 个体体重变化量呈现先上升后下降的趋势。其中, S1F5组个体体重变化量(42.36±4.89) g显著高于对照组值(33.78±4.39) g (P<0.05),S3F3组值(23.93±3.73) g显著低于对照组值(P<0.05),S2F4组值(35.88±3.21) g与对照组值差异不显著(P>0.05)。
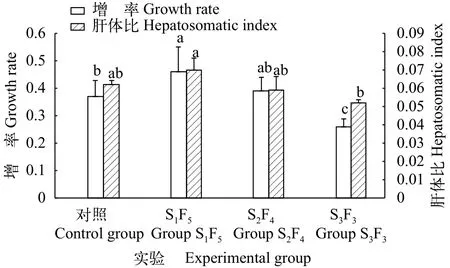
图 1 周期性饥饿再投喂对长蛸增重率及肝体比值的影响Fig. 1 Effects of periodical starvation-refeeding on growth rate and hepatosomatic index of O. minor
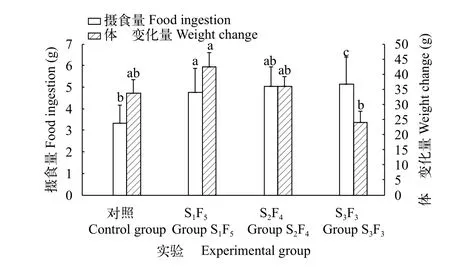
图 2 周期性饥饿再投喂对长蛸摄食量和体重变化量的影响Fig. 2 Effects of periodical starvation-refeeding on food ingestion and weight change of O. minor

表 2 周期性饥饿再投喂对长蛸肌肉脂肪酸含量的影响Tab. 2 Effects of periodical starvation-refeeding on muscle fatty acid content of O. minor
2.3 周期性饥饿再投喂对长蛸肌肉脂肪酸含量的影响
据表 2可知, 长蛸肌肉组织中共检测出16种脂肪酸, 起始碳链长度为14—22, 包含6种饱和脂肪酸(SFA)和10种不饱和脂肪酸(UFA), 其中UFA包括4种单不饱和脂肪酸(MUFA)和6种多不饱和脂肪酸(PUFA)。各实验组SFA、UFA、MUFA、PUFA、Σn-3 PUFA、Σn-6 PUFA、Σn-9 PUFA含量均与对照组差异不显著(P>0.05), 但S1F5组中的值与对照组相比出现了一定程度的升高, S2F4组和S3F3组中值出现一定程度的下降; S1F5组和S3F3组中C18:0的含量显著高于对照组的值(P<0.05); S2F4组C18:1n-7和EPA的含量显著高于对照组的值(P<0.05), 且EPA / DHA也显著高于对照组(P<0.05)。
2.4 周期性饥饿再投喂对长蛸肌肉氨基酸含量的影响
由表 3可知, 于长蛸肌肉组织中共检测出17种氨基酸, 其中必需氨基酸9种, 非必需氨基酸8种。经数据分析发现, 仅S1F5组胱氨酸(Cys)含量显著高于对照组(P<0.05), 实验组中其余氨基酸含量均与对照组差异不显著(P>0.05); 此外, 必需氨基酸总量(TEAA)、氨基酸总量(TAA)以及必需氨基酸总量/氨基酸总量(TEAA/TAA)均与对照组差异不显著(P>0.05), 但随饥饿时间的延长TEAA和TEAA/TAA的值有逐渐升高的趋势。

表 3 周期性饥饿再投喂对长蛸影响Tab. 3 Effects of periodical starvation-refeeding on muscle amino acid content of O. minor
3 讨论
3.1 长蛸补偿生长的实验设计
在鱼类养殖过程中, 补偿生长被认为是一种有效的方法用于加速鱼类的生长, 但由于食物短缺引发的补偿生长在接近对照组生长时具有减慢的现象, 使得最终的生长量并未出现显著的提高[22]。因此建议采用周期性饥饿再投喂的方法, 在每次补偿生长减弱时重新激活, 以增加补偿生长的时间[23]。目前鱼类补偿生长的实验设计主要包含以下两类:一、饵料禁食条件下产生的补偿生长[24]; 二、限制饵料摄食条件下产生的补偿生长[25]。在本研究中,我们采用的是第一类实验设计, 在各组“饥饿+投喂”实验总持续时间相等的基础上[26], 研究不同投喂模式对长蛸补偿生长的影响。在实际生产中, 长蛸的成活率会随饥饿时间的延长逐渐下降, 设定适宜时长的饥饿胁迫对研究长蛸的补偿生长具有重要的影响, 本课题组于2017年开展的长蛸饥饿实验结果显示, 长蛸的成活率自饥饿3d起开始呈现下降趋势[4], 因此, 在本研究中, 我们将最长饥饿时间设定为3d。
3.2 周期性饥饿再投喂对长蛸生长的影响
目前, 补偿生长的衡量指标以摄食量和饵料利用率、蛋白质合成率和能量储备为主[27]。安琪和曾晓起[28]报道马粪海胆(Hemicentrotus pulcherrimus)的补偿生长时, 因海胆壳占湿重比例较大, 将性腺指数和生化组分作为衡量标准。张涛等[26]将成活率和增重率作为无针乌贼(Sepiella japonica)补偿生长的判断标准。通过综合前人的研究基础, 我们将成活率、增重率以及终末体重作为长蛸补偿生长的衡量标准。
在本实验中, S1F5组与对照组相比成活率相同, 而增重率和终末体重显著高于对照组; S2F4组中的成活率、增重率和终末体重均与对照组差异不显著。此结果表明S1F5和S2F4组个体均具有补偿生长的能力, 且S1F5组个体更具备超补偿生长能力。这一结果与大麻哈鱼(Oncorhynchus nerka)和牙鲆(Paralichthys olivaceus)在短期饥饿胁迫下具备补偿生长能力的结果一致[29,30]。同时, 我们还对长蛸的个体摄食量进行了统计, 发现各个实验组长蛸的个体摄食量均显著高于对照组。因此,为保证养殖长蛸在再投喂期间能充分的发挥其补偿生长能力应保证充足的饵料供应。综上所述,从节约成本, 保证养殖长蛸的成活率和生长速度的角度来看, 建议长蛸的最佳投喂模式为周期性饥饿1d再投喂5d。
3.3 周期性饥饿再投喂对长蛸肌肉组织脂肪酸和氨基酸含量的影响
在饥饿条件下, 水生动物会通过消耗自身脂肪酸来提供能量, 其脂肪酸的消耗具有一定的顺序,即首先使用饱和脂肪酸, 再利用低不饱和脂肪酸,最后才动用高不饱和脂肪酸[3]。如鮸(Miichthys miiuy)幼鱼和点带石斑鱼(Epinephelus malabaricus)幼鱼在饥饿过程中, 首先利用饱和脂肪酸(SFA), 其次利用单不饱和脂肪酸(MUFA), 最后才利用多不饱和脂肪酸(PUFA)[31,32]。在本研究中, 结果显示3个实验组的SFA、MUFA以及PUFA的含量均与对照组差异不显著, 从含量变化上看, 长蛸肌肉中的脂肪酸从饥饿2d后开始出现下降且首先利用的是SFA、其次为MUFA、最后才利用PUFA。作者认为肌肉脂肪酸的含量从饥饿2d后才开始下降, 这一现象可能是由于饥饿1d时间太短, 长蛸首先利用了储存在肝脏内的营养物质, 致使肌肉中的脂肪酸含量并未减少。
氨基酸是水生动物必需的营养物质, 对维持水生动物正常的生命活动发挥着重要作用。当水生动物遭受饥饿胁迫时, 其自身能够将氨基酸转化为葡萄糖来提供能量, 具体表现为必需氨基酸总量和氨基酸总量的下降[33,34]。不同种类水生动物对氨基酸的利用也不尽相同, 鳗鲡(Anguilla japonica)经长期饥饿胁迫后, 必需氨基酸量和氨基酸量均显著降低, 且必需氨基酸量较氨基酸量下降的更为明显[35]。大黄鱼(Larimichthys crocea)幼鱼在饥饿早期, 大多数氨基酸组分和氨基酸总量会稍微低于对照组, 但随饥饿时间的增长, 会表现出先上升后下降的趋势[10]。斑点叉尾鮰(Ictalurus punctatus)在遭受饥饿胁迫时, 优先利用非必需氨基酸作为能源物质[36]。在本实验中, 不同实验组的TEAA总量、TAA总量以及TEAA/TAA均与对照组差异不显著, 表明不同投喂模式对长蛸肌肉氨基酸的含量并未产生影响, 这与虎斑乌贼(Sepia pharaonis)幼体经周期性饥饿再投喂后各实验组氨基酸含量与对照组差异不显著的结果一致[6]。此外, 长蛸肌肉中检测出的9种必需氨基酸和8种非必需氨基酸中, 仅Cys的含量显著高于对照组, 这一结果与无针乌贼幼体经过周期性饥饿再投喂处理后Cys含量显著高于对照组的实验结果相似[26]。作者认为这一现象可能与长蛸自身的新陈代谢有关, 饥饿胁迫后降低了长蛸对该种氨基酸的需求量, 致使各实验组的Cys含量均高于对照组, 但具体原因需进一步研究。
致谢:
感谢马山集团有限公司蔡兵经理、王炳辉厂长、蔡辉厂长提供了实验场地和实验材料, 中国海洋大学海水养殖教育部重点实验室2017级硕士研究生南泽参与了部分实验工作。

