草鱼两个细胞因子信号抑制因子3基因序列及表达分析
赵姗姗 孙 源 郑国栋 陈 杰 邹曙明
(上海海洋大学农业部团头鲂遗传育种中心, 农业部淡水水产种植资源重点实验室,水产科学国家级实验教学示范中心, 上海 201306)
在脊椎动物中, 细胞因子在包括体内平衡和免疫反应在内的许多生理过程中发挥着极其重要的作用。细胞因子之间的相互作用与细胞因子信号抑制因子密切相关, 许多细胞因子通过JAK/STAT途径发挥作用[1,2]。细胞因子信号抑制因子(SOCS)蛋白通过调控JAK/STAT信号通路, 最终达到调控细胞活动的目的[3]。SOCS家族的所有成员(SOCS1-7和CIS)皆由N-端结构域、SH2结构域和SOCS盒子构成[4], 而在SOCS家族的成员中只有SOCS1和SOCS3在N端区域有激酶抑制区域, 激酶抑制区域可以作为JAKs的伪底物。
SOCS3作为SOCS蛋白家族新发现的一员, 人们发现SOCS3可被多种免疫细胞因子诱导, 如白细胞介素(IL)等[5]。近年来, SOCS3已经在青斑河豚(Tetraodon nigroviridis)、斑马鱼(Danio rerio)、红旗东方鲀(Fugu rubripes)、三刺鱼(Gasterosteus aculeatus)、虹鳟(Oncorhynchus mykiss)、鲤(Cyprinus carpio)、大菱鲆(Scophthalmus maximus)、牙鲆(Paralichthys olivaceus)、草鱼(Ctenopharyn-godon idellus)等鱼种中被发现[6—11]。在鱼类中鉴定出的所有SOCS家族成员都应该是由特定的鱼类基因复制事件引起的[12,13]。有研究表明, SOCS3是许多生物过程的关键影响因素, 包括免疫反应和细胞存活等[14,15]。目前鱼类SOCS3的两个拷贝基因在表达水平上比较分析只有少数的研究。
草鱼(Ctenopharyngodon idellus)作为一种主要的食草性淡水鱼, 因其味道鲜美在中国广受欢迎。2017年, 我国草鱼产量达到5.35×109kg[16]。在本研究中, 我们从草鱼中克隆了SOCS3b, 确定了成体组织中SOCS3a和SOCS3b表达模式。此外, 研究了注射嗜水气单胞菌后草鱼SOCS3s基因的表达情况。本研究将为后续草鱼SOCS3s基因的功能研究提供参考依据。
1 材料与方法
1.1 实验材料
本研究中所有的实验都是按照上海海洋大学动物实验和护理委员会批准的指导方针进行的。本研究中草鱼取自上海海洋大学滨海基地。本实验中所有草鱼取组织前都先用100 mg/L的MS-222(三卡因甲磺酸盐, Sigma)处理。快速取草鱼成鱼组织, 包括脑、眼、鳃、心、肝、脾、肠、肾、皮、肌和性腺, 储存在-80℃冰箱中。
1.2 草鱼SOCS3b基因的克隆
按照说明书要求, 总RNA提取试剂盒(Promega)提取草鱼总RNA, 反转录试剂盒(GoScriptTMReverse Transcription System. Promega)得到第一链cDNA。实验室克隆得到的团头鲂SOCS3b基因(GenBank Acc. No. MH107242)为模板, 设计引物对F1/R1(表 1)扩增草鱼SOCS3bcDNA片段一, 然后设计引物对F2/R2(表 1)扩增草鱼SOCS3bcDNA片段二。经过测序结果整合后, 总扩增出1398 bp cDNA片段, 用于设计基因特异性引物3′RACE(3RACE-O, 3RACE-I)和5′RACE(5RACE-O, 5RACE-I)。5′和3′RACE使用SMART RACE cDNA扩增试剂盒(Clontech)进行扩增。PCR产物经过处理后进行测序, 具体操作参考杜尚可[17]。测序结果用BioEdit 7.0.0.1软件, 拼接得到草鱼SOCS3b基因cDNA全长序列。
1.3 嗜水气单胞菌攻毒实验
健康草鱼幼鱼(23±4) g在室内水泥池饲养2周。从病鱼中提取的致病性嗜水气单胞菌, 接种到LB液体培养基中, 摇床28℃培养16h。细菌的浓度即每毫升菌液的菌落数(CFU/mL)通过使用平板计数法获得。离心收集嗜水气单胞菌, 制备成4×106CFU/mL磷酸盐(PBS, 上海生工生物技术公司)菌悬液。实验组感染18条幼鱼, 腹腔注射0.1 mL上述PBS菌悬液, 对照组对18条幼鱼注射0.1 mL PBS溶液。注射后的草鱼放回水泥池, 水温维持在28℃左右。注射后0、2h、4h、8h、12h和24h, 随机抽取两组各3条鱼进行麻醉, 取其肝、脾、肠和肾超低温保存。
1.4 序列及进化树分析
使用BioEdit 7.0.0.1分析SOCS3a和SOCS3bcDNA的核苷酸序列[18]。通过NCBI(https://www.ncbi.nlm.nih.gov/)ORF Finder在线查找开放阅读框,BLASP和Search程序对不同物种的SOCS3蛋白推测序列进行比较[17]。Compute pI/Mw(http://web.expasy.org/compute_pi)预测蛋白分子量和等电点。Phyre2和Pymol软件预测SOCS3蛋白的二级结构[19]。MEGA 6.06[20]构建SOCS3系统发育树。
1.5 实时定量PCR(qRT-PCR)分析
实时定量PCR在CFX96 TouchTMreal-time PCR检测系统(Bio-Rad)中进行[21]。以18S(引物对为18S-F/-R)为对照[22], 使用SYBR Green Premix ExTaq(TaKaRa)进行qRT-PCR检测。数据以Mean±SE的形式表示, 用SPSS Statistics 17.0软件采用单因素方差法分析。
2 结果
2.1 草鱼SOCS3b cDNA序列
本文克隆的到的草鱼SOCS3b基因序列已上传至NCBI数据库, 基因库编号MH463452。草鱼SOCS3b基因全长2126 bp, 5′非编码区长170 bp, 开放阅读框为651 bp, 3′非编码区长1307 bp。分析得到该序列编码216个氨基酸, 预测等电点为7.15, 相对分子质量为23.90 kD。NCBI数据库草鱼SOCS3(GenBank Accession No. EU625352.1)经序列对比,与斑马鱼SOCS3a(NM199950.1)相似度为87%, 与团头鲂SOCS3a(MH107241)相似度99%, 我们判断它与斑马鱼和团头鲂SOCS3a直系同源(Orthologue)。为了方便区分, 本文中将上述草鱼SOCS3在称为草鱼SOCS3a。序列分析草鱼SOCS3b包含一个SH2域和一个SOCS盒, 与草鱼SOCS3a和其他物种SOCS3相似。通过 Phyre2 程序和 Pymol 软件预测草鱼SOCS3b二级结构, 并与人类(Homo sapiens)SOCS3、斑马鱼SOCS3s和草鱼SOCS3a对比, 发现人类、斑马鱼与草鱼SOCS3二级结构都主要包括α螺旋和无规则卷曲(图 1), 且结构相似。
通过NCBI BLASP发现,SOCS3a和SOCS3b基因都广泛存在于硬骨鱼中, 包括鲤科、异鳉科、棘鱼科和副棘鱼科。BioEdit 7.0.0.1分析得出, 草鱼SOCS3a和SOCS3b的成熟肽具有72%相似度,SOCS3a的SH2结构域和SOCS盒分别与SOCS3b序列相似度分别为76%和78%。草鱼SOCS3a/3b和人SOCS3的氨基酸序列相似度分别为63%和62%。草鱼和斑马鱼SOCS3a氨基酸序列相似度(87%)低于草鱼和斑马鱼SOCS3b氨基酸相似度(91%)。通过系统发育树分析表明草鱼SOCS3a和SOCS3b与其他硬骨鱼种的直系同源体均有良好的聚类关系(图 2)。草鱼SOCS3a和SOCS3b的成熟肽相似度(72%), 小于草鱼和斑马鱼SOCS3a氨基酸序列相似度(87%), 也小于草鱼和斑马鱼SOCS3b氨基酸相似度(91%)。因此所有鱼类SOCS3a聚类为一簇, 而所有SOCS3b聚类为一簇。
2.2 SOCS3a和SOCS3b的表达模式
通过qRT-PCR方法检测到SOCS3a和SOCS3b在草鱼成鱼11个组织中均有所表达, 但表达略有不同。草鱼SOCS3a在鳃、脾、肠、肝、肌、肾和皮中表达较高, 在心、脑、眼和性中表达较低(图 3);SOCS3b在鳃、肝、脾、肠、性、皮和肾中表达较高, 在肌、心、脑和眼中表达较低(图 3)。
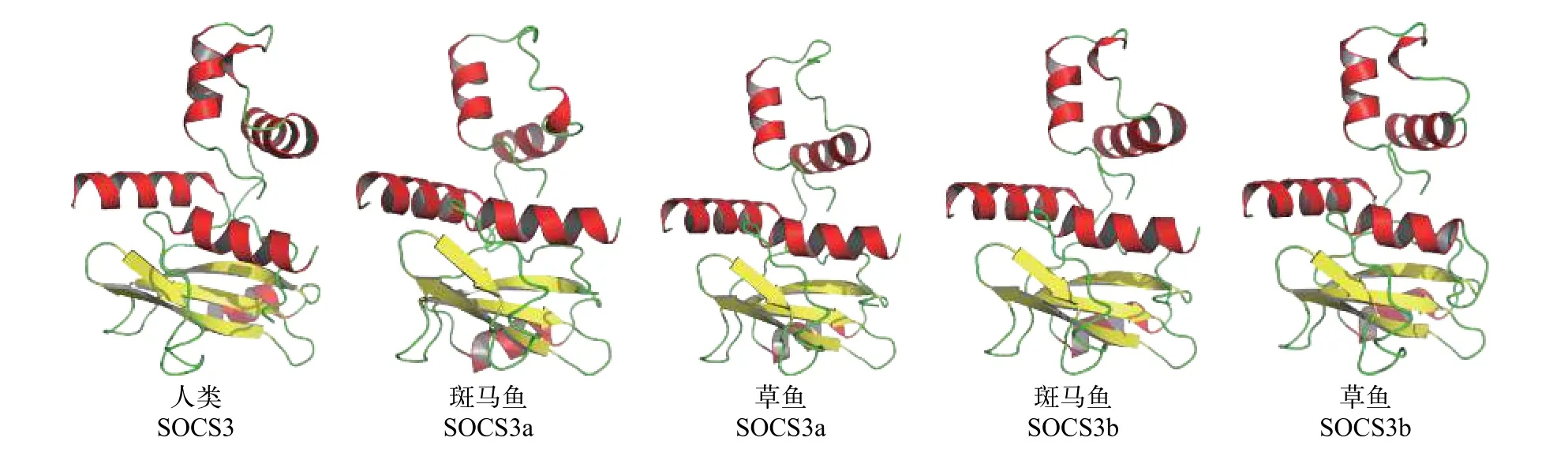
图 1 预测人类、斑马鱼及草鱼SOCS3二级结构Fig. 1 The predicted the secondary structure of SOCS3 in human, zebrafish and grass carp

图 2 草鱼SOCS3s基因序列构建的系统进化树Fig. 2 Phylogenetic tree of grass carp SOCS3s sequences in vertebrates
2.3 嗜水气单胞菌处理后草鱼组织中SOCS3s的表达
为了研究注射嗜水气单胞菌后草鱼中SOCS3a和SOCS3b的表达模式, 在草鱼幼鱼腹腔内注射相同剂量的嗜水气单胞菌[23]。在目前的研究中, 注射嗜水气单胞菌后SOCS3a和SOCS3b在肝脏、脾、肠和肾脏组织的表达显著(P<0.01, 图 4)。经qRTPCR检测后发现, 与对照组相比, 肝脏中SOCS3a/3bmRNAs表达峰值出现在注射后2h(2 hpi), 分别为对照组的21.6倍和17.5倍, 然后表达量几乎减少到原始水平; 在脾脏中,SOCS3a/-3bmRNAs表达峰值出现在4 hpi(17.6倍和18.8倍), 然后几乎下降到原始水平; 在肠道中,SOCS3a和SOCS3b最高表达量出现在4 hpi(分别为21.4倍和16.1倍);SOCS3a/3bmRNAs在肾脏中的相对表达量在12 hpi时达到峰值, 与对照组相比分别约29.6倍和22.2倍(图 4)。
3 讨论
3.1 草鱼SOCS3b序列分析
哺乳动物、鸟类和两栖动物SOCS3只有一个拷贝, 现发现硬骨鱼中SOCS3有两个拷贝[24]。在本研究中, 我们在草鱼中克隆了SOCS3b基因。草鱼SOCS3a和SOCS3b的成熟肽区域中均含有脊椎动物中保守表达的SH2结构域、SOCS盒子以及N端分泌信号, 预测的草鱼SOCS3b二级结构图与人类、斑马鱼和草鱼SOCS3相似, 说明草鱼SOCS3s基因在长期进化中高度保守。通过对氨基酸半胱氨酸残基的观察, 发现SOCS3b分子中还含有除团头鲂外与其他鱼类不同的半胱氨酸残基(Cys-105)。这表明草鱼和团头鲂SOCS3b结构的特殊性,可能与其他鱼类SOCS3b有略微不同。
草鱼SOCS3a和SOCS3b成熟肽相似度为72%,这与斑马鱼SOCS3a和SOCS3b相似度(68%)相似。草鱼SOCS3a/-3b氨基酸序列和斑马鱼SOCS3a/-3b相似度分别为87%和92%, 说明草鱼SOCS3s与斑马鱼SOCS3s同源性高。系统发育树分析表明, 草鱼SOCS3a和SOCS3b与其他硬骨鱼种的直系同源体均有良好的聚类关系, 这表明它们是硬骨鱼特异性基因组复制的结果。
3.2 草鱼SOCS3s表达模式分析
研究部分硬骨鱼发现,SOCS3在成体组织中表达[8]。同样, 草鱼SOCS3a和SOCS3b都在成体组织中表达。我们检测到性腺中SOCS3b表达量高, 而SOCS3a表达量低, 说明这两个基因表达有不同之处。此外, qRT-PCR检测到草鱼SOCS3s基因在鳃、肝、脾、肾、肠、皮肤等免疫相关组织中高度表达。先前研究报道虹鳟SOCS3在脾、肠、鳃和皮中大量表达[7], 大菱鲆SOCS3在鳃、脾、肝、肾中大量表达[9], 鲤SOCS3在鳃、头肾、皮和脾中大量表达[8], 说明本研究结果与前人的一致。根据这些表达特征可以推断草鱼SOCS3s基因可能与免疫应答反应有关。

图 3 草鱼SOCS3s在成体不同组织的表达情况Fig. 3 The SOCS3s mRNA levels in adult tissues of grass carp
3.3 嗜水气单胞菌处理后草鱼组织中SOCS3s表达分析
近年来越来越多的研究表明, SOCS3与免疫应答反应有关。在我们的研究中, 嗜水气单胞菌感染草鱼后, 肝、脾、肠和肾中SOCS3s的表达量首先显著增加, 然后几乎下降到原来的水平。我们的研究结果与前人的相似, 有研究报道LPS(脂多糖)注射到河豚后, 脾和肝的SOCS3表达水平显著升高[6];鲤感染SVCV(鲤病毒春季病毒血症)后, 脾、肠和肾组织的SOCS3表达模式在感染后显著升高, 随后几乎下降到正常水平[8]。大菱鲆感染鱼源鳗线虫的实验中, 随着时间的变化诱导肾脏、脾脏和肝脏中的SOCS3 mRNA的转录[9]。我们的结果表明草鱼SOCS3s与草鱼的免疫反应相关, 似乎引发了草鱼对嗜水气单胞菌的炎症反应, 这表明鱼类中的SOCS3s也可能在平衡细胞因子利害关系中发挥着重要作用。我们的研究和前人的报道都表明硬骨鱼SOCS3s可能在调节细菌诱导的免疫反应中发挥积极的作用。
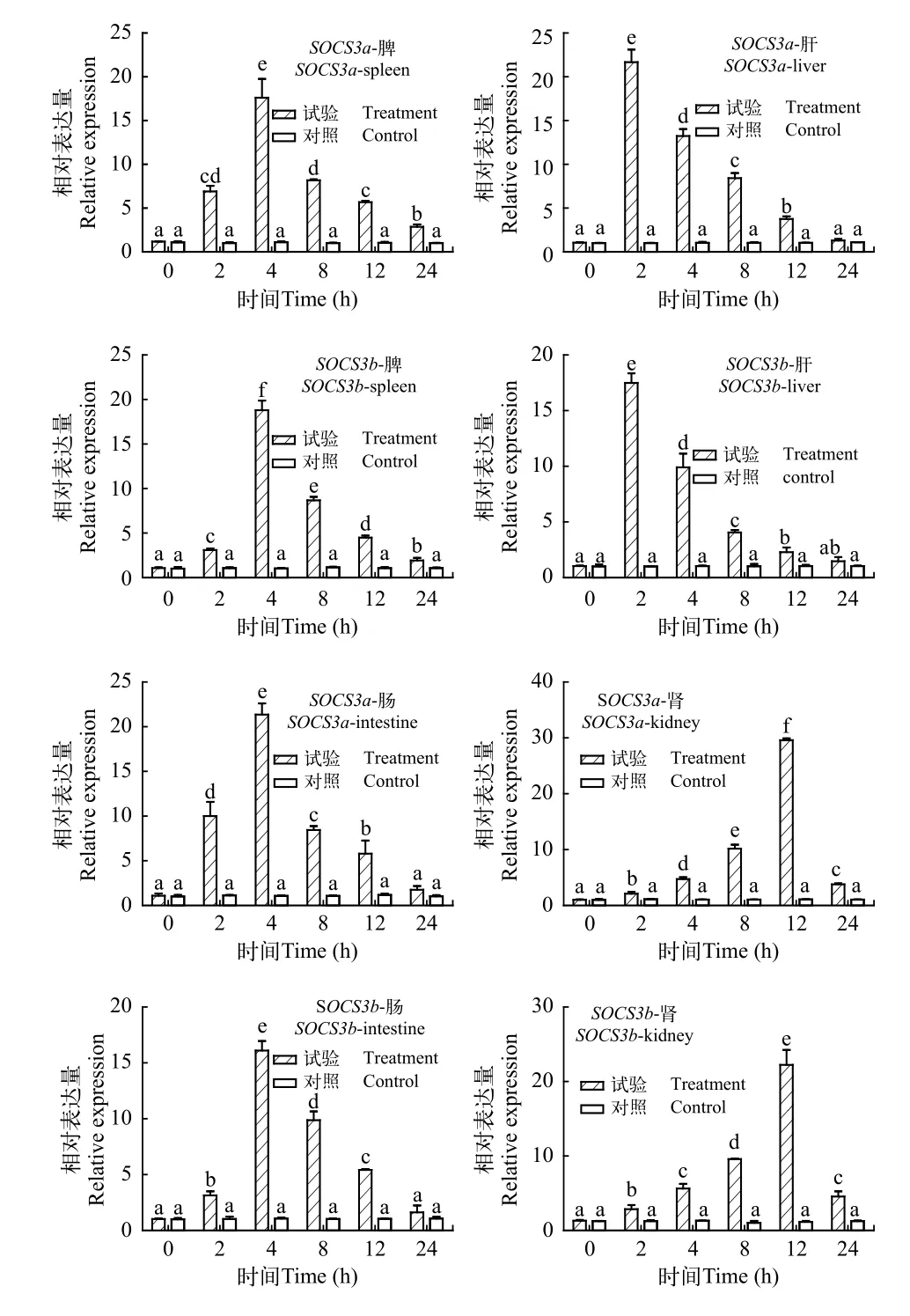
图 4 嗜水气单胞菌处理后幼鱼各组织中草鱼SOCS3的表达情况Fig. 4 The SOCS3 mRNA level in juvenile tissues after Aeromonas hydrophila injection of grass carp
综上所述, 我们克隆了草鱼的SOCS3b基因。序列和表达结果表明, 草鱼的两个SOCS3基因应该是由一个祖先基因进化而来。据检测, 草鱼SOCS3s基因在鳃、肝、脾、肾、肠、皮肤等免疫相关组织中高度表达。经过嗜水气单胞菌处理后, 各免疫相关组织中SOCS3s可以被诱导表达升高, 然后几乎降低到正常水平。本研究将为后续草鱼SOCS3s基因的功能研究提供相关参考依据, 为参与调节细胞因子信号传递和硬骨鱼的细菌防御的SOCS3s机制的研究提供新的线索。

