HIT 2000 方案治疗3 岁以下儿童髓母细胞瘤疗效分析
武万水 刘晶晶 孙艳玲 杜淑旭 李春德 李 苗 龚小军 任思其 张 金 孙黎明
1.首都医科大学附属北京世纪坛医院儿科(北京 100038);2.首都医科大学附属北京天坛医院小儿神经外科(北京 100050)
髓母细胞瘤(medulloblastoma,MB)是一种胚胎性肿瘤,也是最常见的儿童神经系统恶性肿瘤,约占儿童脑肿瘤的20%,其中<3岁儿童的MB约占总数的25%~35%,<5岁儿童MB约占50%[1-2]。术后放疗是目前公认的治疗MB有效方法[3]。但由于儿童发育的特殊性,特别是<3岁儿童,常因放疗而引起相关认知功能障碍,以及内分泌、生长发育异常等远期不良反应[4]。因此对于<3岁MB患儿通常以化疗为主,采取延迟放疗或者减量放疗的方法[5]。本文回顾分析北京世纪坛医院<3岁MB患儿的临床资料。
1 对象与方法
1.1 研究对象
对2012 年5 月至2018 年1 月北京世纪坛医院儿科收治的38 例<3岁MB患儿进行回顾性分析。研究对象入选标准:①手术年龄<3岁,并且手术后一直在北京世纪坛医院治疗;②经手术切除后病理确诊为MB,并分型;③规律进行化疗,并定期复查随访;④家属同意接受该调查且签署知情同意书。研究对象排除标准:①病理分型不明或者包含两种及以上病理类型者;②未规律进行化疗或转外院治疗;③入院前已在外院进行过治疗;④来我院前已出现肿瘤复发;⑤无法定期追踪其治疗方式及影像学表现;⑥患儿家属拒绝接受调查。
1.2 方法
1.2.1 临床资料收集 通过采集病史及电话随访收集患儿性别、年龄、R分期、病理分型、分子分型、M分期、是否放疗等临床资料。
1.2.2 肿瘤分期 以国际上常用的后颅窝MB 分期系统[6]进行分期:M0期指无肿瘤转移者,M1期为仅脑脊液中有肿瘤细胞,M 2 期为仅脑部核磁共振成像(MRI)发现肿瘤转移灶,M3期为脊髓MRI发现肿瘤转移灶,M4期为神经系统外发现肿瘤转移灶。M1~4期常统称为M+期。根据肿瘤是否有残留分为R0、R+期,R0指术后无残留者,而R+指术后有残留,即肿瘤残留≥ 1.5 cm2。
1.2.3 肿瘤分型 根据WHO 2007病理分类标准,分为经典型(classic medulloblastoma,CMB)、促纤维增生/结节型(desmoplastic nodular medulloblastoma,DMB)、广泛结节型(MB with extensive nodularity,MBEN)、大细胞/ 间变型(large cell/anaplasticmedulloblastoma,LC/A)[7]。由于部分患儿的病理结果未详细说明为DMB还是MBEN,故将这二者合并至DMB/MBEN。根据基因检测结果,MB分子分型分为:WNT(Wingless)、SHH(Sonic hedgehog)、G3(Group3)、G4(Group4)四型[8]。
1.2.4 治疗方法 患儿入院前均经手术切除肿瘤,手术后3~4 周开始化疗。根据HIT 2000 方案,<3 岁患儿均先给予全身诱导化疗,方案为Ⅰ(环磷酰胺800 mg/m2×3d+长春新碱1.5 mg/m2)、Ⅱ(甲氨蝶呤5 g/m2×24 h +长春新碱1.5 mg/m2)、Ⅲ(甲氨蝶呤5 g/m2×24 h+长春新碱1.5 mg/m2)、Ⅳ(卡铂200 mg/m2×3 d +依托泊苷150mg/m2×3d ),每2个方案间隔2周,完成4个方案为1周期,每2 个周期之间间隔3 周,共3 个化疗周期。化疗结束后,根据患儿影像结果决定是否进一步放疗。
1.2.5 疗效评价及不良反应 治疗结束时检查脑脊液有无肿瘤细胞,1~2年内每3 个月复查全脑全脊髓MRI,每6 个月复查全脊髓MRI;第3~5年每6~9个月复查全脑全脊髓MRI,5 年以后每年复查全脑全脊髓MRI。评价方法按照 WHO 标准分为:①完全缓解(complete response,CR),肿瘤灶完全消失,脑脊液肿瘤细胞阴性;②部分缓解(partial response,PR),肿瘤灶减少≥ 50%,脑脊液肿瘤细胞阴性;③改善(improvement,IMP),肿瘤灶减少25%~50%,和/ 或脑脊液肿瘤细胞阴性;④稳定(stable disease,SD),瘤灶减少或增加< 25%;⑤进展(progressive disease,PD),瘤灶增加≥25%,和/或脑脊液肿瘤细胞阴性[10]。以临床表现及核磁征象进行评估。按照美国国家癌症研究所的不良事件通用术语记录患儿的不良反应。
1.2.6 随访 随访时间截止到2019年5月1日。随访内容包括患儿有无神经系统相关临床表现,每个化疗周期结束进行全脑全脊髓MRI检查评估疗效。无事件生存期(event-free survival,EFS)定义为从手术切除肿瘤时间开始,至患者出现肿瘤复发、播散或病变进展时间,这段时间的生存率称为无事件生存率;总体生存期(overall survival,OS)定义为从手术切除肿瘤开始至患者因肿瘤进展或其他原因出现死亡的时间,这段时间的生存率称为总体生存率。
1.3 统计学分析
采用SPSS 25.0 统计软件进行数据处理。非正态分布计量资料用中位数(范围)表示,计数资料采用例数和百分比表示。采用Kaplan-Meier法估计生存函数,采用Log-Rank 检验比较不同组之间生存函数差异。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
共38 例患儿符合标准纳入研究,男21 例(55%)、女17例(45%);年龄为1.9(0.6~3.0)岁。CMB 10例、DMB/MBEN 26例、LC/A 2例。肿瘤分期为M0期 24例、M+期14 例;R0 32 例、R+6 例;接受放疗13 例、未放疗25 例。共15 例行分子分型,SHH 13例、G4 2例。
2.2 生存分析
患儿中位随访时间3.7(1.2~7.0)年。随访截止时,CR 8例(21%)、PR 5例(13%)、SD 6例(16%)、PD 或复发19 例(50%)。38 例患儿5 年总体EFS 率、OS 率分别为(43.9±8.8)%和(49.5±9.1)%。见图1。M0组和M+组5 年EFS 率、OS 率差异均有统计学意义(P<0.05);DMB/MBEN组和CMB、LC/A组5年EFS 率、OS率差异均有统计学意义(P< 0.05);放疗组和未放疗组5 年EFS率、OS率差异均无统计学意义(P>0.05);R0组和R+组5 年EFS率、OS率差异均无统计学意义(P>0.05);SHH组和G4组3年EFS率、OS率差异均有统计学意义(P<0.05)。见表1。
2.3 不良反应
13 例患儿接受放疗,9 例出现骨髓抑制,均为Ⅰ~Ⅱ级骨髓抑制,没有患儿因出现严重骨髓抑制中断放疗;4 例出现呕吐、腹痛等消化道反应,2 例出现一过性淀粉酶增高,经对症处理后好转,无胰腺损伤证据;3 例放疗期间出现放疗相关皮疹。
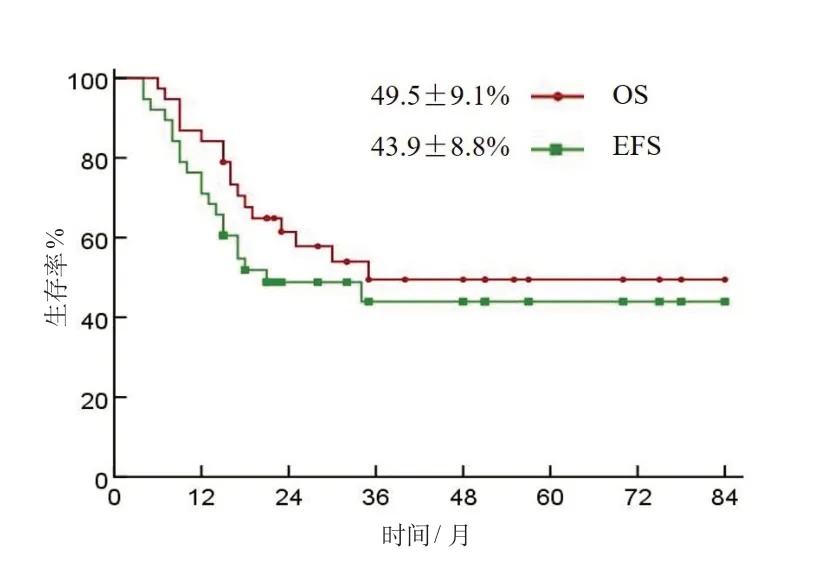
图1 患儿5 年总体EFS 率和OS 率
化疗期间38 例患者均出现不同程度的骨髓抑制,其中Ⅰ级骨髓抑制8 例,Ⅱ~Ⅲ级骨髓抑制20 例,Ⅳ级骨髓抑制10 例;粒细胞缺乏继发感染6 例,因严重骨髓抑制输血小板患儿5 例,因重度贫血输红细胞2例;肝功能损害3 例,口腔黏膜溃疡5 例。无放化疗相关性死亡。1 例患儿采用顺铂化疗期间出现听力下降,改用卡铂后损伤未进一步加重,截止到随访日期,听力损伤未有缓解。
3 讨论
MB为儿童最常见的脑恶性肿瘤,1~9岁儿童中每年的发病率略低于8/100000,男孩发病率高于女孩[11]。目前MB的治疗包括手术、放疗、化疗,随着手术方式的改进及手术技术的提高,目前我国MB 的5 年总体生存率为(78 ±6.5)%[12]。欧洲一项2000-2007 年的研究提示,MB的1 年、3 年、5 年OS分别为81%、63%和56%,婴儿的预后最差,5 年OS仅33%,1~4岁儿童为47%,5~7岁为67%[13]。可见年龄越小,肿瘤预后越差。因此,<3岁儿童MB的治疗更应该予以关注。MB是一类以苏木精-伊红染色呈小而圆的肿瘤细胞,自发现至今已经100余年[14],根据其病理特点,MB分为4 型:CMB、DMB、MBEN、LC/A。DMB和MBEN的病理均表现为明显的神经细胞分化且伴有小叶间结节形成,由于这种病理上的相似性,故许多临床研究将MBEN与DMB合并为同一种病理类型[15]。
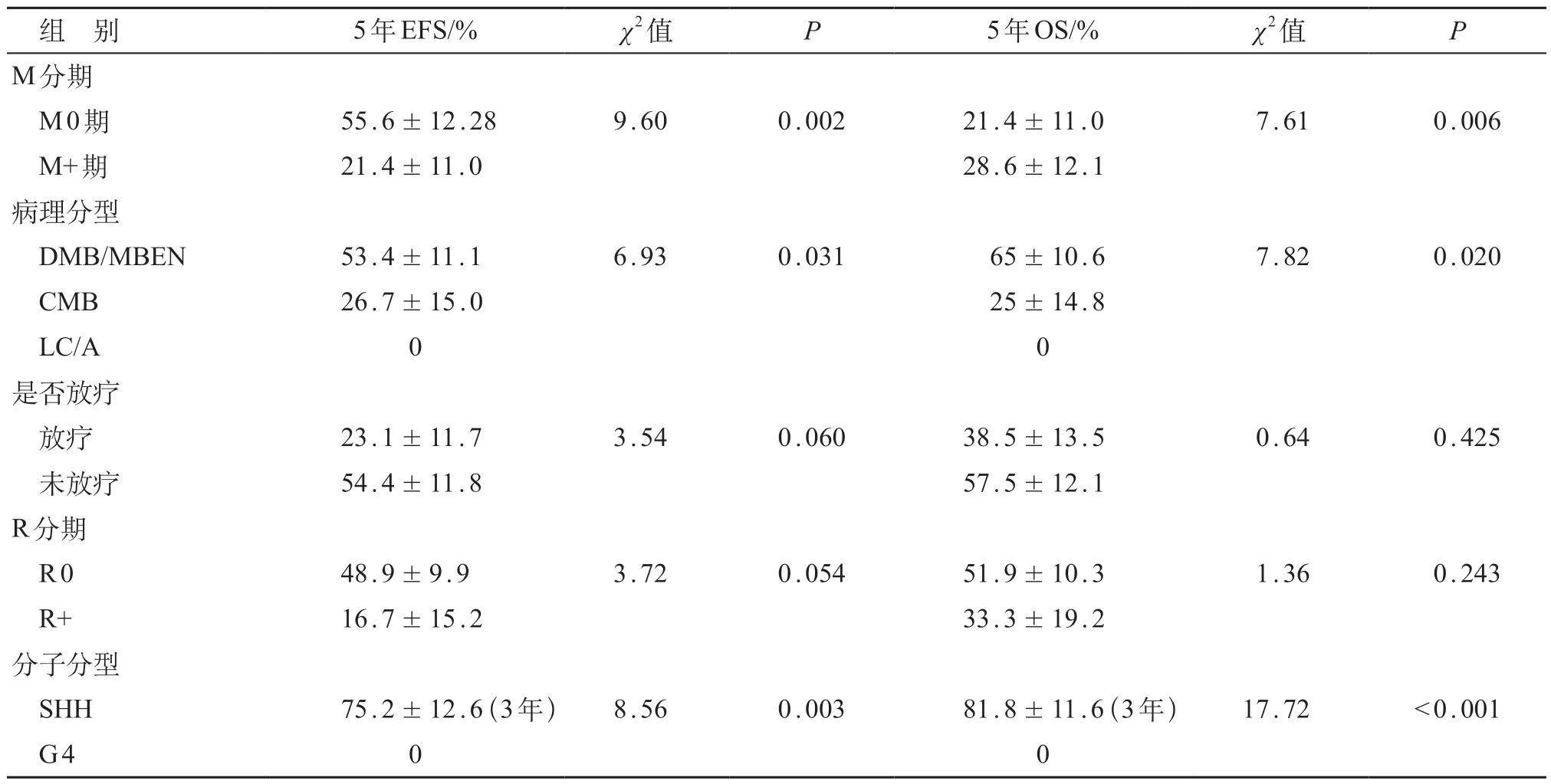
表1 不同分组之间EFS、OS比较
研究显示,6 岁以下MB 患儿采用大剂量化疗(CCG 99703[16]),其5 年EFS 和OS 分别为(69.6±6.9)%和(76.1±6.5)%,其中病理分类为DMB/MBEN 者,其5 年EFS 为(92.3±7.4)%,而非DMB/MBEN 组,其5 年EFS 仅(59.6±8.9)%,两组之间差异有统计学意义[17]。本组患儿中DMB/MBEN组5 年EFS(53.4±11.1)%,CMB、LC/A组的5 年EFS分别为(26.7±15)%和0%。与以上研究相比,DMB/MBEN组及非DMB/MBEN组5 年EFS 均较差,可能与化疗方案强度不同有关。上述研究采用的为强化化学疗法,需干细胞移植下支持治疗方能完成。另有研究对17 例5 岁以下MB患儿进行回顾性分析(中位随访时间37 个月)时发现,1 年、3 年EFS 分别为(93±8)%、(72±15)%,其1年、3年OS分别为100%、85%[18]。相关研究对5岁以下MB采用SJYC07方案治疗,5年EFS为31.3%,低于本组患儿[19]。根据MB分子分型,WNT、SHH、G3、G4四型中,SHH约占25%~30%,尤其多见于2岁以下儿童[18]。其中WNT分型预后最好,SHH 及G 4 次之,G 3 型预后最差。本组患儿中,SHH21 例,其中DMB/MBEN 17 例;SHH型预后明显较G4组好,与SHH多为DMB/MBEN,而G4均为CMB有关。
本组患儿中,分期为M+者较M 0 者预后差,差异有统计学意义。且多项研究均证明,M 分期为影响MB 预后的独立危险因素[5,16]。本组患儿中放疗组预后较非放疗组差,可能与DMB/MBEN 组患儿通常不放疗,仅化疗不敏感才联合放疗有关;但两组间差异并不显著,与放疗例数少有关。复发或转移是决定MB预后的重要因素,复发后1 年OS为(38.3±4.0)%,2 年OS为(16.9±3.3)%,5 年OS仅(12.4±2.8)%[20]。因此复发后治疗更显重要,适宜手术者可进行二次手术,少部分患儿选择二次放疗。复发后治疗仍以化疗为主,目前可选择靶向药物联合化疗,如贝伐珠单抗联合伊立替康、替莫唑胺等。
放疗和化疗近期最常见不良反应为骨髓抑制、胃肠道反应,经对症治疗后均可缓解。本组患儿中,1 例患儿使用顺铂化疗后出现听力下降,改用卡铂后听力损伤未进一步加重。顺铂的耳毒性通常表现为进展性,为不可逆的双侧由高频向低频逐渐受累的感觉神经耳聋,且常伴有眩晕。建议对年龄≤10 岁,单疗程顺铂最大用量≥ 100 mg/m2的实体瘤患儿可考虑减量或慎用[21]。截止到随访日期,17 例患儿存在不同程度的运动发育迟缓、共济失调等,但这部分患儿术后即有上述症状,考虑与肿瘤占位术后有关。
综上,本组<3 岁MB 患儿术后单用HIT 2000 方案化疗,DMB/MBEN单用化疗预后良好,HIT2000 方案治疗<3 岁MB 5 年OS 为(49.5±9.1)%,与相关研究的3 年OS(31.37 ±11.7)%[22]相比,预后较好,为国内<3 岁MB 的治疗提供了临床依据。随着研究深入,分子分型作为判断MB预后的因素越来越重要,在今后的研究中需进一步完善分子分型检查并延长随访时间。

