多糖-蛋白质酶促共聚物研究进展
吕丁阳,殷丽君,陈复生*
1. 河南工业大学粮油食品学院(郑州 450001);2. 中国农业大学食品科学与营养工程学院(北京 100083)
早在20世纪80年代,研究人员发现将蛋白质与多糖结合可以大大提高蛋白质溶解性、热稳定性和乳化性[1]。复合蛋白质-多糖产物可用于医疗和化妆用品的功能生物活性物质包封和递送、食品工业中脂肪、奶油及石油替代品等[2]。蛋白质-多糖复合物主要分为天然复合产物、静电复合产物、共价交联产物[3]。阿拉伯树胶是一种具有优良乳化特性的典型蛋白质-多糖天然复合物,但其供应有限、价格昂贵,限制其工业应用[4]。Bai等[5]证实由玉米纤维、小麦麸皮、甜菜甜渣中提取的玉米纤维胶、小麦麸皮阿拉伯木聚糖、甜菜果胶具有替代阿拉伯胶的能力。乳状液体系中的阿拉伯木聚糖-蛋白质之间静电相互作用需要严格的条件控制,如pH范围、离子强度及温度,且静电相互作用过强会导致沉淀或不可溶,相互作用过弱会引起乳状液絮凝进而导致乳状液失稳[6]。共价交联主要分为美拉德反应和酶促交联反应,美拉德反应需要在严格条件控制下进行,在产生目标碳水化合物-蛋白质缀合物过程中防止晚期黑素形成[7]。酶促交联反应条件温和、反应时间较短,且产物无较重颜色,可应用于饮料乳状液体系,因此,近年来成为研究热点。阿拉伯木聚糖与蛋白质的酶促交联反应通常通过过氧化物酶、转谷氨酰胺酶、漆酶等实现[8]。因此,对催化酶交联阿拉伯木聚糖-蛋白质复合物研究进展进行综述。
1 酶及其反应体系
1.1 过氧化物酶及其反应体系
过氧化物酶是一种血红素酶,其酶活性来源于结构中血红素基团的铁原子循环还原和氧化[9]。由于辣根过氧化物酶作用底物广泛,且较高温度下稳定性较好,常用作过氧化物酶类研究对象,其最佳作用底物常常含有酚羟基,且酚羟基邻位被羟基或甲氧基等给电子基团取代,另一邻位位置无取代基[10]。辣根过氧化物酶含有血红素和2个钙原子,血红素位于远端和近端区域之间,每个区域含有1个钙原子,钙原子通过氢键网络与血红素结合区连接。每个钙位点与由氨基酸侧链羧酸(Asp)、羟基(Ser、Thr)、骨架羰基和结构水分子(仅限远端位点)组合提供的供氧配体七配位[11]。当多糖中的阿魏酸与辣根过氧化物酶结合时,阿魏酸的芳香环处于接近血红素“裸露”边缘的一个末梢位点,其中侧链的苯甲酸基团朝向结合点,作用力包括疏水作用力和3个氢键[12]。蛋白质与辣根过氧化物酶结合时,过氧化物酶(HRP)作用于酪氨酸(Tyr)、苯丙氨酸(Phe)、色氨酸(Trp)、组氨酸(His)和半胱氨酸(Cys)。最佳作用底物氨基酸为酪氨酸,在最初的单电子氧化步骤之后,可以形成邻位二酪氨酸或异十三烷酸[13]。当过氧化物酶与α-乳白蛋白作用时,需要将α-乳白蛋白进行去除钙离子处理。Boeriu等[14]利用过氧化物酶处理水溶性小麦阿拉伯木聚糖和β-酪蛋白时,利用动力学控制反应,让过氧化物酶优先与β-酪蛋白混合,产生过量自由基,将阿拉伯木聚糖添加到混合物中,制得蛋白与多糖最优摩尔比10︰1的异源结合物,并通过尺寸排阻和阴离子交换色谱将蛋白质-阿拉伯木聚糖结合物与阿拉伯木聚糖均聚物分离,研究首次利用酶促方法大规模制备小麦阿拉伯木聚糖-蛋白质复合物。Boeriu[15]利用小麦阿拉伯木聚糖与α-乳白蛋白在过氧化物酶体系下进行酶促交联,通过表征蛋白质-阿拉伯木聚糖复合物,得出过氧化物酶可以催化阿拉伯木聚糖中的阿魏酰残基与α-乳白蛋白的酪氨酸残基交联,交联后的产物可作食品增稠剂。
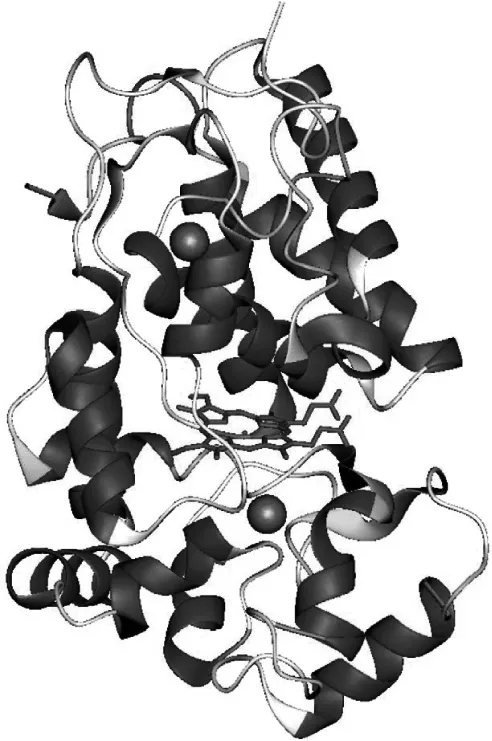
图1 辣根过氧化物酶X射线晶体结构[16]
1.2 转谷氨酰胺酶及其反应体系
转谷氨酰胺酶最初大多从动物组织和体液中提取,具有有害的红色素。为了扩展其在食品工业中的应用,研究人员从微生物菌落中大规模提取转谷氨酰胺酶,并将其应用在食品工业中[17]。微生物转谷氨酰胺酶是由331个氨基组成的分子量约38 000 Da的具有活性中心的单体蛋白质酰基转移酶。其结构为单核苷酸肽链,二级结构中α-螺旋占21%,β-片层占31%,三级结构为球形,整个分子为亲水性,并点缀着一些疏水基团,酶分子中无Ca2+结合位点,故其催化作用与Ca2+无关[18]。转谷氨酰胺酶能催化多肽或蛋白质谷氨酰胺酰残基(酰基供体)的γ-羧基酰胺基团与赖氨酸氨基(酰基受体)的ε-氨基之间的酰基转移反应[19]。而且微生物转谷氨酰胺酶热稳定性好,pH范围广(pH 4~9)。微生物转谷氨酰胺酶可催化交联多种蛋白质,其最佳作用底物为酪蛋白。由一些副产物如小麦麸皮、甜菜果胶中提取的阿拉伯木聚糖含有蛋白质组分,可以通过微生物转谷氨酰胺酶与外源蛋白质共价交联,Liu等[20]利用转谷氨酰胺酶交联酪蛋白酸钠和阿拉伯树胶,并通过多角度激光光散射与高效尺寸排阻色谱结合监测缀合程度,发现转谷氨酰胺酶可以通过其共价交联谷氨酰胺(Gln)和赖氨酸(Lys)残基进而改善各种蛋白质的功能特性,如酪蛋白酸钠、乳清蛋白和大豆分离蛋白。周小华等[21]以纯化微生物转谷氨酰胺酶催化壳聚糖和明胶合成壳聚糖-明胶共聚物。经红外光谱测试表明,共聚物在转谷氨酰胺酶催化下形成席夫共价键。转谷氨酰胺酶体系与漆酶体系和过氧化物酶体系不同,转谷氨酰胺酶只能实现蛋白质与多糖之间、蛋白质成分之间的交联,且蛋白质成分之间的交联不会消耗多糖的酚酸成分。唐传核等[22]研究并探讨微生物转谷氨酰胺酶催化2种异源蛋白质的聚合情形,表明表面疏水性相仿的蛋白质之间会发生聚合,影响蛋白质聚合的因素主要有蛋白空间结构位阻、蛋白质的表面疏水性质或空间结构。
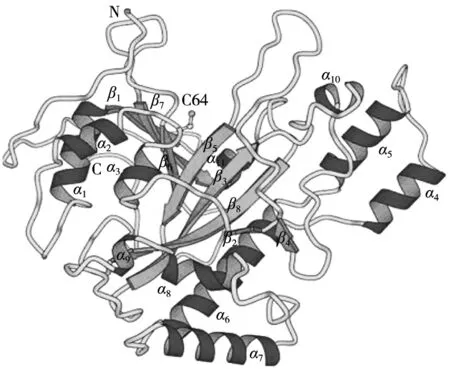
图2 转谷氨酰胺酶3D图像[23]
1.3 漆酶及其反应体系
漆酶是一种多酚氧化酶,存在于植物、真菌、细菌中,能氧化酚类和芳香族化合物,但不能氧化酪氨酸[24]。漆酶是单电子氧化还原酶,分子结构中含有4个Cu原子,分别是T1(1个Cu)、T2(1个Cu)、T3(2个Cu),漆酶可通过4个Cu原子协同传递电子和价态变化,催化底物氧化和还原,还原性底物在T1位点结合,T1Cu提取1个电子,该电子通过Cys-His途径传递到T2/T2三核中心,该位点结合第二底物分子氧并接受T1的电子传递给氧,使之还原为水[25]。在催化氧化酚类和芳香胺类化合物时,漆酶可以从被氧化的底物分子中提取1个电子,使之形成不稳定自由基,该自由基可进一步发生聚合反应或解聚反应,分子氧被还原为水。漆酶结合位点和序列变异性相对较大,导致真菌漆酶极度广泛的底物专一性[26]。漆酶作用底物虽然较广泛,但是β-乳球蛋白(BLG)被报道为漆酶作用的不良底物,因为其酪氨酸残基被掩埋在BLG的三维结构中,研究表明加热的BLG可以增强与SBP和BLG的异源结合。Jung等[27]利用漆酶交联热处理的β-乳球蛋白(H-BLG)与甜菜果胶(SBP),并通过使用尺寸排阻色谱、多角度激光散射、折射率和UV检测的峰位置确认SBP和H-BLG缀合。Figueroa-Espinoza等[28]利用漆酶交联小麦水溶性阿拉伯木聚糖与蛋白质,改善小麦水溶性阿拉伯木聚糖的凝胶特性。

图3 漆酶三维结构[29]
过氧化物酶与漆酶主要作用于多糖中的阿魏酸与蛋白质中的酪氨酸,使二者交联进而使多糖与蛋白质形成复合产物。转谷氨酰胺酶主要使多糖提取过程中沉淀的蛋白质与外源蛋白形成交联。过氧化物酶与转谷氨酰胺酶通常作用时间较短,漆酶作用时间较长。在过氧化氢、多糖存在条件下,过氧化物酶催化的蛋白质氧化交联反应的机理为:酚酸或者其他多元酚的二元酚在氧化物酶的作用氧化成邻醌,醌在副反应中形成二聚体,或与多肽的氨基或巯基侧链反应与酚环形成共价C—N或C—S键,并再次形成酚羟基结构,后者可以再次被氧化并结合从而形成交联化合物。所以在过氧化物酶体系或者漆酶体系中,多糖和蛋白质可以形成分子内结合物[30]。酶促交联阿拉伯木聚糖和蛋白质虽然具有特异性及反应条件温和等优点,但是在反应过程中也会形成多种复杂产物,如阿拉伯木聚糖同源交联、蛋白质同源交联。反应产物由目标基团与过氧化物酶的反应差异性及反应基团数量和目标基团可接近性决定。阿拉伯木聚糖中碳水化合物与蛋白质中氨基酸交联需要暴露彼此的靶基团且不具有或具有有限的空间位阻。
2 酶促产物表征技术
2.1 紫外可见光吸收光谱
紫外可见光吸收光谱是由于价电子的跃迁而产生的分子光谱,它利用物质的分子或离子对紫外和可见光的吸收所产生的紫外可见光谱及吸收程度对物质的组成、含量和结构进行分析、测定、推断[31]。对于过氧化物酶及漆酶反应体系,酶促反应主要发生在多糖中的阿魏酸与蛋白质中的酪氨酸中。通过对于反应物阿魏酸及酪氨酸的减少及生成物的增加可以间接判定酶促反应的发生。阿魏酸在290~310 nm处有良好的紫外吸收[32],郦金龙等[33]通过对甜菜果胶200~800 nm全波长扫描,检测出果胶在325 nm处有最大紫外吸收峰,而酪氨酸通常在280 nm处有良好的紫外吸收。可通过325 nm处及280 nm处吸光度的减少以证实多糖中的阿魏酸与蛋白质中的酪氨酸参与酶促交联反应。李君文等[34]在阿魏酸存在条件下利用过氧化物酶交联酪蛋白,利用A315nm/280nm的比值反映交联反应过程中酪蛋白、阿魏酸之间的相对变化关系。随着反应时间延长,A315nm/280nm比值减小,说明阿魏酸参与交联。
2.2 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)是以聚丙烯酰胺凝胶作为支持介质的一种常用电泳技术,常用于分离蛋白质和寡核苷酸。聚丙烯酰胺凝胶为网状结构,具有分子筛效应[35]。它有2种形式:非变性聚丙烯酰胺凝胶电泳和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳。在非变性聚丙烯酰胺凝胶电泳过程中,蛋白质能够保持完整状态,并依据蛋白质分子量大小、蛋白质形状及其所附带的电荷量而逐渐呈梯度分开[36]。SDS-PAGE根据蛋白质亚基分子量的不同分离蛋白质,SDS-PAGE仅与蛋白质的相对分子质量有关,而与其所带电荷和分子形状无关。SDSPAGE凝胶电泳通常被用在美拉德反应中糖蛋白产物鉴定,多糖及蛋白质之间发生交联时,反应产物能够在浓缩胶及分离胶的交界处出现染色条带,或者由于大的结合物分子量在分离胶中出现拖尾条带[37]。通常研究人员使用PAS(糖蛋白染色)对多糖中的糖物质进行检测。Schmidt等[38]利用SDS-PAGE凝胶电泳检测热处理的乳清分离蛋白-果胶混合物,发现经过热处理的乳清分离蛋白特征条件变浅,且凝胶注射点观察到强烈固定的条带,表明大分子量的富含蛋白质的物质被排除在侵入凝胶孔之外,而酶处理的多糖及蛋白对照组未出现,表明在乳清分离蛋白及果胶之间形成异源结合物。张伊宁[39]对于转谷氨酰胺酶修饰大豆分离蛋白产物进行SDS-PAGE凝胶电泳分析,与大豆分离蛋白相比,交联产物泳道的7 S和11 S等亚基部分条带明显减少甚至消失,且分离胶及浓缩胶上缘均有大分子条带出现。
2.3 傅里叶变换红外光谱
红外光谱分析(FTIR)是一种根据物质的光谱来鉴别物质及确定其化学组成、结构或者相对含量的方法。按照分析原理,光谱技术主要分为吸收光谱、发射光谱和散射光谱3种;按照被测位置的形态分类,光谱技术主要有原子光谱和分子光谱2种[40]。红外光谱属于分子光谱,有红外发射和红外吸收光谱2种,常用的为红外吸收光谱。红外吸收光谱是由分子振动和转动跃迁所引起的,组成化学键或官能团的原子处于不断振动(或转动)状态,其振动频率与红外光的振动频率相当。所以,用红外光照射分子时,分子中的化学键或官能团可发生振动吸收,不同化学键或官能团吸收频率不同,在红外光谱上将处于不同位置,从而可获得分子中含有何种化学键或官能团的信息[41]。Liu等[42]利用傅里叶红外扫描从分子水平上证明了玉米麸皮阿拉伯木聚糖与牛血清白蛋白之间的交联,牛血清白蛋白在1 650,1 545和1 387 cm-1处分别具有C=O伸缩(酰胺Ⅰ带),C=N伸缩(酰胺Ⅱ带)的N—H弯曲和C—N弯曲(酰胺Ⅲ带)。牛血清白蛋白与玉米麸皮阿拉伯木聚糖单纯混合时,混合物的红外光谱分析显示在1 545 cm-1处出现1个新谱带,表明两者之间可能存在氢键或静电相互作用。当牛血清白蛋白与玉米麸皮阿拉伯木聚糖在过氧化物酶的存在下混合时,混合物中的谱带移动到1 644 cm-1,并出现4个新峰,从而印证多糖与蛋白酶促交联。研究人员用高效液相色谱分析方法、微观结构等表征方法印证多糖与蛋白质酶促交联[43-44]。
3 多糖-蛋白质酶促复合物功能特性
通过酶促交联的多糖-蛋白质复合物通常具有多种功能性质,如乳化性、凝胶性、起泡性等,其中共价复合物的乳化性和凝胶性研究较多。翁静宜等[45]研究在大分子拥挤体系下转谷氨酰胺酶对7S-葡聚糖糖基化产物的凝胶性能影响,表明经过酶处理后的复合物凝胶具有更加均匀及致密的凝胶网络结构。有研究制备多糖蛋白相分离凝胶,其利用蛋白质与多糖的热力学不相容性,使半固体食品具有灵活的结构,酶促蛋白质-多糖凝胶具有良好的机械性能和咀嚼口感,具有很广阔的开发前景[46]。
蛋白质-多糖复合物在乳状液体系中时,共聚物会迁移到油水界面,在油水界面上形成界面膜,减少乳状液絮凝。乳状液中pH和离子强度决定了蛋白质/多糖相互作用的亲和力。Guerrero等[47]证明,在恒定的蛋白质浓度下,逐渐加入带相反电荷的多糖可以诱导蛋白质稳定的乳液依次经历4种不同的状态:稳定(几乎不含多糖)、不稳定(桥接絮凝)、稳定(多层形成)和不稳定(枯竭絮凝)。Sovilj等[48]阐明蛋白质与多糖赋予食品乳液的空间和静电稳定性机理,并解释水胶体空间稳定方面的作用。此外,乳化过程中添加单个蛋白质,多糖或其混合物的顺序至关重要,因为它控制界面处蛋白质/多糖的组织和结构,产生所谓的双层乳液或混合乳液[49]。张伊宁[39]利用转谷氨酰胺酶交联明胶和酪蛋白,交联后的产物具有优良的乳化特性和消化特性。李君文等[34]在阿魏酸存在条件下利用过氧化物酶交联酪蛋白,表明交联酪蛋白的乳化活性指数、乳化稳定性分别提高25.2%和7.0%。
4 结语与展望
通过酶促反应对蛋白质和多糖进行结合,可以改善两者的功能特性。蛋白质-多糖共价复合物对于控制生物活性物质在食品基质中的释放有很大潜力。对于酶促多糖-蛋白质复合物的研究,仍需要不断的完善和充实。应更加深入了解多糖与蛋白质的交联机制及其在乳状液、凝胶体系中的应用,使酶促共价复合物的工业化成为可能。

