双孢菇酪氨酸酶的提取纯化及其性质
闵玉涛,宋彦显*,马庆一
1. 郑州工程技术学院(郑州 450044);2. 郑州轻工业学院(郑州 450002)
双孢菇(Agaricus bisporus)是全球种植范围最广、产量最大的一种食用菌,中国各地均有种植,是中国出口量最大的蘑菇[1]。双孢菇营养丰富,含有8种人体必需氨基酸、维生素、蛋白质、核苷酸等物质[2-3],具有抗氧化、抗衰老、抑菌、降血糖、预防肥胖、消炎、抗癌等保健作用[4-7],口味鲜美,深受消费者喜爱,市场空间较大。双孢菇成熟后,水分在90%以上,多酚物质含量多,质地鲜嫩,生理代谢旺盛,在贮运、售卖过程中易褐变,若受机械损伤,褐变加剧,致保鲜期非常短[8]。因此,双孢菇的采后保鲜一直是研究的热点之一[9-12]。
酪氨酸酶(TYR)又称儿茶酚氧化酶、多酚氧化酶等[13],以酚类及其衍生物、羧酸及其衍生物等为底物[14],是双孢菇酶促褐变的关键酶。双孢菇中酪氨酸酶可以催化酪氨酸等底物形成二羟苯丙氨酸(多巴),多巴是一种辅助底物,被酪氨酸酶催化形成多巴醌,转化形成黑色素,从而导致褐变。因此,一切可降低或抑制双孢菇酪氨酸酶的条件均可减少黑色素的形成,防止双孢菇酶促褐变。
试验采用丙酮沉淀,硫酸铵盐溶盐析和透析、反渗透相结合的方法提取双孢菇中的酪氨酸酶并部分纯化,研究酶学性质,为双孢菇采后保鲜、防止褐变、延长货架期提供依据,同时为美白和乌发化妆品的开发提供参考。
1 材料与方法
1.1 材料与试剂
双孢菇(郑州毛庄菜市场)。丙酮(AR级,安徽宿州化学试剂厂);硫酸铵(AR级,新乡市化学试剂厂);氟化钠(AR级,莱阳化工实验厂);磷酸氢二钠(AR级,北京红星化工厂);磷酸二氢钾(AR级,莱阳化工实验厂)。
1.2 仪器与设备
紫外分光光度计(SP-2102 PC型,上海光谱仪器有限公司);三用紫外分析仪ZF-C型(上海康禾光电仪器有限公司);高速台式离心机(TGL-18 C型,上海安亨科学仪器厂);离心沉淀器(80-1型,上海手术器械厂);组织匀浆机(JJ-2型,金坛市亿通电子有限公司);高速冷冻离心机(GL型,湖南仪器仪表总厂离心机厂)。
1.3 试验方法
1.3.1 酪氨酸酶的提取与纯化
双孢菇清洗,去水,切块,按照1︰1比例加入pH 6.8磷酸缓冲液,组织匀浆至浆状,4 ℃,5 000 r/min离心15 min,弃沉淀,上清液即为粗酪氨酸酶液。粗酶液加等体积丙酮沉淀,同上述条件离心,弃上清,加10%饱和(NH4)2SO4溶解沉淀,同条件离心,上清液即为初步纯化酪氨酸酶液。将初步纯化酪氨酸酶液调整(NH4)2SO4饱和度至60%,静止沉淀,同条件离心,用pH 6.8的磷酸缓冲液溶解沉淀,半透膜透析、反渗透,制备酪氨酸酶液。分别测定粗酶液、初步纯化酶液、纯化后酶液酶活力和蛋白含量。
1.3.2 酪氨酸酶活力的测定
参照马庆一等[15]的方法,于波长317 nm处比色法测定酶活力。反应体系为2.5 mL含1 mmol/L L-酪氨酸的pH 6.8磷酸盐缓冲液,于室温(20 ℃左右)中加入0.02 mL纯化后酶液,迅速混匀,使用紫外可见分光光度计,于波长317 nm处比色。酶液加入后开始计时,每30 s记录1次吸光度随时间的变化值,以最初的直线部分计算反应速率。定义吸光度每分钟增加0.001为1个酶活力单位。
1.3.3 酪氨酸酶性质的研究
1) 底物浓度与酶活性的影响
测定不同底物浓度下反应速度随时间的变化。分别取2.0,1.5,1.0,0.8,0.5和0.1 mL含2 mmol/L L-酪氨酸(底物)的pH 6.8磷酸盐缓冲液,加pH 6.8的磷酸缓冲液使总体积均为4 mL,加入0.02 mL酪氨酸酶液,按1.3.2小节在317 nm比色测定酶活力。
2) pH对酶活性的影响
分别取4 mL pH 3~8.5 10种pH的磷酸盐缓冲液(含1 mmol/L L-酪氨酸),25 ℃保温10 min后,立即加入0.02 mL酪氨酸酶液,按1.3.2小节在317 nm比色测定酪氨酸酶的活性。
3) 温度对酶活性的影响
反应体系为4 mL含1 mmol/L L-酪氨酸的pH 6.8磷酸盐缓冲液,在5~60 ℃不同温度的水浴中保温10 min后,立即加入0.02 mL纯化后酶液,混匀后按1.3.2小节在317 nm测定酪氨酸酶活性。
4) 异VC钠对酶活性的影响
以4 mL含1 mmol/L L-酪氨酸的pH 6.8磷酸盐缓冲液为底物,分别测定无抑制剂、加入0.01%异VC钠时酶反应速度随时间的变化,绘制酶反应速度曲线,比较抑制剂对酶活性的影响。
2 结果与讨论
2.1 酪氨酸酶的提取
缓冲溶液粗提应在0~4 ℃下进行,以防止酪氨酸酶失活,缓冲溶液中加入0.1 mol/L NaF,以抑制提取过程中酶促反应的进行,防止褐变的发生,避免酶失活。采用丙酮沉淀酪氨酸酶,整个操作过程控制在0~4 ℃下进行。
2.2 酪氨酸酶的比活力及纯化倍数的测定
粗酶、初步纯化酶液和纯化后酪氨酸酶的酶活力、蛋白含量、比活力和纯化倍数如表1所示。
结果表明,在提纯过程中,第一步经过丙酮沉淀和硫酸铵盐溶,酶活提高5倍,而蛋白质含量却下降近1/2。第二步经过60%饱和硫酸铵盐析,在蛋白质含量没有明显提高情况下,酶活提高近70倍,比酶活提高500余倍,说明经过丙酮沉淀和硫酸铵盐溶,去除部分杂蛋白。试验中盐溶用10%饱和硫酸铵溶液,盐析中硫酸铵用量60%的饱和度,结果证明这样可有效去除杂蛋白,纯化效果明显。
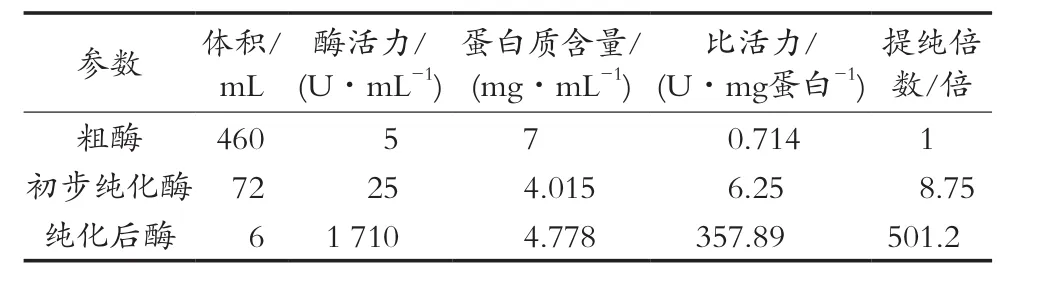
表1 酪氨酸酶纯化过程中的酶活力、蛋白含量、比活力和纯化倍数
2.3 酪氨酸酶的性质
2.3.1 底物浓度与酶活性的关系
根据酶活随底物浓度的变化值,绘制出不同底物浓度酶反应速度曲线,结果如图1所示。
结果表明,底物与酶活呈典型的矩形双曲线,当底物浓度小于0.4 mmol/L时,为一级反应,反应速率和底物浓度呈正比;当底物浓度大于0.804 mmol/L时,反应速率趋近最大反应速率,接近零级反应,反应速率不再随着底物浓度增加而增加。反应动力学符合米氏动力学方程。
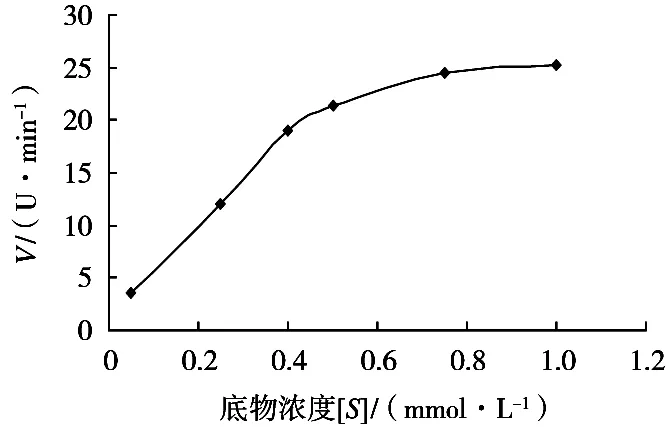
图1 底物浓度与酶活的关系
2.3.2 酶促反应动力学方程
采用双倒数作图法,以1/[s]为横坐标,以1/V纵坐标作图,结果如图2所示。
由图2得出的线性方程y=0.013 1x+0.024 1可知,直线在y轴上的截距为1/Vmax=0.024 1,则Vmax=41.5 U/min,在x轴上的截距为-1/Km=-1.840,则Km=0.543 mmol/L。
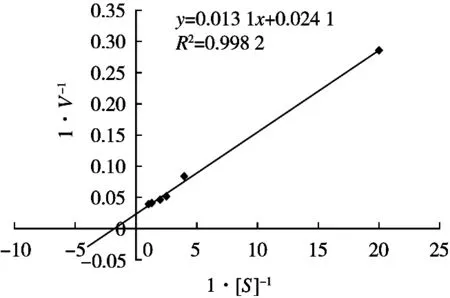
图2 作图法求Vmax和Km
2.3.3 pH对酶活力的影响
在不同pH条件下,在317 nm处吸光度随时间变化结果,以pH为横坐标,不同pH时的酶活为纵坐标作图,结果见图3。
酪氨酸酶的最适pH为6.5,其在pH 6.5附近保持较高的活性,在pH 6.5以下酶活力与pH呈正相关关系;在pH 6.5时达到最大值;大于pH 6.5时,酶活力与pH呈负相关关系。

图3 pH对酶活的影响
2.3.4 温度与酶活的关系
不同温度时,在317 nm处吸光度随时间变化结果,以温度为横坐标,不同温度时的酶活为纵坐标作图,结果见图4。
酪氨酸酶最适温度为30 ℃,其在30 ℃左右保持较高酶活力,温度对酶活的影响呈“钟罩形”曲线。
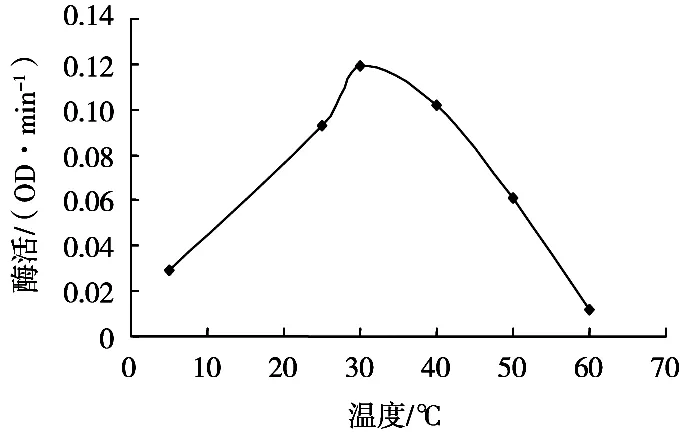
图4 温度对酶活的影响
2.3.5 异VC对酶活性的影响
异VC及对照在317 nm处吸光度随时间变化结果,以时间为横坐标,不同时间的吸光度为纵坐标作图,结果见图5。
异VC钠是常用抗褐变剂,它能有效地抑制酪氨酸酶活性,使反应速度减慢,是酪氨酸酶的抑制剂之一。

图5 抑制剂对酶活的影响
3 结论
经过丙酮沉淀和硫酸铵盐溶、盐析、透析和反渗透等方法提取纯化后,酶活力为1 710 U/mL,比活力为357.89 U/mg蛋白,纯化倍数为501.2。L-酪氨酸为底物,双孢菇中酪氨酸酶的Km=0.543 mmol/L,Vmax=41.5 U/min。在pH 5~7之间酶活较高,最适pH为6.5;最适反应温度为30 ℃,异VC能有效抑制酪氨酸酶活性,反应速度与酶量、底物浓度关系均符合酶促反应动力学。

