响应面法优化低共熔溶液提取儿茶素工艺及组分分析
阮怿航,吴亮宇,鲁静,黄秀红,刘丽辰,林金科, *
1. 福建农林大学园艺学院(福州 350002);2. 福建农林大学安溪茶学院(泉州 362000)
铁观音原产于福建安溪,属于乌龙茶类,既有绿茶的清香又有红茶的醇厚,深受消费者的喜爱[1]。儿茶素作为铁观音乌龙茶中多酚类的主要成分,包含儿茶素(C)、表儿茶素(EC)、没食子儿茶素(GC)、表没食子儿茶素(EGC)、表没食子儿茶素没食子酸酯(EGCG)、没食子儿茶素没食子酸酯(CGC)、表儿茶素没食子酸酯(ECG)7种组成成分[1]。儿茶素具有抗肿瘤、抗氧化、抗辐射、降脂等[2-5]多种保健功效。目前,儿茶素主要的提取方法有离子沉淀-大孔树脂吸附分离法[6]、微波辅助浸提法[7]、超声波辅助浸提法[8]、超临界CO2萃取法等[9]。这些方法中,有的方法提取率较低,有的方法耗能大、成本高,无法投入大规模生产[10]。因此,探索一种绿色环保高效的儿茶素提取方法对茶产业具有深远的意义。
低共熔溶剂,又称低共熔离子液体,是指利用有机化合物和离子型化合物通过氢键结合形成的体系。这种溶剂无毒性,可生物降解,是一种新型的绿色溶剂[11];其具有制备过程简单,原料易得,相对较低的蒸汽压,化学性质稳定,表面张力小,扩散系数较大,室温下为液体且电导率高等优点[12]。根据文献报道,低共熔溶液在提取类黄酮物质[13]、橘皮多酚[14]、螺旋藻多糖[15]、黄酮物质[16]等方面有着深入的研究,但在茶叶内含活性成分的提取领域国内未见报道。故此次试验通过对比不同体系的低共熔溶剂和传统水提取方法的提取率,筛选适合的儿茶素提取体系,通过单因素试验和响应面法,优化儿茶素提取条件,为提高儿茶素工业提取效率提供可靠的理论依据。
1 材料与方法
1.1 材料与试剂
铁观音成品茶,惜缘茶叶有限公司;乳酸、柠檬酸、果糖,国药集团;苹果酸、氯化胆碱、甜菜碱、没食子酸,麦克林公司;以上药品均为分析纯。乙腈(色谱纯),德国Merck公司;冰醋酸(AR);抗坏血酸(AR);甲醇(色谱纯),美国Sigma-Aldrich公司。
1.2 仪器与设备
712N可见分光光度计(上海精密科学仪器厂);5424R高速离心机(德国制造);HH-6恒温水浴锅(国华电器公司);SY-2230恒温水域摇床(美国精骐公司);超纯水机(成都艾柯公司);高速多功能粉碎机(永康市铂欧五金制品有限公司);高效液相色谱仪(美国Waters公司)。
1.3 样品预处理
将铁观音成品茶叶粉碎后过60筛,密封备用。
1.4 试验方法
1.4.1 不同体系的低共熔溶液制备
采用水浴加热搅拌的方法制备低共熔溶剂,将氯化胆碱/果糖、氯化胆碱/乳酸、甜菜碱/苹果酸、甜菜碱/柠檬酸、甜菜碱/乳酸5种双组分按摩尔比1︰2各放入烧杯中,在85 ℃水浴中搅拌为均一的液体,60~80 min。
1.4.2 儿茶素的提取工艺流程
准确称取2.000 0 g(±0.000 5 g)铁观音茶粉于50 mL离心管中,各加入30%含水率的5种自制低共熔溶液,混均放入恒温水浴摇床中。提取条件为时间60 min、固液比1︰20 g/mL、温度60 ℃、转速100 r/min。提取后趁热抽滤,滤液于4 ℃保藏待测。
1.4.3 HPLC分析
1.4.3.1 待测液制备
将25 mL EDTA(10 mg·mL-1)+0.2 g抗坏血酸+50 mL乙腈至500容量瓶,用水定容至刻度,制得稳定溶液;儿茶素提取液用稳定溶液稀释10倍后过0.45 μm膜,制成待测液。
1.4.3.2 HPLC条件
采用Waters Acquity UPLC HSS T3色谱柱(2.1 mm×100 mm,RP 181.7 μm),Acquity UPLC柱在线过滤器,以色谱图中峰不出现拖尾、基线不漂移和分离度为依据对流动相体系和梯度洗脱设计、分析参数进行评定。流动相条件:A相为9.5%乙腈+0.02%EDTA-2Na+2%冰醋酸,流动相B为80%乙腈+0.02%EDTA-2Na+2%冰醋酸。柱温箱温度35 ℃。PDA检测条件:扫描范围200~400 nm,特征检测波长278 nm,扫描时间9 min,进样量2 μL。
1.4.4 儿茶素提取的单因素试验
低共熔溶液的制备和铁观音茶汤的提取参照1.4.1和1.4.2,考察不同因素对儿茶素提取的影响。设置的单因素分别是:时间(40,60,80,100和120 min)、温度(40,50,60,70和80 ℃)、固液比(1︰20,1︰30,1︰40和1︰50 g/mL)、低共熔溶液含水率(10%,20%,30%,40%和50%)、低共熔溶剂中氢键受体(HBA)与供体(HBD)的摩尔比(1︰1,1︰2,1︰3,2︰1和3︰1)。
1.4.5 响应面优化茶多酚提取试验
在单因素试验的基础上,选取连续变量时间(A,min)、温度(B,℃)、低共熔溶液的含水率(C,%)为自变量,儿茶素的提取率(Y,%)为响应值,根据Box-Behnken中心组合试验原理,设计三因素三水平响应面分析试验。试验各因素水平设定参见表1。

表1 Box-behnken试验因素水平及编码水平表
1.5 数据处理
所有试验均进行3次重复,采用Excel 2007,SPSS 17.0,Graphpad及Design-Expert 10.0.7进行分析处理。
2 结果与分析
2.1 低共熔溶剂体系筛选试验
由图1可知,低共熔溶剂的儿茶素提取率高于超纯水;其中乳酸与甜菜碱组成的低共熔溶液体系儿茶素提取率最高,为14.56%,相比于传统水提取的方法提高了148.70%。因此选择乳酸和甜菜碱体系作为低共熔溶剂体系。

图1 不同低共熔溶剂体系对儿茶素提取率的影响
2.2 儿茶素提取的单因素试验
2.2.1 提取时间对儿茶素提取率的影响
由图2可知,儿茶素的提取率在20~40 min时提取率呈现上升趋势;在40 min之后提取率逐步下降;40 min时提取率达到最大,为11.53%。综合考虑提取成本和效率,确认最佳提取时间为40 min。

图2 不同提取时间对儿茶素提取率的影响
2.2.2 温度对儿茶素提取率的影响
由图3可知,当温度低于60 ℃时,提取率随着温度的增加而呈现上升趋势;当温度为60 ℃时提取率达到最大,为11.43%;进一步增加温度,提取率呈现下降趋势。因此,选择温度60 ℃为最佳提取条件。
2.2.3 低共熔溶剂组成摩尔比对儿茶素提取率的影响
由图4可知,当氢键供体(HBD)和氢键受体(HBA)的摩尔比为2︰1时,提取率最佳,为12.26%;当摩尔比为3︰1时,提取率最低,为10.82%。因此,选取低共熔溶剂组成摩尔比2︰1为最佳摩尔比条件。
2.2.4 低共熔溶液含水率对儿茶素提取率的影响
由图5可知,当溶液的含水率为10%~30%时,儿茶素的提取率随着含水率提高而逐渐增加;当含水率为30%时,提取率达到最大,为13.31%,当含水率大于30%时,提取率下降。因此,选择30%含水率为儿茶素提取的最佳低共熔溶液条件。

图3 不同提取温度对儿茶素提取率的影响

图4 不同低共熔组分摩尔比对儿茶素提取率的影响

图5 不同低共熔溶液含水率对儿茶素提取率的影响
2.2.5 固液比对儿茶素提取率的影响由图6可知,当固液比为1︰10~1︰40 g/mL时,提取率随着固液比的增加而增加;当固液比为1︰40 g/mL时,提取率达到最大,为10.85%;当固液比大于1︰40 g/mL时,提取率有所下降。综上所述,选取1︰40 g/mL作为低共熔溶剂提取儿茶素的最优固液比。
2.3 儿茶素提取工艺优化
2.3.1 响应面试验方案及结果分析
根据单因素试验结果,选取提取时间(A)、提取温度(B)、低共熔溶液含水率(C)为自变量,以儿茶素的提取率Y为因变量,根据Box-Behnken中心组合设计原理进行响应面试验,试验方案和结果见表2。
利用Design-Expert 10.0.7软件中的Box-Behnken模型对表3中的数据进行多元拟合分析,从而获得儿茶素提取率(Y)对自变量提取时间(A)、提取温度(B)、低共熔溶液含水率(C)的二次项多元统计分析,建立的二元回归方程为:Y=14.99+0.066A+0.051B+0.067C-0.42AB-0.22AC-0.12BC-0.92A2-0.48B2-0.28C2。
由表3可知,模型p<0.000 1,失拟项的p>0.05,说明模型的预测值和试验数据具有高度的吻合度;相关系数R2=0.984 5,说明回归方程能够很好地模拟实际曲面;调整系数R2=0.964 6,说明有96.46%的响应值变化可以通过该模型来解释,表明此方程能够充分反映儿茶素提取率与各个提取工艺参数之间的关系。
模型的响应曲面图见图7。等高线的形状能表示两个因素之间的相互作用情况;若等高线呈现椭圆形,则两个因素之间存在显著的交互作用;若等高线呈现圆形,则无显著性[17]。由图7(f)可知,提取时间和提取温度对儿茶素的提取率的交互作用没有显著性;由图7(b)(d)可知,含水率和提取时间、含水率和提取温度对儿茶素的提取率具有显著的交互影响作用。由图7(a)(c)(e)可知,当提取温度、提取时间、含水率增加时,响应值呈现出先增加后减少的趋势。这与单因素试验的结果相吻合。
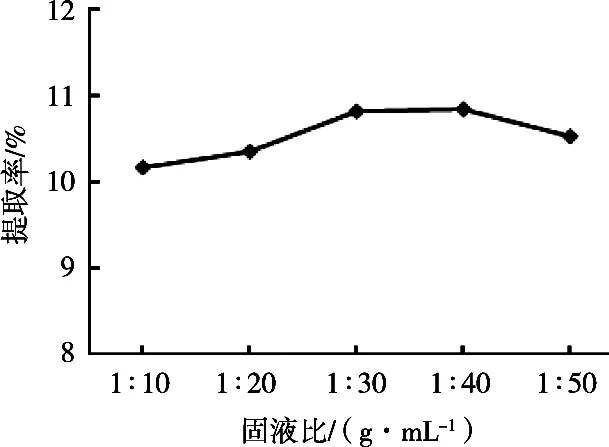
图6 不同固液比对儿茶素提取率的影响

表2 响应面方案及结果
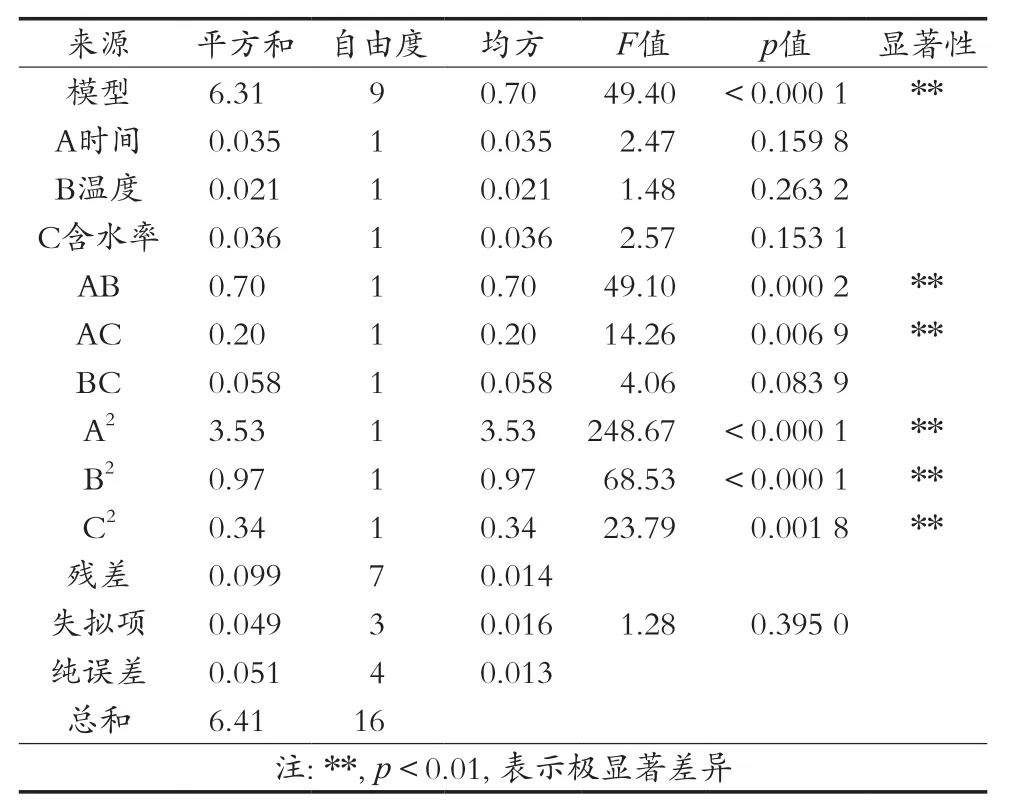
表3 回归统计分析

图7 各因素影响儿茶素提取率的响应面图
2.3.2 儿茶素提取的最佳条件确定及验证
在响应面试验设计的因素范围内,按照回归模型利用Design-Expert 10.0.7软件分析得出的儿茶素提取最佳条件是:提取时间40.31 min,提取温度60.33℃,低共熔溶液含水率31.68%,模型预测茶多酚提取率为15.00%。最后确定的儿茶素的提取条件为:提取时间40 min,提取温度60 ℃,低共熔溶剂含水率32%。为证实预测结果,采用最后确定的提取条件进行3次重复验证试验,得到实际儿茶素提取率(15.22%),与模型预测相差0.22%,由此可见应用响应面优化法确定的儿茶素提取条件具有实际应用价值。
2.4 儿茶素组分含量分析
通过HPLC对优化后的提取液进行组成成分分析,结果如图8所示。含量最高的组分是EGCG,达到1.68 mg/mL;含量最低的是CG,仅有0.009 8 mg/mL。由图8可知,儿茶素中的主要成分为EGCG和EGC,两者合计占总量的69.20%;EC、C、GCG为次要成分,合计占儿茶素总量的29.57%。由此可见,发挥儿茶素主要保健功能的成分很可能是EGC、EGCG这两种物质。

图8 儿茶素各组分及其含量
3 结论
通过对低共熔溶剂体系的筛选,得到最佳低共熔溶液体系,为乳酸-甜菜碱;在单因素试验的基础上应用Box-Behnken试验设计及响应面分析法对此工艺进行优化分析,得出的优化提取工艺条件为:提取时间40 min,提取温度60 ℃,低共熔溶剂含水率32%、固液比1∶40 g/mL、低共熔溶剂组分摩尔比2∶1。此时通过模型计算得出的提取率为15.00%,验证试验的提取率为15.22%,试验与模型得到的提取率高度吻合,表明模型准确、可靠,具有实际参考意义。对儿茶素提取物进行HPLC组分分析,结果显示儿茶素中的主要成是EGCG和EGC,占总量的69.20%。由此可见采用低共熔溶液可以有效提高茶叶中儿茶素的提取效率;通过HPLC分析儿茶素主要成分可知,发挥儿茶素保健功效的主要成分可能是EGC、EGCG这两种成分。因此可以在今后探索如何从低共熔溶液提取的儿茶素中分离出EGC、EGCG,从而发挥儿茶素类物质在食品、保健品等领域巨大的潜在市场价值和应用前景。

