鲣鱼蛋白肽谱效关系研究
任娇艳 李宇娟 张 婷 梁 明 袁尔东*
(1 华南理工大学食品科学与工程学院 广州510641 2 中新国际联合研究机构 广州510000 3 无限极(中国)有限公司 广州510665)
鲣鱼,属于深海洄游鱼类,鱼肉蛋白质丰富,血脂含量低,氨基酸组成比例与人体肌肉蛋白相近,吸收利用度高,且鲣鱼蛋白酶解物具有显著的降尿酸活性和抗氧化活性[1-3]。研究表明,从鲣鱼鱼肉中鉴定合成的多肽DLDLRKDLYAN 具有显著的氧自由基和ABTS 自由基清除能力[4]。据日本YSK 公司报道,从鲣鱼蛋白中提取出两种天然低聚肽--鹅肌肽和肌肽,发现其具有显著降低高尿酸血症小鼠血清尿酸水平的功效。与大分子蛋白质和游离氨基酸相比,鲣鱼蛋白酶解所得小分子多肽更容易被人体吸收利用[5]。酶解法制备多肽,生产条件温和,易控制,产品安全性高,是工业制备活性多肽的常用方法。蛋白质和多肽对温度敏感,且均为两亲性物质,其存在形式容易受溶液酸、碱度和温度的影响。此外,酶活性和加酶量的变化易使酶解物中多肽链的结构及氨基酸组成发生变化,进而导致多肽化学图谱和化学活性的改变。酶解多肽的活性必需通过体外化学反应才能检测到,操作繁琐,无法在工业生产中实时监测酶解产物的活性变化。研究多肽化学活性与其分子质量图谱、总氨基酸含量图谱和质谱间的相关性,对于明晰鲣鱼蛋白活性肽“工艺-结构表征-生物活性”三者间的关系具有重要的意义。
本试验在不同酶解工艺条件下制备鲣鱼蛋白肽差异样品,研究其蛋白质回收率、分子质量分布、总氨基酸含量与降尿酸活性、抗氧化活性之间的谱效关系;对鲣鱼蛋白肽进行分离纯化和质谱鉴定,探讨鲣鱼蛋白肽纯化组分的降尿酸活性、抗氧化活性与质谱分析图谱间的相关性,旨在为活性肽工业化制备过程中的质控提供重要理论依据。
1 材料与方法
1.1 材料与试剂
鲣鱼,购自山东;黄嘌呤、黄嘌呤氧化酶、细胞色素C(12 384 u)、抑肽酶(6 511 u)、氧化型谷胱甘肽(651 u)、Gly-Gly-Gly(189 u),购自sigma 公司;Trolox、Fluorescein、AAPH、氯化硝基四氮唑蓝(NBT),购自阿拉丁试剂公司;木瓜蛋白酶,购自南宁庞博生物工程有限公司。
1.2 主要仪器、设备
KDN-1 型自动凯氏定氮仪,上海科晓科学仪器有限公司;Synergy H1 全功能微孔板检测酶标仪,美国伯腾仪器有限公司;A300 全自动氨基酸分析仪,德国曼默博尔公司;Akta 蛋白纯化仪,美国通用电气公司;高分辨高效液相质谱联用分析仪,德国布鲁克公司。
1.3 试验方法
1.3.1 鲣鱼蛋白肽样品制备 将鲣鱼鱼糜与蒸馏水按料液质量比1∶3 搅拌均匀,煮沸10 min 预处理灭酶,以鲣鱼蛋白肽的蛋白质回收率为指标,制备得到不同单因素条件下的差异样品:
1)不同pH 条件 制备3 个pH (6.0,6.5,7.0)条件下, 加酶量(E/S)为1%木瓜蛋白酶,酶解温度55 ℃酶解4 h 后,煮沸10 min 灭酶,于4 ℃,8 000 r/min 离心20 min 后过滤浓缩,-20 ℃冷藏备用。
2)不同温度条件 根据蛋白质回收率最高pH 7.0 条件,制备两个温度(50,60 ℃)条件下,1%木瓜蛋白酶酶解4 h 后煮沸10 min 灭酶,离心过滤浓缩后于-20 ℃冷藏备用。
3)不同加酶量条件 根据蛋白质回收率最高pH 7.0,温度55 ℃时,制备3 个加酶量(0.35%,0.50%,0.75%)条件的鲣鱼蛋白肽样品,-20 ℃冷藏备用。
1.3.2 蛋白质回收率的测定 鲣鱼鱼肉中蛋白质为主要含氮物质,故其蛋白质回收率可通过氮回收率来表征。采用凯氏定氮法 (GB/T 5009.5-2003)测定鲣鱼蛋白肽的总氮含量,依据以下计算方法确定其蛋白质回收率:
蛋白质回收率 (Nitrogen recovery ratio,%)=[酶解后上清液中的氮含量(g)/酶解前底物中的氮含量(g)]×100%
1.3.3 XOD 抑制活性的测定 XOD 是尿酸合成的关键酶,体外XOD 抑制活性可作为评价样品降尿酸活性的有效方法[6-8]。在嘌呤代谢过程中,XOD可将黄嘌呤和次黄嘌呤氧化成尿酸,其反应原理如下:
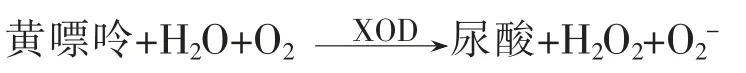
参照文献[9]和[10],并稍作修改。分别将50 μL 待测样 品,50 μL 0.05 U/mL 的XOD 加入96酶标仪检测板中,37 ℃孵育10 min,加入150 μL 0.4 mmol/L 黄嘌呤溶液后,酶促反应被启动,同时记录2 min 内反应体系在290 nm 处吸光值的动力学变化,以pH 7.5 PBS 缓冲液做参比,酶促反应体系的初始反应速率记为V0,样品存在时酶促反应体系的初始速率记为VS,按照以下公式计算样品对XOD 活性的抑制率:
XOD 抑制活性 (XOD inhibitory activity,%)=(V0-VS)/V01.3.4 超氧阴离子(O2-)清除能力的测定 XOD催化黄嘌呤产生尿酸的同时生成了超氧阴离子(O2-),O2-可与NBT 结合生成紫色甲瓒。参 照文献[9-10],并稍作修改。分别将50 μL 待测样品,50 μL 0.05 U/mL 的XOD 加入96 酶标仪检测板中,37 ℃孵育10 min 后,加入150 μL 混合液(0.4 mmol/L 黄嘌呤+0.24 mol/L NBT),并记录2 min内反应体系在290 nm 处的吸光值,以pH 7.4 PBS做空白对照,酶促反应体系的初始反应速率记为V0′,样品存在时酶促反应体系的初始速率记为VS′,按照以下公式计算样品对O2-的清除能力:
O2-清除活性 (O2-Scavenging activity,%)=(V0′-VS′)/V0′
1.3.5 氧自由基清除能力 (ORAC)的测定 ORAC 方法是评价抗氧化剂对过氧自由基的清除能力,以维生素E 水溶性类似物Trolox 作为标准溶液,AAPH 为自由基引发剂,Fluorescein 为荧光物质,在485 nm 光激发下,可发射538 nm 的荧光。在水溶液中,AAPH 释放过氧自由基将Fluorescein 氧化,荧光衰减。抗氧化剂通过与过氧自由基结合,抑制其氧化Fluorescein,从而减缓荧光衰减的速度。
参照文献[11]和[12],并稍作修改。采用酶标仪检测荧光强度的变化,分别向96 酶标仪检测板中加 入20 μL 待 测 样 品、Trolox(6.25,12.5,25,50 μmol/L)定量标准液和pH 7.4 PBS 缓冲液,37 ℃孵育10 min 后,加入200 μL Fluorescein 孵育20 min,其中对照组加入20 μL PBS 缓冲液,其余每孔加入20 μL AAPH,检测2 h 内反应液在538 nm 处吸光值的变化。氧自由基清除能力ORAC 值是通过相对荧光衰减曲线面积S 的变化计算得出,公式如下:

物质的量浓度/样品物质的量浓度
1.3.6 HPLC 分析鲣鱼蛋白肽分子质量分布 将标准品细胞色素C、抑肽酶、氧化型谷胱甘肽和Gly-Gly-Gly 配置成质量浓度为1 mg/mL 的溶液,鲣鱼蛋白肽样品稀释成质量浓度为5 mg/mL 的待测溶液,所有溶液均用0.22 μm 的微孔膜过滤后,采用AKTA 蛋白纯化仪分离鲣鱼蛋白肽,并分析其分子质量分布范围。蛋白纯化洗脱条件为:色谱柱:Superdex peptide GL10/300;流动相:0.02 mol/L PBS+0.25 mol/L NaCl (pH=7.2),流速:0.5 mL/min,检测波长:214 nm;样品质量浓度:5 mg/mL,进样量:500 μL。
1.3.7 鲣鱼蛋白肽的总氨基酸含量分析 参照文献方法[13],并稍作修改。准确吸取1 mL 样品于水解管中,加入1∶1 分析纯盐酸5 mL,酒精喷灯封管后置烘箱中于110 ℃水解24 h,水解后的样品冷却至室温,过滤到50 mL 容量瓶中定容,吸取2 mL 样品置于60 ℃烘箱中脱酸至底部留有少许痕渍,再加入1 mL 样品缓冲液混合均匀,经0.22 μm 过滤器过滤后备检。采用全自动氨基酸分析仪分析:色谱柱:membraPureT259 钠离子交换柱;流动相流速:160 μL/min;茚三酮溶液流速:80 μL/min;检测波长:脯氨酸在440 nm 处检测,其余氨基酸均在570 nm 处检测。
1.3.8 鲣鱼蛋白肽的分离纯化 DEAE-52 纤维素层析填料装柱,以0.5 mL/min 流速先后用去离子水、0.05 mol/L NaCl、0.15 mol/L NaCl、0.5 mol/L NaCl 溶液阶段洗脱,收集洗脱组分并浓缩至一定浓度,测定其相应的XOD 抑制活性和ORAC 值。鲣鱼蛋白肽差异样品经DEAE-52 纤维素层析分离纯化后,活性最好的组分进一步采用Sephadex G15 纯化,0.5 mL/min 流速,去离子水洗脱并收集各分离组分,浓缩至一定浓度后,测定其相应的XOD 抑制活性和ORAC 值。
1.3.9 LC-MS/MS 鉴定纯化组分的多肽序列 将组分B1、D1 和F1 配制成浓度为1 mg/mL 的待测溶液,进一步进行高效液相质谱联用分析。参照文献方法[14-15],并稍作修改,洗脱条件为:Agilent 1290/maXis Impact,LC-Agilent Technologies 1290 Infinity 超高相液相色谱和MS-BRUKER maXis Impact 高分辨质谱仪,C18 反相色谱柱:Agilent SB-C18,流动相为乙腈梯度洗脱,1~4 min:20%~80% 乙腈水溶液;4~9 min:80%等度洗脱;9~10 min:80%~20%乙腈梯度洗脱。
1.4 数据分析
数据采用SPSS 19.0 软件分析,质谱结果采用Bruker Compass Data Analysis 4.1 软件解谱,以P<0.05 为显著性评定指标,数据用x±SD 表示,试验数据采用Graph prism 和origin 2017 制图。
2 结果与分析
2.1 鲣鱼蛋白肽降尿酸活性及抗氧化活性评价
由图1a 可知,酶解pH 和温度变化时,鲣鱼蛋白肽的蛋白质回收率随pH 变化呈上升趋势,鲣鱼蛋白肽样品S3 蛋白质回收率最高,原因是木瓜蛋白酶对温度和pH 敏感,在pH 7.0、温度55 ℃时活性最高,其蛋白质回收率最大。酶解加酶量增加时,木瓜蛋白酶酶解效率提高,从而使鲣鱼蛋白肽的蛋白质回收率升高。
由图1b 和图1c 可知,当酶解pH 升高时,差异样品的XOD 抑制活性呈上升趋势,其中S1 和S2 的ORAC 值 相 当,S3 的XOD 抑 制 活 性 和ORAC 值均显著高于S1 和S2(P<0.05),说明弱酸性或中性鲣鱼蛋白肽的XOD 抑制活性和抗氧化活性更显著;当酶解温度升高时,鲣鱼蛋白肽的XOD 抑制活性和ORAC 值均表现为先上升后下降的趋势,温度为55 ℃的鲣鱼蛋白肽,其XOD 抑制活性和ORAC 值均显著升高(P<0.05),说明酶在最适温度酶解效率提高,鲣鱼蛋白肽中活性小分子多肽种类和数目明显增多。当增加木瓜蛋白酶的加酶量时,鲣鱼蛋白肽的XOD 抑制活性和ORAC 值均呈先降低后上升的趋势,加酶量为0.5%的S7 显著低于加酶量为0.35%和0.75%的S6 和S8,原因是木瓜蛋白酶对蛋白质和多肽的酶解是非特异性的,S7 中可能含有较多活性较弱的多肽片段。
由图2c 可知,鲣鱼蛋白肽的XOD 抑制活性与ORAC 值二者显著相关(P<0.05),而氧自由基清除能力ORAC 值与样品中羟基的存在有关[16],说明鲣鱼蛋白肽的XOD 抑制活性可能与多肽分子中的羟基有关。由图2a 和图2b 可知,当pH 条件变化时,XOD 抑制活性与蛋白质回收率的变化具有相关性,蛋白质回收率一定程度上能够反映样品的降尿酸活性。与此不同的是,在温度和加酶量变化时,XOD 抑制活性和ORAC 值随蛋白质回收率的升高呈先降低后上升的趋势,由于木瓜蛋白酶酶解的非特异性,加酶量及酶活性变化时,处于不同分子质量段的多肽,其数目和种类都存在较大的差异性,从而导致活性之间的差异。
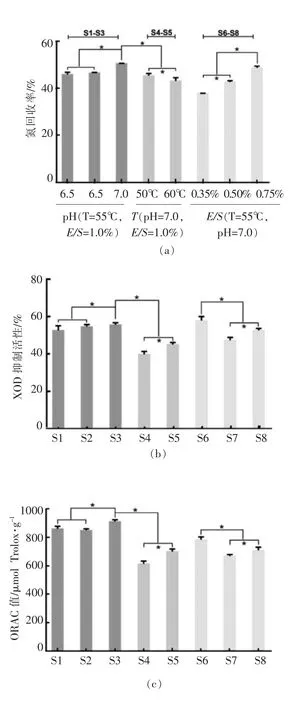
图1 不同工艺制备鲣鱼蛋白肽的蛋白质回收率(a)、XOD 抑制活性(b)和抗氧化能力ORAC 值(c)Fig.1 The nitrogen recovery ratio,XOD inhibitory activity and antioxidant activity of bonito protein hydrolysates

图2 (a)蛋白质回收率与XOD 抑制活性的相关性(b)蛋白质回收率与ORAC 值的相关性和(c)XOD 抑制活性与ORAC 值的相关性Fig.2 (a)The correlation of nitrogen recovery ratio with XOD inhibitory activity,(b)the correlation of nitrogen recovery ratio with ORAC values and (c)the correlation of XOD inhibitory activity and ORAC values
2.2 鲣鱼蛋白肽分子质量分布与体外活性的相关性
由图3a 中差异样品的分子质量分布可知,分子质量>1 ku 所占含量最高的为样品S6,最低的为样品S1。由图3b 和图3c 可知,差异样品的活性与分子质量<1 ku 的含量之间并无直接的线性相关关系,S6 中存在较多酶解不完全且分子质量较大的多肽,其XOD 抑制活性相对较高;当分子质量<1 ku 的含量大于62.5%时,XOD 抑制活性在60%~70%和72.5%~82.5%范围内集中分布,ORAC 值在62.5%~73.5%和74%~85%范围内集中分布,说明通过检测多肽分子质量<1 ku 的含量在不同区段的分布,可初步了解样品的XOD 抑制活性和ORAC 值水平。
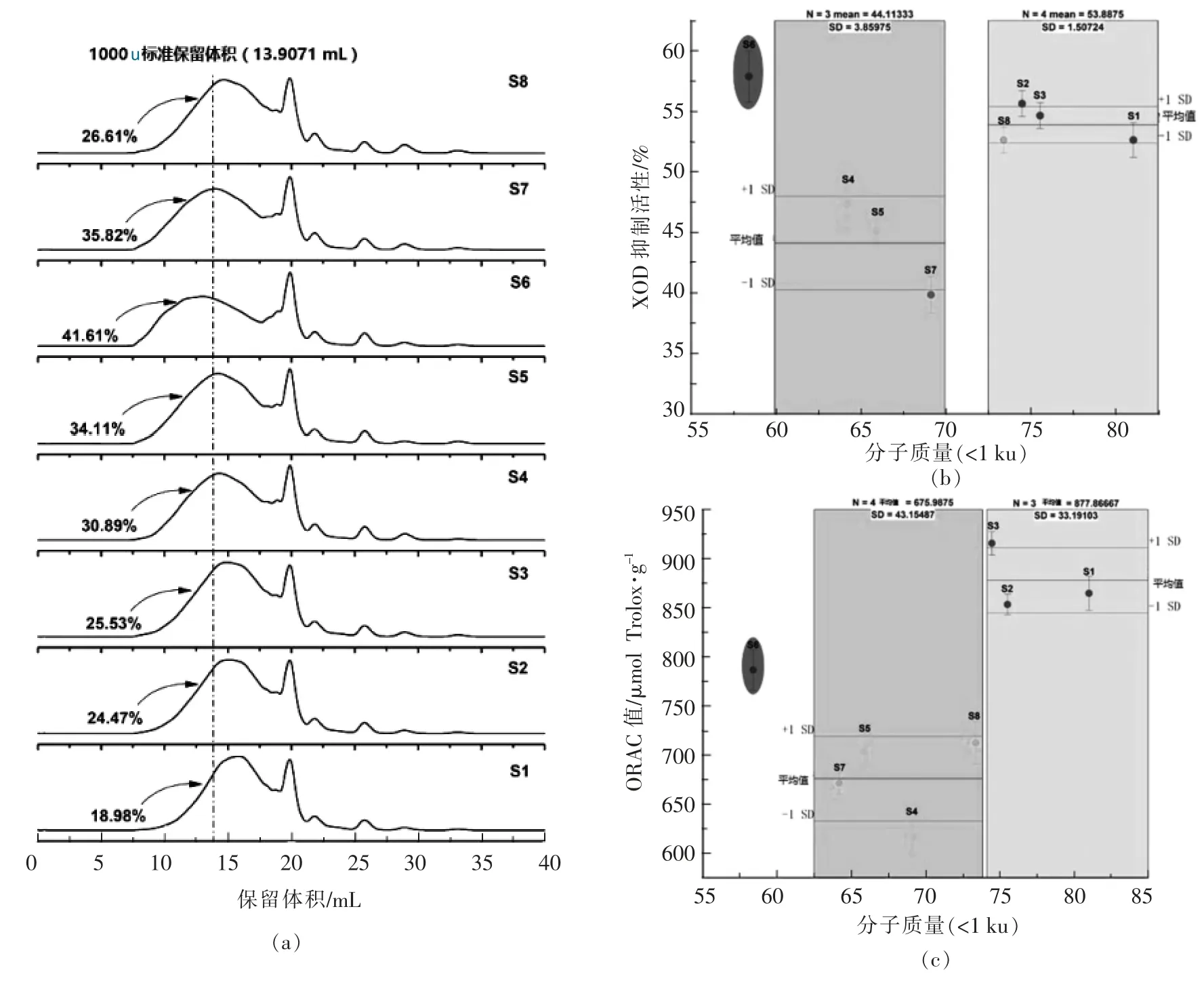
图3 (a)鲣鱼蛋白肽分子质量分布(b)分子质量<1 ku 的含量与XOD 抑制活性的相关性和(c)分子质量<1 ku 含量与ORAC 值的相关性Fig.3 The molecular weight (Mw)of bonito protein hydrolysates (a), the correlation of the percentage of Mw <1 ku with XOD inhibitory activity (b)and ORAC values (c)
2.3 鲣鱼蛋白肽总氨基酸含量与体外活性的相关性
由图4a 和图4b 可知,鲣鱼蛋白肽样品中总氨基酸含量的差异主要表现为脂肪族氨基酸含量的不同,说明脂肪族氨基酸含量的变化是影响其活性差异的重要指标。由图4c 可知,脂肪族氨基酸含量与蛋白质回收率的变化无线性相关性,而脂肪族氨基酸含量的变化与XOD 抑制活性和ORAC 值的变化趋势基本呈负相关,说明差异样品的降尿酸活性和抗氧化活性可以通过脂肪族氨基酸含量的变化来评估其活性变化的可能趋势。

图4 鲣鱼蛋白肽总氨基酸含量与体外活性的相关性Fig.4 Correlation between total amino acid content and in vitro activity of bonito protein peptide
2.4 鲣鱼蛋白肽的分离纯化及活性评价
差异样品S1-S8 经DEAE-52 纤维素层析纯化后,发现去离子水洗脱组分的XOD 抑制活性和ORAC 值均显著高于其它溶液洗脱组分,故将去离子水组分进一步用Sephadex G15 分离纯化,纯化后组分分别记为A1、B1、C1、D1、E1、F1、G1 和H1。纯化组分的ORAC 值、XOD 抑制活性、O2-清除活性及30 min 时290 nm 处尿酸吸收值测定结果如图5所示。
由图5a 可知,分离纯化后的组分A1-H1,除组分E1 的ORAC 值降低之外,其余样品的ORAC值均显著升高,说明大部分样品在纯化过程中氧自由基清除能力较强的多肽得到富集。
由图5b 和图5c 可知,酶促反应在30 min 达到反应平衡后,纯化组分均具有显著的降低尿酸含量的功效。然而,纯化组分对黄嘌呤氧化酶催化黄嘌呤生成尿酸初始速度的相对抑制率评价其XOD 抑制活性时,组分A1、B1、C1、E1 和G1 均表现为促进酶促反应的进行,同时测定其反应体系O2-的变化时,发现这些组分具有较强的O2-清除活性,说明样品在逐级纯化过程中,活性多肽富集,当组分中抗氧化肽的有效分子数目明显高于降尿酸肽的有效分子数目时,抗氧化活性成为纯化组分发挥功效的主导,从而使酶促反应向生成产物方向进行,导致反应初始阶段呈现出尿酸生成速率加快的现象。与此不同的是,组分D1、F1 和H1在反应初始阶段便具有较强的O2-清除活性和XOD 抑制活性,在反应平衡后F1 和H1 的尿酸水平显著降低,而D1 的尿酸吸光值降低不明显,说明抗氧化肽加速反应进行的同时并不改变反应平衡时降尿酸肽的XOD 抑制活性。这与上述分子质量分布图谱及总氨基酸含量的分析结果一致,不同活性肽在差异样品中分子数目所占含量,使其分子质量分布图谱、总氨基酸含量及体外化学活性改变,但样品的降尿酸活性和抗氧化活性主要取决于组分中多肽的氨基酸序列。

图5 鲣鱼蛋白肽的分离纯化及活性评价Fig.5 Purification and activity evaluation of bonito protein peptide
2.5 鲣鱼蛋白肽的结构鉴定与体外活性的相关性
根据上述试验结果,为进一步了解鲣鱼蛋白肽质谱图谱、氨基酸序列变化与其降尿酸活性、抗氧化活性之间的相关性,筛选差异样品纯化组分中XOD 抑制活性较强的B1 和F1 与活性较弱的D1,分析其LC-MS/MS 质谱图谱及氨基酸序列。
由图6可知,组分B1 和D1 在1~4 min 内基峰图的峰形相似,其中B1 的信号明显高于D1,且具有3 个明显的峰形。在0~1 min 时,B1 和F1 均具有一个较强信号峰,组分F1 在1~3 min 内信号较弱,在3~5 min 时信号较强,峰形明显,基本为高浓度乙腈溶液洗脱出的疏水性多肽。

图6 纯化组分B1、D1、F1 的BPC 图Fig.6 The basic peak chromatogram (BPC)of the purified fractions B1,D1 and F1
由表1可知,经过DEAE-52 纤维素层析和Sephadex G15 分离纯化后,组分F1 中多肽片段相对较纯,WML 为疏水性多肽,组分B1 中LEYE、LPVI 和LPVPAF 为疏水性多肽,组分F1中LEYE 为疏水性多肽,其余多肽序列均为亲水性多肽,其中亲水性多肽AMPF 同时存在于组分B1 和F1 中,疏水性多肽LEYE 同时存在于组分D1 和F1 中。色氨酸及含有色氨酸的多肽已被证明具有显著的XOD 抑制活性[17],疏水肽WML 可能具有XOD 抑制活性。因此,结合图6纯化组分的基峰图与图5组分的活性分析结果,说明B1 和D1 的抗氧化活性可能与1~3 min 内信号强的多肽片段相关,而B1 和F1 的XOD 抑制活性可能是由0~1 min 内亲水性多肽和3~5 min 内疏水性多肽共同作用的结果,故1~3 min 内信号最强的B1具有显著的抗氧化活性,在XOD 活性测定时表现为加速酶促反应的进行,使其反应初始速率上升,而F1 在1~3 min 内信号弱,故其抗氧化活性相对较低。

表1 组分B1、D1 和F1 鉴定出的多肽序列Table 1 The amino acid sequence of peptides identified from B1,D1 and F1
3 结论
不同工艺条件制备的鲣鱼蛋白肽差异样品,其XOD 抑制活性与氧自由基清除能力ORAC 值之间具有显著的相关性。单因素pH 条件改变时,蛋白质回收率的变化与鲣鱼蛋白肽活性的变化趋势一致。鲣鱼蛋白肽的XOD 抑制活性和ORAC 值在多肽分子质量<1 ku 所含占比的不同分布区段集中,且与脂肪族氨基酸的含量呈相反的趋势变化,从而可通过分子质量分布和脂肪族氨基酸含量的变化对其化学活性进行初步评估。分离纯化和质谱结构鉴定结果表明,纯化组分质谱基峰图在0~1 min、1~3 min 和3~5 min 峰形分布可能与降尿酸肽和抗氧化肽在鲣鱼蛋白中的分布显著相关。因此,通过分析样品的分子质量分布图谱、脂肪族氨基酸含量图谱及纯化后质谱基峰图图谱,可进一步对鲣鱼蛋白降尿酸肽和抗氧化肽的制备工艺进行质控。

