Bacillus sp. L1胞外蛋白酶EL1基因克隆及酶学性质分析
李钰娜,宋英达,任晨霞
(长治医学院,山西长治 046000)
蛋白酶是一类水解蛋白质肽键的酶类。蛋白酶是第一种被应用于工业生产的酶类,也是最主要的工业酶制剂[1-3],占所有工业酶制剂销售总额的60%,在食品、饲料、医药、化妆品制造和皮革加工等行业有着广泛的应用[4-11]。蛋白酶在动物、植物、微生物中均有分布,但来源于动物、植物的蛋白酶往往生产周期长,且受到地理、气候、季节等因素的影响,导致生产成本较高,较难进行规模化生产。目前,商业化的蛋白酶制剂主要来源于细菌,而细菌分泌的胞外蛋白酶具有易提取、易纯化、下游处理工艺相对简单等优势,成为商业化酶制剂的主要来源。
随着我国众多工业领域地发展,蛋白酶需求逐年增加,寻求在较宽的温度范围内及pH范围内具有较好稳定性的蛋白酶,对于进一步拓展蛋白酶在各行业的应用具有重要意义[12-14]。芽孢杆菌属(Bacillussp.)是重要的蛋白酶生产菌株,产生蛋白酶的芽孢杆菌主要包括B.subtilis、B.cereus、B.pumilus、B.licheniformis等[15-17]。本研究中菌株Bacillussp.L1分泌的胞外蛋白酶EL1与Bacillusstratosphericus分泌的丝氨酸蛋白酶同源性最高,具有较好的热稳定性和碱稳定性,具有一定的工业应用价值,本研究为胞外蛋白酶EL1的进一步开发和利用提供了理论依据。
1 材料与方法
1.1 材料与仪器
PMDTM18-T载体克隆试剂盒 日本Takara公司;Bacillussp. L1、E.coliDH5α为实验室保存菌株;低分子量蛋白Marker(14.4~116 kDa)、苯甲基磺酰氟(PMSF) 北京索莱宝公司;Biospin细菌基因组提取试剂盒 杭州博日科技公司;PCR产物纯化试剂盒 美国Omega公司;Solution I载体连接试剂盒 日本Takara公司;其它试剂均为国产分析纯。
ELX800酶标仪 美国BioTek公司;DYCZ-24DN双垂直电泳槽 北京六一公司;TGL-16M台式高速冷冻离心机 湖南湘仪公司;DEAE sepharose fast flow层析柱 美国GE公司。
1.2 实验方法
1.2.1 培养基制备 LB液体培养基:酵母粉 0.5 g,蛋白胨 1 g,NaCl 1 g,H2O 100 mL,pH7.5;发酵培养基:麸皮 1 g,玉米粉 2 g,豆粕 2 g,KH2PO40.03 g,Na2HPO40.1 g,Na2CO30.1 g,CaCl20.1 g,H2O 100 mL,pH7.5。
1.2.2 16S rRNA序列测定 利用试剂盒提取细菌基因组DNA作为模板,27 F(5′-AGAGTTTGATCCTG GCTCAG-3′)及1492 R(5′-ACGGCTACCTTGTTACG ACTT-3′)为通用引物扩增16S rRNA基因序列。对扩增产物进行切胶回收并与PMDTM18-T载体连接,连接产物转化E.coliDH 5α,挑取阳性克隆进行测序。
1.2.3 酶活测定 Folin-酚法测定蛋白酶活力[18-19]。将60 ℃,每分钟催化酪蛋白水解生成1 μg酪氨酸所需的酶量定义为1个活力单位。
1.2.4 蛋白酶的分离纯化 首先斜面挑取菌株接种于LB液体培养基中,37 ℃、200 r/min培养24 h进行菌株的活化,然后将活化后的菌株按1%的接种量接种于发酵产酶培养基中,37 ℃、200 r/min培养3 d;将发酵液在4 ℃、8000×g离心30 min,收集上清。将(NH4)2SO4粉末缓慢加至上清液中[20],使其饱和度达到65%,4 ℃静置过夜。之后将液体8000×g离心30 min,弃上清,沉淀用20 mmol/L的Tris-HCl(pH8.8)重溶,并用该缓冲液透析10 h。用20 mmol/L的Tris-HCl缓冲液(pH8.8)平衡层析柱,上样,利用0~100%的1 mol/L NaCl 溶液以1.0 mL/min 的流速进行线性梯度洗脱,按照1 mL/管进行分部收集,测定每管收集液的酶活,将蛋白酶活性较高管进行合并,进行SDS-PAGE纯度鉴定。
1.2.5 质谱鉴定、基因克隆 SDS-PAGE电泳获得的目的条带经胰蛋白酶酶解后进行二级质谱检测,检测结果搜索数据库Mascot,获得最相似的蛋白序列,根据该序列设计嵌套引物,利用TAIL-PCR技术[21]克隆5′端未知序列和3′端未知序列,最后拼接获得全序列。
1.2.6 酶学性质测定
1.2.6.1 最适反应温度及热稳定性 将纯化的酶液适当稀释,分别在37、45、50、55、60、65、70、75、80 ℃下孵育,Folin-酚法检测蛋白酶活力。酶活最高时对应的温度为酶的最适温度。将纯化的酶液在60 ℃水浴中保温1、1.5、2、2.5、3、4、5 h,在最适反应温度下检测残余酶活力,以未处理酶液为对照,将其活力定义为100%,分析温度对酶活力的影响。
1.2.6.2 最适pH及pH稳定性 用Mcllvaine buffer(pH4.0、5.0、6.0、7.0)、Tris-HCl buffer(pH7.0、7.5、8.0、8.5、9.0)和Glycine-NaOH buffer(pH9.0、9.5、10.0、10.5)三种缓冲液对酶液进行适当稀释。Folin-酚法检测蛋白酶活力,确定酶的最适pH。将纯化的酶液于0 ℃、pH8.0缓冲液中处理不同时间,最适温度下检测残余酶活力,将未处理酶液活力定义为100%,分析pH稳定性。
1.2.6.3 金属离子及抑制剂对酶活性的影响 用20 mmol/L pH8.0 的Tris-HCl缓冲液配制10 mmol/L的不同金属离子溶液,将金属离子(Mg2+、Mn2+、Zn2+、Ca2+、Fe2+、Cu2+)溶液与酶液按照1∶4的比例混合,使金属离子终浓度为2 mmol/L。配制10 mmol/L的PMSF,与酶液与按照1∶4的比例混合,使其终浓度为2 mmol/L。冰浴30 min,以pH8.0、20 mmol/L Tris-HCl对酶液稀释相同倍数作为对照,于最适反应条件下测定酶活。
2 结果与分析
2.1 16S rRNA序列分析
将16S rRNA序列测定结果进行搜库比对分析,发现菌株与GenBank中的Bacillusstratosphericus属菌具有高度同源性,相似度达99%,因此将菌株L1与Bacillusstratosphericus归为同一属(图1)。
2.2 蛋白酶的分离纯化
用65%的(NH4)2SO4对菌株Bacillussp. L1发酵后的粗酶液进行沉淀。阴离子交换层析对透析脱盐后的样品进行纯化(图2),收集具有蛋白酶活性的峰尖部分,超滤浓缩后SDS-PAGE电泳检测为单一条带(图3),由SDS-PAGE图谱可知EL1的分子量介于45~66 kDa之间。
2.3 质谱鉴定及基因克隆
二级质谱获得2段多肽序列,序列与Bacillusstratosphericus分泌的丝氨酸蛋白酶序列高度一致,序列一致性为100%(表1)。克隆的蛋白酶EL1的全基因序列与Bacillusstratosphericu丝氨酸蛋白酶(WP_007499449)全序列的相似度为98%,共1326 bp(图4)。由此可知,EL1是由441个氨基酸组成的丝氨酸蛋白酶。
2.4 酶学性质分析

表1 蛋白酶MALDI-TOF/TOF质谱检测结果Table 1 Amino acid sequence of the EL1 by using MALDI-TOF/TOF system
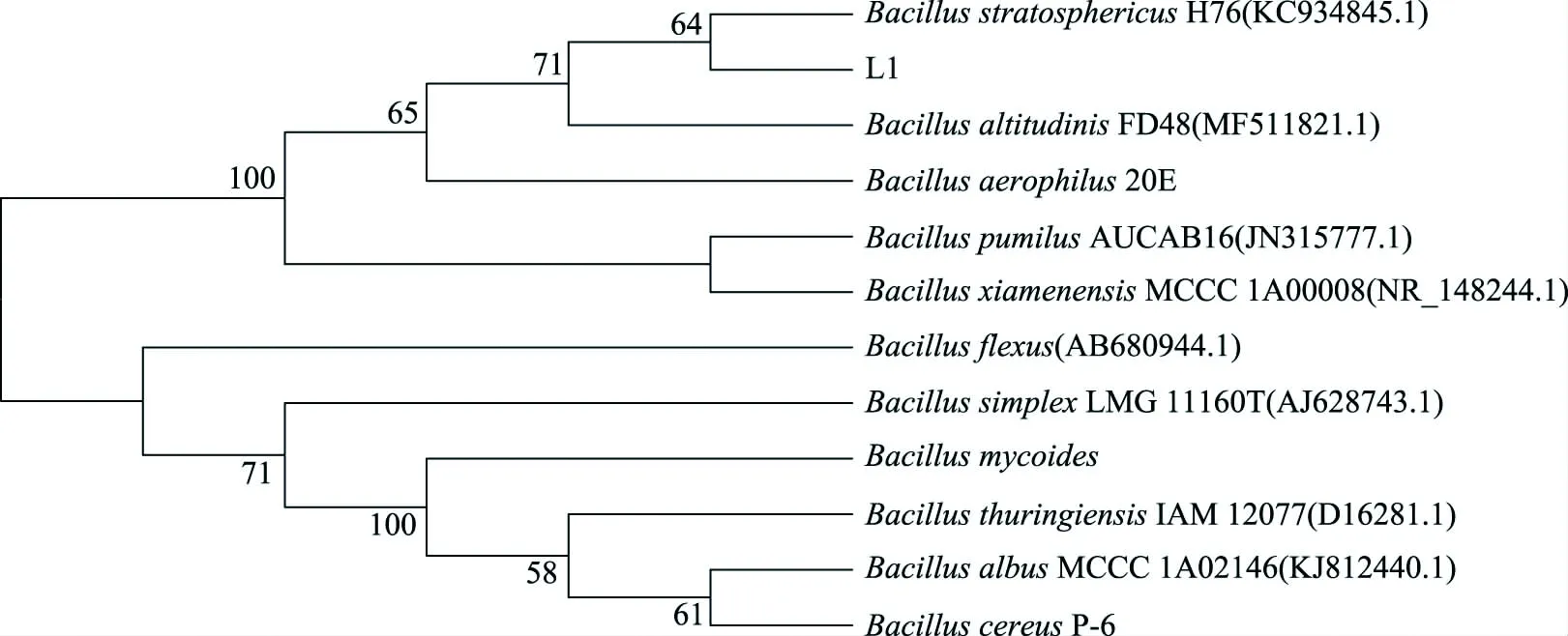
图1 菌株L1的16 S rRNA系统发育进化树Fig.1 Phylogenetic tree of the strain L1 on the 16S rRNA gene sequence
2.4.1 最适温度及热稳定性 检测结果表明,EL1最适温度为60 ℃;热稳定性试验表明,60 ℃处理5 h,仍保留约60%的酶活力,EL1具有很好的热稳定性(图5)。

图2 DEAE阴离子交换色谱图Fig.2. Elution profile of proteases secreted by Bacillus sp. L1 on DEAE
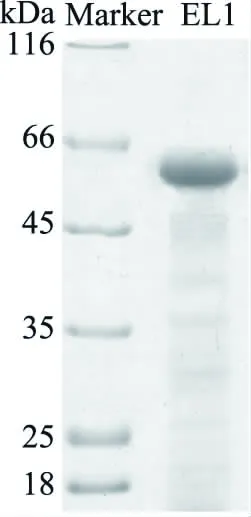
图3 蛋白酶SDS-PAGE分析Fig.3 SDS-PAGE of the purified protease
2.4.2 EL1的最适pH及pH稳定性 检测结果表明,EL1最适pH为8.0;EL1在pH8.0的缓冲液中处理12 h时仍可保留约80%以上的酶活力,在碱性条件下稳定性较好(图6)。
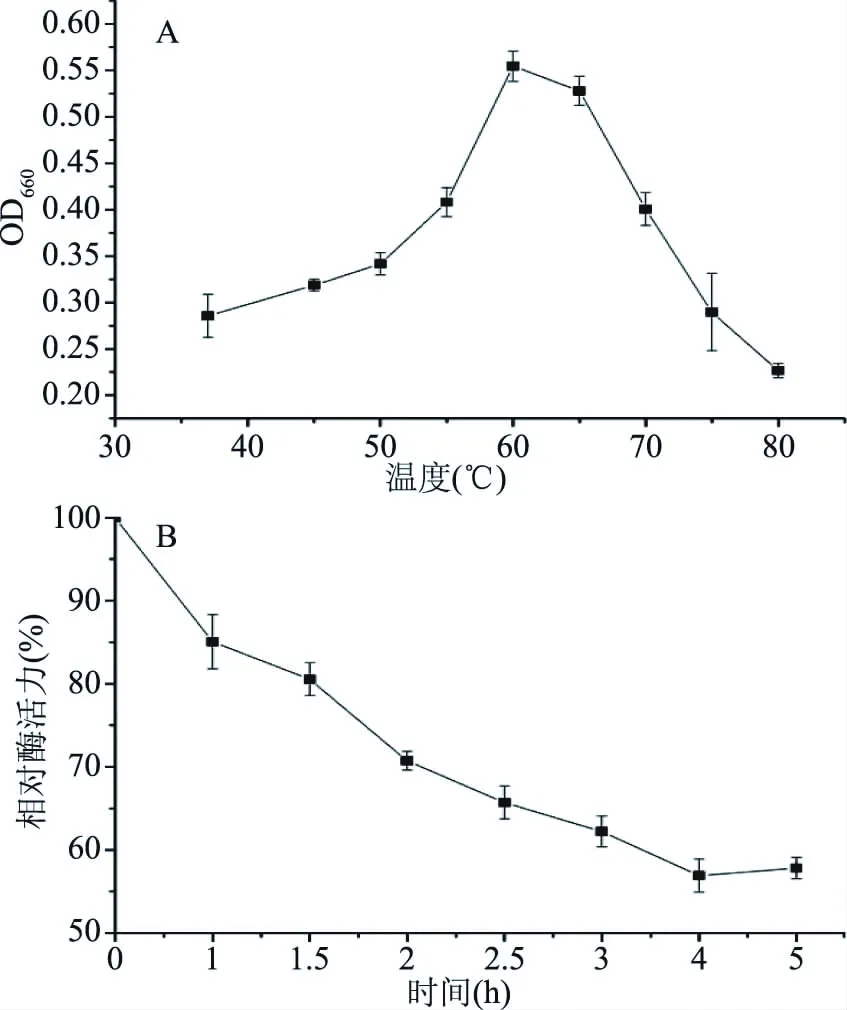
图5 EL1的最适温度(A)和热稳定性(B)Fig.5 Optimum temperature(A)and the temperature(B)stability of EL1
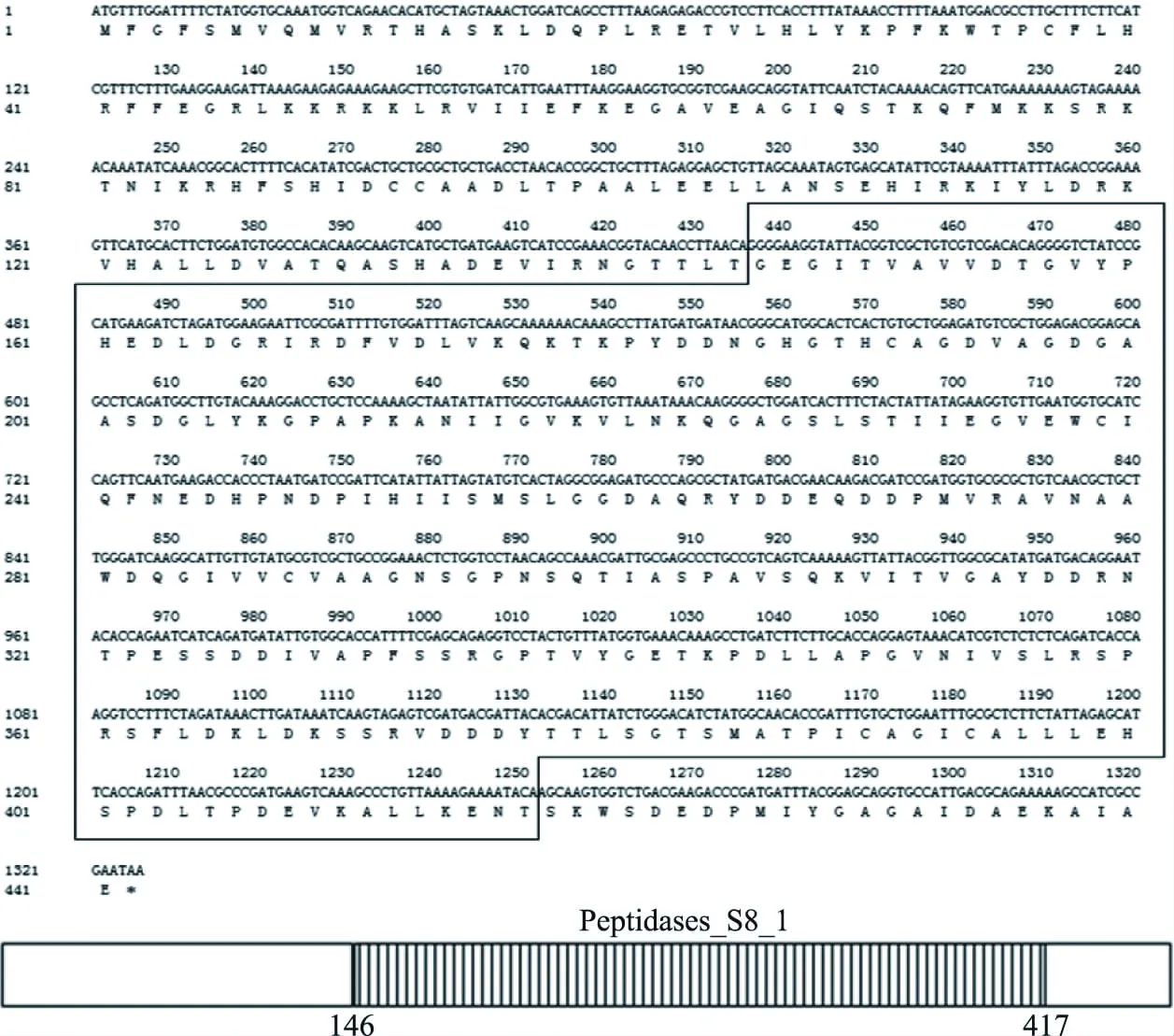
图4 EL1的核苷酸序列和氨基酸序列(实线框中的序列为Peptidases_S8_1)Fig.4 The nucleotide sequence and amino acid sequence of EL1(The sequence in the box are the Peptidases_S8_1)
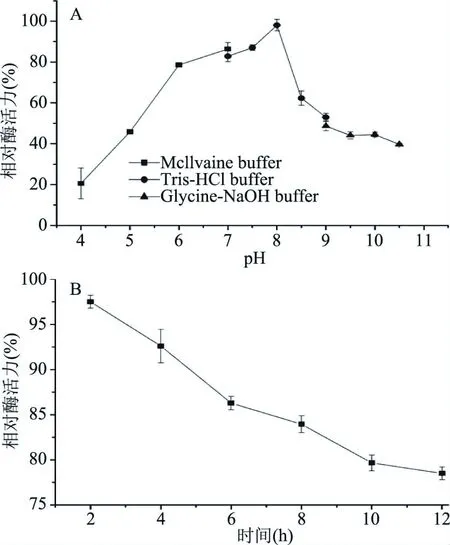
图6 EL1的最适pH(A)及pH稳定性(B)Fig.6 Optimum pH(A)and the pH stability(B)of EL1
2.4.3 金属离子及抑制剂对 EL1的影响 检测结果表明,Mn2+对EL1活力具有一定的促进作用,Cu2+具有一定的抑制作用,PMSF作用下EL1几乎完全失活(图7),进一步验证了EL1属于丝氨酸蛋白酶。

图7 各种金属离子及抑制剂对EL1的影响Fig.7 Effect of different regents on the activity of EL1
3 结论
本研究从菌株Bacillussp. L1分泌的胞外蛋白酶中纯化出了EL1。EL1氨基酸序列与菌株Bacillusstratosphericus分泌的丝氨酸蛋白酶具有较高的同源性,且酶活性受到PMSF的抑制,故推断其为丝氨酸蛋白酶。EL1最适温度为60 ℃,具有较好的热稳定性,60 ℃处理5 h,仍保留约60%的酶活力;最适pH为8.0,且在pH8.0的缓冲液中处理12 h时仍可保留约80%以上的酶活力。与已报道的Bacillussp.来源的蛋白酶相比较,在较宽的温度范围及pH范围内具有较好的稳定性,如李金鞠等[22]报道的芽孢杆菌蛋白酶BLYS-1在pH5~8时活性较高,最佳反应温度为50 ℃。该特性使其在一些特殊的工业生产中(如:高温、碱性环境)具有潜在的应用价值。鉴于该丝氨酸蛋白酶的纯化得率不高,下一步预计通过响应面法对发酵条件进行优化,另一方面可以通过构建重组表达载体,对该蛋白酶进行异源表达,进而提高EL1的产量,为其工业化生产奠定基础。

