阿霉素诱导人食管鳞癌细胞凋亡的实验研究
刘玟琳 冯 彤 苑亚娇 徐建玲 蒋汉明
山东第一医科大学(山东省医学科学院),山东 泰安 271000
食管癌是最常见的消化系统恶性肿瘤之一,其死亡率位居世界肿瘤死因的第6位[1-3]。尽管放疗、化疗、手术和综合治疗等多种治疗方法已用于食管癌的治疗,但其5年生存率也仅为20%~30%[4-5]。我国是食管癌年龄标准化死亡率最高的国家,绝大多数食管癌为食管鳞癌(esophageal squamous cell carcinoma,ESCC)。食管癌起病隐匿,发现时多为进展期[6],食管鳞癌进展主要分为5个阶段,其中异型增生是其发展的关键[7-9]。目前化疗仍是食管癌最普遍的治疗方法,尤其针对于易复发型和中晚期食管癌患者[10-11]。阿霉素作为蒽环类广谱抗肿瘤药物具有疗效好、活性强等特点,其主要通过抑制拓扑异构酶的活性,发挥抗肿瘤作用。在动物实验和临床应用中表现出较显著的抗肿瘤效果[12-14,18-20]。研究表明,阿霉素可诱导肿瘤细胞S期阻滞,而S期是细胞周期中DNA合成和染色体复制的关键时期。作用于S期的阿霉素,可以有效的抑制细胞增殖,诱导细胞凋亡[15,17]。本实验以人食管鳞癌细胞KYSE450、KYSE180、KYSE510、EC9706作为研究对象,通过体外实验探讨阿霉素对人食管癌细胞增殖和凋亡的影响,为阿霉素抗食管癌的研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1细胞株 人食管鳞癌KYSE450、KYSE180、KYSE510、EC9706细胞株,分别购自中科院上海细胞库和北纳生物。KYSE450的基础培养基为MEM,其它细胞基础培养基为RPMI1640,所有基础培养基中均添加10%的胎牛血清和100 U/mL的青链霉素。细胞培养于37 ℃含5%CO2的细胞培养箱中。
1.1.2药品与试剂 阿霉素购自于Sigma公司,溶于DMSO中,制成5 mg/mL的储备液;cleaved caspase-3、cleaved PARP、Bax抗体购自CST公司;内参GAPDH抗体购自Santa Cruz公司;二抗购自KPL公司;增强型CCK-8、DAPI染色液购自碧云天;Annexin V-FITC /PI双染细胞凋亡检测试剂盒、MitoScreen(JC-1)购自BD公司;BCA微量蛋白定量试剂盒购自索莱宝公司。
1.1.3仪器 全波长多功能微孔板酶标仪(PE Enspire);流式细胞仪(BD Canto II);离心机(Minispin);蛋白质印迹系统(Bio-rad);血细胞计数板(上海XB-K25);尼康普通倒置显微镜(TS100);尼康荧光倒置显微镜(Ti-S);超净工作台(上海新苗SW-CJ-2F);CO2细胞培养箱(Thermo-3111)。
1.2 方法
1.2.1细胞培养 人食管癌细胞KYSE450、KYSE180、KYSE510、EC9706,采用含10%胎牛血清的MEM或RPMI1640培养基,培养皿置于37 ℃含5%CO2的细胞培养箱中培养,细胞生长至培养皿中80%~90%时进行传代,待细胞生长到对数期进行后续实验。
1.2.2ADM敏感细胞株筛选 取对数生长期食管癌细胞KYSE180、KYSE450、KYSE510、EC9706 3×104细胞/mL接种于96孔板中,每孔100 μL,过夜。阿霉素浓度设置为5 000,2 000,1 000,500,250,125,62.5和31.25 ng/mL,并设置0 ng/mL为对照组,每个浓度4个复孔。48 h后,吸尽培养基,加入含CCK-8(5 mg/mL)的新鲜培养基,每孔100 μL,37 ℃避光孵育1.5 h,波长450 nm处测定各组的吸光度,计算IC50,实验重复3次,取平均值。IC50最低的细胞为最敏感细胞株。细胞增殖抑制率=(对照组吸光度-处理组吸光度)/对照组吸光度×100%。
1.2.3细胞总蛋白的提取 取对数期的KYSE450和KYSE180细胞,接种于6孔板中,24 h后加入不同浓度的ADM,分别作用48 h和72 h,吸尽培养基,以4 ℃预冷的PBS清洗2遍,加入SDS-裂解液,提取总蛋白。
1.2.4蛋白印迹 将收集的蛋白经定量后,等量蛋白(40 μg)经SDS-PAGE电泳后转移至NC膜上,5%脱脂奶粉常温封闭1 h。分别用cleaved PARP(稀释比1∶1 000),cleaved caspase-3(稀释比1∶1000),Bax(稀释比1∶500)和GAPDH(稀释比1∶3000)抗体4 ℃孵育过夜,然后TBST洗膜3次,5 min/次,TBS洗膜1次,5 min/次,加入HRP偶联的二抗,室温封闭1 h,再次重复上述洗膜步骤,最后显影、定影曝光后分析结果。
1.2.5细胞形态学变化 取对数生长期的KYSE450细胞接种至6孔板中,过夜。加入不同浓度的ADM,48 h后观察,并拍照记录。
1.2.6DAPI染色 ADM处理48 h后的KYSE450细胞,经预冷的PBS清洗2次后加入-20℃预冷的甲醇/丙酮固定液(体积比1∶1),PBS清洗2次,加入DAPI染色液,避光孵育10 min,再次用PBS清洗,置于荧光显微镜下观察细胞核形态,拍照记录。
1.2.7细胞周期检测 取对数期生长的KYSE180和KYSE450细胞接种于小皿中,ADM处理24 h后,收集细胞,并用1 mL PBS清洗2遍。加入预冷的75%乙醇悬浮,置于摇床上,4 ℃固定过夜,离心后PBS洗涤2遍。加入终浓度为50 mg/L的RNase A溶液,于37 ℃水浴20 min,再加入相同工作浓度的PI试剂,30 min避光孵育,最后上机检测。
1.2.8线粒体膜电位JC-1检测 收集不同浓度ADM处理24 h后的KYSE450细胞,根据BDTMMitoscreen说明,37 ℃含5%CO2的细胞培养箱中孵育10~15 min,上机检测。
1.2.9细胞凋亡检测 收集不同浓度ADM处理48 h的KYSE450细胞, 4℃预冷的PBS清洗2遍,根据Annexin V-FITC/PI双染试剂盒说明,避光孵育15 min,然后上机检测。
1.3 统计学分析
2 结 果
2.1 ADM抑制食管鳞癌细胞增殖
为了验证ADM对食管鳞癌细胞增殖的影响,我们采用不同浓度的ADM作用48 h。结果表明,ADM对各食管鳞癌细胞株增殖具有显著的抑制作用,并呈剂量依赖性。当ADM浓度达到250 ng/L时,除EC9706外,细胞增殖抑制率均超过50%。ADM对KYSE450、KYSE180、KYSE510、EC9706的半数抑制浓度(IC50)分别97.46、111.21、168.63和368.53 ng/mL。其中KYSE450最敏感(表1,图1A)。镜下观察发现,对照组的KYSE450细胞生长饱满,贴壁均匀,细胞边缘完整清晰。随着ADM浓度的增加,皱缩的细胞增多,高浓度组多数细胞变圆,部分细胞未贴壁悬浮于培养基中(图1B)。以上结果表明ADM呈剂量依赖性的抑制食管鳞癌细胞增殖,并诱导细胞死亡。

表1 ADM抑制人食管鳞癌细胞增殖

A:ADM抑制人食管鳞状细胞癌细胞增殖对KYSE450细胞形态变化的影响(× 400)。
2.2 ADM对KYSE450细胞和KYSE180细胞周期的影响
不同浓度ADM处理24 h后的KYSE180和KYSE450细胞S期和G2期细胞比例增加,G1期减少。KYSE180细胞中,对照组S期和G2期的细胞比例分别为20.11%和4.49%,当ADM浓度为187.5 ng/mL时,S期和G2期细胞比例上升至29.9%和64.9%。此后,随着ADM浓度增加,G2期细胞比例下降,S期细胞比例上升。当ADM浓度为3 000 ng/mL时,G2期细胞比例下降至为4.81%,与对照组相比差异无统计学意义。S期细胞比例为44.12%,显著高于对照组;而在KYSE450细胞中,ADM浓度187.5 ng/mL时,S期细胞比例上升至68.36%,随着ADM浓度增加,S期细胞比例虽有所下降但仍显著高于对照组(图2A,B)。以上结果表明,ADM可诱导食管癌KYSE180和KYSE450细胞S期阻滞,在一定浓度范围内,也伴随G2期阻滞。

A & B:阿霉素影响KYSE450、KYSE180细胞周期分布<0.01 vs 对照组)。
2.3 ADM对KYSE450和KYSE180线粒体膜电位的影响
为了验证ADM对KYSE450和KYSE180线粒体膜电位的影响,我们利用JC-1探针检测了不同浓度ADM处理后细胞线粒体膜电位的变化。结果表明,对照组中KYSE450和KYSE180细胞低线粒体膜电位的细胞比率仅为4.77%、1.83%,随着ADM浓度增加,线粒体膜电位下降的细胞比例逐渐增加。当ADM浓度达到3 000 ng/mL时,低线粒体膜电位的细胞比率分别达到了9.83%和8.20%(图3A~D),但差异无统计学意义。说明ADM并不影响KYSE450和KYSE180细胞的线粒体膜电位。
2.4 ADM诱导KYSE450凋亡
DAPI染色结果表明,对照组细胞核呈现圆形或椭圆形,随着ADM浓度增加,部分细胞核皱缩,着色加深,呈现密度的强荧光团,有些呈新月状聚集(图4A,B)。Annexin V-FITC/PI双染结果表明,ADM可显著诱导KYSE450细胞凋亡,并呈浓度依赖性。对照组细胞凋亡率仅为6.63%,而当ADM浓度达到3 000 ng/mL时,46.6%的细胞发生了凋亡(图4C,D),差异具有统计学意义(P<0.01)。
2.5 ADM对KYSE450、KYSE180细胞凋亡相关蛋白的影响
Western Blot结果显示,随着ADM处理,KYSE450和KYSE180细胞内cleaved caspase-3,cleaved PARP水平显著上升,且呈时间剂量依赖性,而Bax水平在KYSE450和KYSE180细胞中呈现不同的变化趋势。在KYSE450细胞中,ADM处理可诱导Bax水平升高,而在KYSE180细胞中,Bax表现出下降的趋势(图5A~D)。以上结果表明,ADM能激活caspase-3,剪切PARP,促进KYSE450和KYSE180细胞凋亡。

A & B:不同浓度的ADM对KYSE450细胞线粒体膜电位的影响;
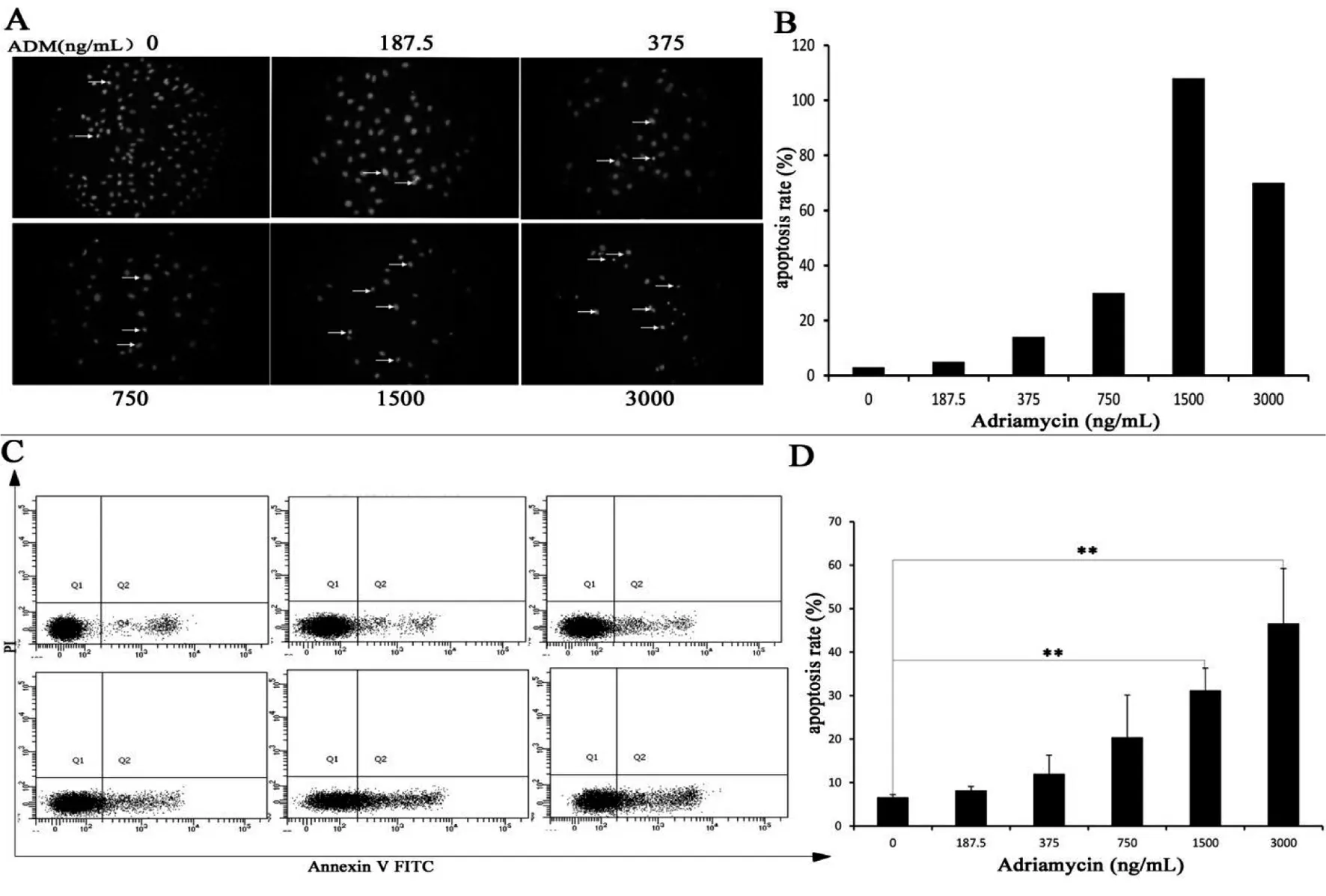
A & B:DAPI染色显示ADM诱导的KYSE450细胞凋亡(×400);

A & B:ADM对KYSE180细胞凋亡相关蛋白表达的影响;C & D:ADM对KYSE450细胞凋亡相关蛋白表达的影响。
3 讨 论
食管癌以淋巴转移为主,进行性吞咽困难为其典型表现,易侵犯气管、喉返神经、颈交感神经等周围组织器官,出现呼吸困难、疼痛呛咳等症状,难以耐受,终末期呈恶病质状态[16]。尽管外科手术和化疗能提高食管癌生存率,但由于广泛转移,复发和耐药的存在,5年生存率仅有20%~30%[4]。
肿瘤细胞的发生发展与细胞生长周期密切关联,S期是DNA合成关键期,从G1期进入S期意味着DNA复制的开始,细胞增殖活动的进行[15,17,20]。阿霉素属于蒽环类广谱抗肿瘤药物,作为一种拓扑异构酶抑制剂,主要通过抑制DNA复制,诱导肿瘤细胞死亡[21]。此外,阿霉素还可通过多种方式发挥抗肿瘤作用,如产生自由基,使DNA链断裂;影响转录过程;影响细胞周期等。虽然阿霉素对各时期的细胞均有抑制作用,但S期的细胞对阿霉素最为敏感。本实验结果表明,ADM可以阻滞KYSE180和KYSE450细胞于S期。与对照组相比,较高浓度下的阿霉素处理KYSE180和KYSE450细胞,S期细胞比率均升高,且KYSE180细胞升高更加明显,说明ADM更易诱导KYSE180细胞S期阻滞。肿瘤的发展不仅受细胞增殖过度的影响,也与细胞凋亡受抑有关[17]。本实验通过DAPI染色和Annexin V-FITC/PI双染均证实ADM可显著诱导KYSE450细胞凋亡,且呈浓度依赖性。在3 000 ng/mL的ADM作用48 h后,46.6%的KYSE450细胞发生了凋亡。在不同类型的肿瘤中细胞凋亡的方式和机制不完全相同。以往研究表明,ADM可以降低肺癌、肝癌、乳腺癌等肿瘤细胞的线粒体膜电位,诱导细胞凋亡[22-27],但本实验结果表明,在食管鳞癌KYSE180和KYSE450细胞中,高浓度ADM虽然可以在一定程度上降低线粒体膜电位,但差异无统计学意义,说明ADM诱导的食管鳞癌细胞凋亡可能并不需要线粒体膜电位的下降。其原因我们推测可能与肿瘤的类型有关。在细胞凋亡过程中,bcl-2家族和caspase家族最受关注[28]。杨建勇等发现,Bax基因能够增加肿瘤细胞对阿霉素的敏感性,可促进凋亡基因发挥作用[29]。本实验发现,阿霉素可上调Bax的水平,并激活KYSE450细胞内caspase-3,进而对PARP进行剪切,最终导致细胞凋亡。然而在KYSE180细胞中,ADM诱导的细胞凋亡伴随着Bax水平的下降,具体机制还需进一步揭示。
总之,本研究发现,ADM可显著抑制食管鳞癌的细胞增殖,诱导食管鳞癌细胞S期阻滞,并通过激活caspase-3诱导细胞凋亡。本研究为ADM用于食管鳞癌治疗提供了实验基础。本研究仅限于体外培养的食管鳞癌细胞株,体内的药效仍需进一步探究。

