局灶性脑缺血再灌注损伤对小鼠脑组织SUV39H1、H3K9及GFAP表达的影响
花向阳,卞尔保,张正伟,赵 兵
缺血性脑血管病是危害人类健康的主要疾病之一,大脑是最易受缺血等疾病影响的器官。大脑中动脉阻塞模型(middle cerebral artery occlusion model, MCAO模型)是模拟人类大脑出现缺血缺氧性脑损伤(hypoxic ischemic brain damage, HIBD)常用的实验动物模型[1-2]。组蛋白3赖氨酸9(histone 3 lysine 9, H3K9)的特异性甲基化转移酶(SUV39H1)属于人类SUV39家族,是最早发现的组蛋白甲基化转移酶,主要在异染色质中发挥作用,H3K9的甲基化与转录的抑制有关。但H3K9及其甲基化转移酶SUV39H1在脑缺血再灌注损伤时如何变化的相关研究国内尚未报道。胶质纤维酸性蛋白(glial fibrin acidic protein, GFAP)是星形胶质细胞的特异性标志物,几乎参与细胞内一切重要的生命活动。有报道[3]显示在脑缺血再灌注损伤后星形胶质细胞活化。该实验旨在研究小鼠脑部缺血再灌注损伤后对SUV39H1、H3K9及星形胶质细胞特异性标志物GFAP蛋白表达的影响。
1 材料与方法
1.1 主要材料选用45只18~25 g的清洁级成年雄性C57BL/6小鼠,购自安徽医科大学实验动物中心;水合氯醛购自中国天津市大茂化学试剂厂;2,3,5-氯化三苯基四氮唑(tripheny-Ltetrazo-lium chloride,TTC)购自北京Solarbio公司;连续变倍显微镜(型号:XTL-2400)购自深圳新高电子有限公司;兔抗KMT1A(SUV39H1)多克隆抗体、兔抗H3K9多克隆抗体、兔抗GFAP多克隆抗体购自中国Abcam有限公司;兔抗β-actin 多克隆抗体购自中国博奥森生物技术公司;山羊抗兔IgG/辣根过氧化物酶标记购自北京中杉金桥生物技术有限公司;BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶制配试剂盒及聚偏二氟乙烯膜(PVDF膜)采购自中国碧云天生物技术有限公司;CFX Connect Real-Time PCR仪及CFX Maestro检测系统购自美国BIO-RAD公司。
1.2 方法
1.2.1分组 将45只小鼠随机平均分为3组,分别为空白对照组、假手术组、脑缺血再灌注组(实验组)。空白对照组的小鼠不做任何处理;假手术组的小鼠仅寻找并分离出颈总动脉,不做缺血再灌注处理;实验组小鼠的缺血时间设定为2 h,2 h后行再灌注处理,时间为24 h。每组中各取6只小鼠处死取脑进行TTC染色以及梗死体积的测定,其余9只小鼠提取脑组织蛋白及RNA进行Western blot及qRT-PCR实验。
1.2.2MCAO模型的制作 本实验以Koizumi法[4-5]作为基础进一步改良建立脑缺血模型。小鼠腹腔注射4%水合氯醛(0.07 ml/10 g),待小鼠麻醉效果出现后,固定于显微操作台上,术中用电烤灯使小鼠肛温保持在36~37 ℃,小鼠颈部皮肤备皮,用碘伏消毒3次,在颈正中部做一长约1.5 cm的竖切口,在显微镜下钝性分离皮下组织及肌肉等,可见颈总动脉(common carotid artery,CCA)位于气管旁的颈动脉鞘内且有力的搏动,向上分离暴露出颈内动脉(internal carotid artery,ICA)、颈外动脉(external carotid artery,ECA),在 ECA的深面穿两根细线,ECA近心端打一个活结,远心端结扎,用微血管夹暂时夹闭CCA和ECA,在两线结之间剪一个小口,将准备好的线栓(0.1 mm栓线的头部包有硅橡胶,紫外灯下风干后酒精浸泡)沿ECA上切开的小口插入,解开ECA上的活结,朝着ICA方向缓慢插入,再向内侧、上方缓慢插入,栓线进线深度距CCA分叉处约10.0 mm,可感受到轻微阻力,此处即可将大脑中动脉(颅内动脉的主要动脉)阻塞,在ECA近心端打一死结从而固定栓线,完成后开始记录脑缺血的时间,用浸润生理盐水的无菌纱布覆盖于切口保持切口湿润,在缺血的2 h之间保持伤口的湿润及小鼠的肛温在36~37 ℃,2 h后缓慢的拔出线栓,用生理盐水冲洗伤口后缝合。假手术组小鼠仅做游离颈部血管,用浸润生理盐水的无菌纱布覆盖2 h后缝合切口。待小鼠麻醉清醒后进行Longa生物学行为评分,评分为5分制,1~3分视为模型成功。术后各小鼠单笼饲养,缺血再灌注24 h后将各组小鼠麻醉,迅速开颅取脑。
1.2.3Longa生物学评分 此评分常被用来评测小鼠的神经功能缺损症状。0分:小鼠的活动完全正常,无任何神经功能缺损症状;1分:轻度神经功能缺损,将小鼠提尾悬空,出现右侧前肢屈曲、抬高、肩部内收、肘关节伸直;2分:中度神经功能缺损,小鼠爬行时向缺血对侧转圈,侧推时左右推动的阻力不等;3分:重度神经功能缺损,缺血对侧肢体不能承受体重,站立时向右侧倾倒;4分:严重神经功能缺损,无自主活动、意识障碍或呈筒样滚动。其中0分缺损极轻,1~3分视为合格模型,4分为缺损过重,0分及4分均需剔除,将1~3分纳入试验标准。
1.2.4TTC染色 处死后的小鼠迅速(10 min内)取脑,置于0~4 ℃的PBS溶液中,-20 ℃冰箱冷冻30 min,置于脑槽中切取冠状位脑切片,厚度为2 mm,放入现配的1%TTC溶液中,37 ℃恒温水浴箱中避光染色30 min,每5 min轻轻晃动容器,使之充分染色,染色后取出脑片用PBS溶液洗涤3~5 min,用4%多聚甲醛室温固定2 h后取出摆放于蓝色背景下并拍照,TTC 染色可以使缺血梗死灶出现苍白色,正常脑组织染成红褐色,然后再利用图像分析软件Image J计算出梗死灶体积所占整个大脑体积的百分比。
1.2.5qRT-PCR分析 取各组小鼠左侧大脑组织,称量组织并加入TRIzol试剂后用匀浆器匀浆,完毕后低温离心、氯仿抽取、75%酒精洗涤、DEPC水溶解;进行RNA浓度测量、RNA定量、稀释、逆转录成cDNA;加入GFAP引物及SUV39H1引物后使用CFX Connect Real-Time PCR仪检测各组中GFAP及SUV39H1蛋白对应基因的相对表达情况。
1.2.6Western blot实验 取各组小鼠左侧大脑组织,按1 ∶10(0.01 g脑组织加0.1 ml)的比例计算蛋白裂解液总体积,RIPA裂解液和PMSF按100 ∶1的配比与剪碎的脑组织混合加入EP管中,用匀浆器匀浆,匀浆完毕后离心,取上清液移入新的EP管中,煮蛋白。煮蛋白前提取的总蛋白运用BCA试剂盒进行蛋白定量。提取后进行Western blot实验,制备SDS-PAGE凝胶(分离胶12%,浓缩胶5%),按上样量30 μg/20 μl的标准加样进行电泳(80 V、30 min;120 V、60 min),聚偏二氟乙烯膜(PVDF膜)湿转(200 mA、30 min/60 min),配置封闭液(含5%脱脂牛奶TBST封闭缓冲液),室温封闭90 min,β-actin(兔抗,1 ∶1 000)4 ℃过夜,GFAP(兔抗,1 ∶2 000)4 ℃过夜,KMT1A(兔抗,1 ∶1 000)4 ℃过夜,H3K9(兔抗,1 ∶1 000)4 ℃过夜。次日用辣根过氧化物酶标记的IgG(山羊抗兔,1 ∶10 000)室温孵育1h,完毕后运用Syngene Bio Imaging检测系统在暗室中曝光显色,检测各组小鼠脑组织SUV39H1、H3K9及GFAP的相对表达情况。
2 结果
2.1 各组小鼠的Longa评分比较实验组在Koizumi法模型的基础上进行改良线栓法制备小鼠MCAO模型,为比较各组小鼠神经功能的缺损情况,缺血2 h待麻醉清醒后进行了Longa评分。各组评分的结果表明:实验组小鼠的Longa生物学评分为2.53±0.64分,差异有统计学意义(P<0.05);空白对照组和假手术组的小鼠为0分,即无任何神经功能缺损表现。证明MCAO模型组小鼠的神经功能缺损症状明显重于空白对照组及假手术组。
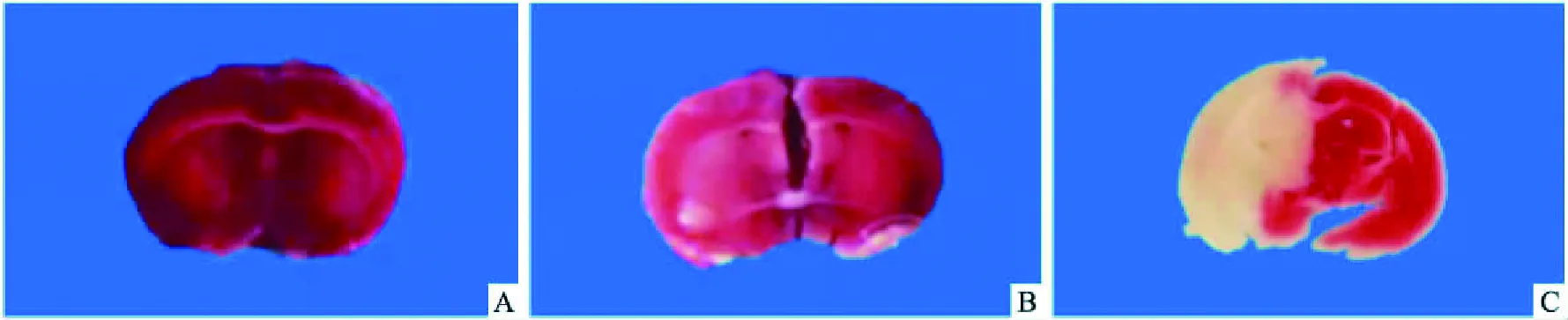
图1 各组小鼠脑组织切片TTC染色结果A:空白对照组;B:假手术组;C:MCAO模型组
2.2 小鼠脑切片TTC染色
2.2.1TTC染色情况 空白对照组小鼠可见双侧大脑质地均匀、形态对称,无苍白梗死灶,脑组织全部红染(图1A);假手术组小鼠脑组织也可见大脑几乎全部红染,大脑质地均匀、形态对称,无苍白梗死灶(图1B);MCAO模型组小鼠可见左侧大脑半球出现深入皮质区、纹状体及海马等区域的苍白色梗死灶,并且双侧大脑半球质地不均匀,形态不对称(图1C)。
2.2.2小鼠脑缺血梗死灶所占体积百分比分布情况 空白对照组:0%;假手术组:(0.41±0.25)%;MCAO模型组:(40.91±4.27)%。结果可见实验组小鼠脑梗死面积百分比明显高于假手术组,差异有统计学意义(F=16.81,P<0.05)。
2.3 qRT-PCR分析结果运用CFX Maestro检测系统,测定各组小鼠脑组织中SUV39H1及GFAP蛋白对应基因的表达情况, qRT-PCR结果表明,假手术组和MCAO模型组中SUV39H1蛋白对应基因的相对表达分别为(1.17±0.15)、(6.51±0.83);GFAP蛋白对应基因的相对表达分别为(1.14±0.17)、(10.44±1.43)。结果表明实验组SUV39H1基因表达量高于空白对照组,差异有统计学意义(F=21.57,P<0.001);GFAP基因表达量高于空白对照组,差异有统计学意义(F=21.72,P<0.001)。各组的SUV39H1、GFAP基因qRT-PCR结果见图2。
2.4 相关性分析运用Graphpad Prism 7.0统计软件,将各组小鼠脑组织中GFAP及SUV39H1蛋白对应基因的表达量进行相关性分析,分析结果表明,GFAP及SUV39H1蛋白对应基因的表达量成线性相关,具有统计学意义(r=0.9671,P<0.001);由此可以推测GFAP及SUV39H1基因的表达具有一定的关系。见图3。
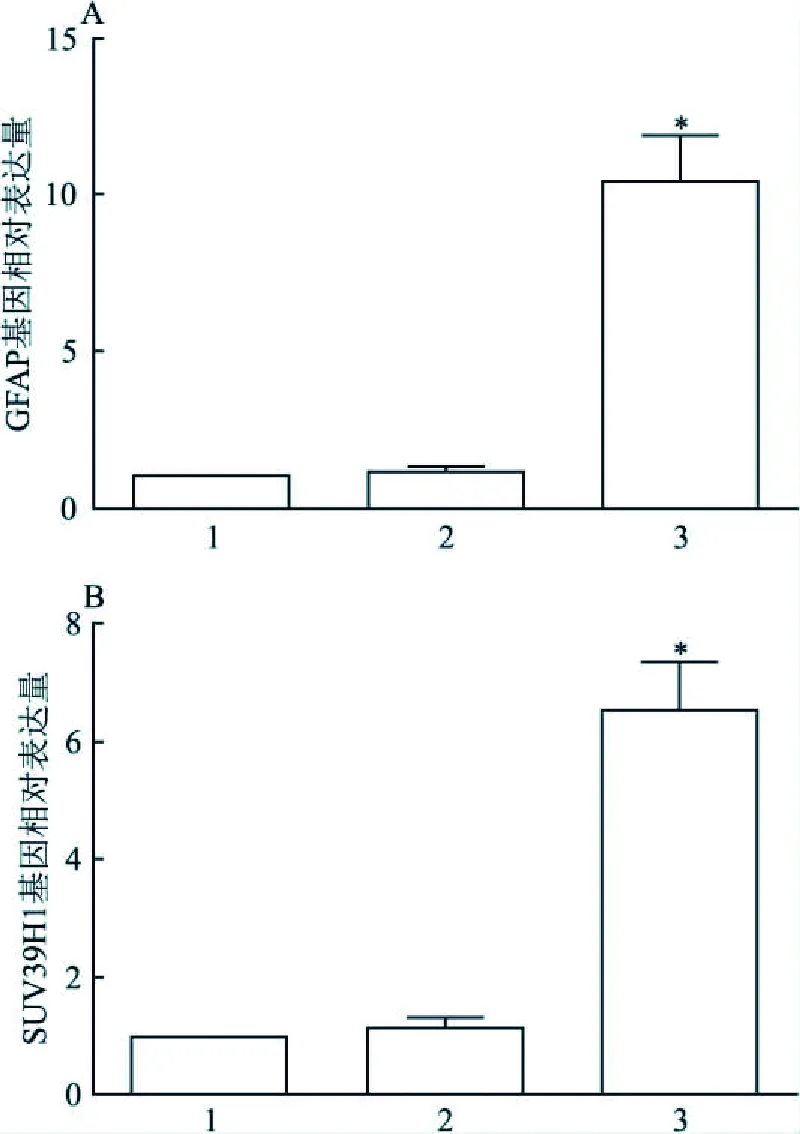
图2 各组小鼠脑组织GFAP、SUV39H1蛋白对应基因表达情况A:3组小鼠脑GFAP蛋白对应基因的表达;B:3组小鼠脑SUV39H1蛋白对应基因的表达;1: 空白对照组; 2: 假手术组; 3: 实验组;与空白对照组比较:*P<0.000 1
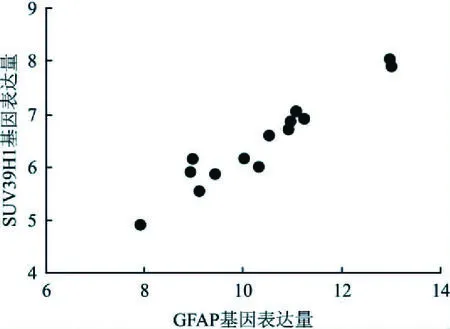
图3 小鼠脑组织GFAP、SUV39H1蛋白对应基因表达相关性
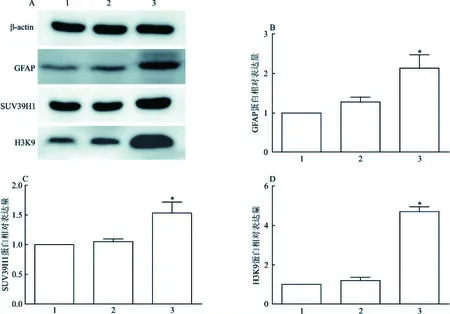
图4 各组小鼠脑组织SUV39H1、H3K9蛋白表达情况A: Western blot 检测3组小鼠脑β-actin、GFAP、SUV39H1、H3K9蛋白的表达; B: 3组小鼠梗死侧脑组织GFAP蛋白的相对表达情况; C: 3组小鼠梗死侧脑组织 SUV39H1蛋白的相对表达情况; D:3组小鼠梗死侧脑组织 H3K9蛋白的相对表达情况;1: 空白对照组; 2: 假手术组; 3: 实验组; 与空白对照组比较:*P<0.05
2.5 Western blot结果运用Syngene Bio Imaging检测系统,测定各组小鼠脑组织蛋白中SUV39H1(KMT1A)、H3K9及GFAP的表达情况,Western blot结果表明,假手术组和MCAO模型组中GFAP蛋白的相对表达分别为(1.28±0.12)、(2.13±0.34);SUV39H1蛋白的相对表达量分别为(1.05±0.04)、(1.53±0.19);H3K9蛋白的相对表达量分别为(1.20±0.16)、(4.71±0.22)。结果表明,实验组SUV39H1蛋白表达量高于空白对照组,差异有统计学意义(F=10.81,P<0.05);实验组H3K9蛋白表达量显著高于空白对照组,差异有统计学意义(F=3.31,P<0.05);实验组GFAP蛋白表达量高于空白对照组,差异有统计学意义(F=6.88,P<0.05)。各组的SUV39H1、H3K9及GFAP蛋白条带显影情况与结果一致。见图4。
3 讨论
在脑血管病中,缺血性脑血管病占关键地位,死亡率居高不下。许多不同的机制涉及到缺血诱导的细胞凋亡,包括兴奋毒性、氧化应激、炎症等[6],同时脑缺血也引起基因表达的变化,本研究的前提是MCAO模型的成功建立,故选择在Koizumi法的基础上建立MCAO模型,此方法的优点是操作对于小鼠的损伤较小,对脑组织的其他生理指标影响也不大,是目前建立MCAO模型运用最为广泛的造模手法。
有研究[7]发现,人类的一种具有SET结构域的染色体蛋白,可以抑制基因的转录,并定义为SUV39H1,与异染色质形成有关,异染色质在基因调控水平上具有重要作用。神经保护作用是基于基因的转录激活[8-10],同时Schweizer et al[11]研究发现,在体外建立氧葡萄糖剥夺模型模拟脑缺血再灌注模型时,SUV39H1在受敲除或药理抑制时,增加了脑源性营养因子的转录活性,从而对氧葡萄糖剥夺后的细胞具有明显的保护作用,脑源性营养因子在神经元的可塑性和存活中起着重要的作用,即抑制组蛋白甲基化水平的转录可以有效地促进神经元的存活。组蛋白H3K9及其甲基化转移酶SUV39H1在基因层面具有重大的意义,影响基因转录活性而不涉及DNA序列的表观遗传修饰改变。组蛋白甲基化属于一种翻译后的修饰,一般认为,H3K9与基因转录抑制相关,它可以通过使目的基因启动子处于紧密折叠的状态来阻止目的基因与转录因子、RNA聚合酶接触,阻止目的基因的转录[12]。同时Stewart et al[13]发现H3K9甲基化作为异染色质形成的标志,可以促进基因的沉默。H3K9甲基化可抑制组蛋白H3和H4乙酰化从而抑制转录,且组蛋白H3K9甲基转移酶SUV39H1可以结合到基因的启动子区域,抑制基因的表达。GFAP作为星形胶质细胞的主要标志物,几乎参与细胞内一切重要的生命活动。有报道[14]发现GFAP特异地存在于星形胶质细胞中并与星形胶质细胞的活性成正比。还有报道[3]称在脑缺血再灌注损伤后,缝隙连接会使星形胶质细胞形成功能合胞体,位于缺血中心区垂死细胞的凋亡信号通过星形胶质细胞网络传播,缺血中心区的其他有害成分也可以通过功能合胞体传播,同时在缺血的情况下,缺血中心区细胞内ATP迅速耗竭, 垂死的细胞通过星形胶质细胞形成的合胞体从附近活着的细胞中抢夺能量,从而导致更多的细胞因能量短缺而受损,进一步加重脑缺血造成的损伤。
综上所述,本研究显示,在成功建立MCAO模型的基础上,Longa行为学评分表明MCAO模型组因缺血导致的神经系统损伤症状比假手术组及空白对照组严重;在脑缺血再灌注损伤后SUV39H1、H3K9及GFAP的表达明显增加,提示组蛋白甲基化可能在局灶性缺血再灌注损伤中具有重要作用,据此推测SVU39H1表达量的增加会加重脑组织的进一步损伤;同时SUV39H1催化H3K9甲基化的过程变化,使H3K9在缺血再灌注中的表达量也大量增加,抑制基因的转录,但是抑制基因转录的具体过程以及其对脑组织缺血再灌注损伤的影响,有待于进一步研究;GFAP表达量的上升标志着星形胶质细胞的活跃,星形胶质细胞因脑缺血损伤刺激形成功能合胞体,促进凋亡信号的传播、有害成分的传递以及能量的消耗,从而使脑组织的损伤进一步加重。此外本研究只观察了SUV39H1、H3K9及GFAP的变化,探讨了初步的分子机制,推测SUV39H1、H3K9与星形胶质细胞活化密切相关,使脑组织缺血再灌注损伤进一步加重,但是SUV39H1以及H3K9对星形胶质细胞活化的具体作用机制尚待于深入研究。

