低氧条件下Akt抑制剂MK-2206增强胰腺癌细胞对吉西他滨敏感性的作用研究
骆广涛,汤为香,裘正军
胰腺癌是一种恶性程度极高、预后极差的消化系统肿瘤[1-2]。吉西他滨是目前治疗中晚期胰腺癌的一线化疗药物,但由于胰腺癌患者对吉西他滨存在固有及继发性耐药,临床上吉西他滨的疗效并不令人满意。因此,研究胰腺癌吉西他滨耐药的机制并寻找新的靶向治疗药物具有重要的临床意义。
低氧微环境是胰腺癌的典型特征之一[3]。有研究[4-5]表明低氧条件下胰腺癌细胞中低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)蛋白累积和Akt信号通路活化,导致胰腺癌细胞对吉西他滨耐药性增强。MK-2206是近年来发现的一种具有生物活性的口服变构类Akt抑制剂[6]。鉴于Akt信号通路在胰腺癌吉西他滨耐药中的重要作用,该研究使用MK-2206与吉西他滨联合用于探讨低氧条件下胰腺癌细胞对吉西他滨敏感性的改变。
1 材料与方法
1.1 主要细胞系和试剂人胰腺癌细胞系MIA PaCa-2、BxPC-3、PANC-1、AsPC-1、CAPAN-2、HPAF-Ⅱ及SW1990由本课题组长期保存。DMEM、RPMI-1640细胞培养基、磷酸缓冲盐溶液(PBS)及胎牛血清(FBS)购于美国Hyclone公司。MK-2206(货号:S1078)及吉西他滨(货号:S1149)购于美国SELLECK公司。二甲基亚砜(DMSO)购于北京鼎国昌盛公司。PAGE凝胶制备试剂盒购于上海熠晨公司。CCK-8购于日本同仁公司。人Total-Akt(Akt)、p-Akt(Ser473)及β-actin抗体、辣根过氧化酶标记的兔二抗和鼠二抗购于美国Cell Signaling Technology(CST)公司。低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)蛋白抗体购于美国BD公司。ECL化学发光检测试剂盒购于美国Millipore公司。
1.2 实验方法
1.2.1细胞培养 MIA PaCa-2、PANC-1、CAPAN-2及SW1990细胞在含10% FBS的DMEM培养基中常规培养。HPAF-Ⅱ细胞在含20% FBS的DMEM培养基中培养。BxPC-3和AsPC-1细胞在含10% FBS的RPMI-1640培养基中常规培养。常氧处理时,胰腺癌细胞置于细胞培养箱,培养条件为37 ℃、21% O2、5% CO2;低氧处理时,胰腺癌细胞置于低氧培养箱,培养条件为37 ℃、1% O2、5% CO2。
1.2.2Western blot法检测胰腺癌细胞低氧标志分子HIF-1α、p-Akt(Ser473)及Akt蛋白的表达改变 ① 首先课题组拟通过三气培养箱建立低氧微环境。将胰腺癌细胞系(MIA PaCa-2、BxPC-3、PANC-1、CAPAN-2及SW1990、HPAF-Ⅱ及AsPC-1细胞)在低氧条件下(氧气浓度1%)培养48 h,并以常氧条件培养(氧气浓度21%)的细胞作为对照,使用Western blot检测HIF-1α蛋白表达改变;② 为检测低氧条件下胰腺癌细胞中Akt信号通路的表达改变,本课题组将MIA PaCa-2、BxPC-3及PANC-1细胞置于常氧和低氧条件下培养48 h,使用Western blot检测MIA PaCa-2和BxPC-3细胞中p-Akt(Ser473)和Akt表达改变。 ③ 为探讨常氧及低氧条件下MK-2206对Akt信号通路的影响,本课题组查阅文献后选择1 μmol/L MK-2206处理胰腺癌细胞(MIA PaCa-2及BxPC-3)。常氧和低氧条件下使用1 μmol/L MK-2206分别处理MIA PaCa-2和BxPC-3细胞48 h,使用Western blot检测p-Akt(Ser473)、Akt的表达改变。
Western blot实验步骤如下:配制SDS-PAGE胶,分离胶浓度为10%,浓缩胶浓度为5%。用移液枪将蛋白样品缓慢加入到SDS-PAGE胶孔内进行电泳。电泳结束后,卸下胶板并组装“三明治”转膜装置开始转膜。转膜条件为300 mA、100 min。转膜结束后配制5%脱脂牛奶,常温摇床封闭膜1 h。封闭结束用TBS轻轻洗涤1次,4 ℃摇床用一抗(一抗浓度HIF-1α 1∶1 000, p-Akt 1 ∶1 000,Akt 1 ∶1 000, β-actin 1 ∶3 000)孵育过夜。次日回收一抗,TBS洗10 min,共3次。常温摇床用二抗(1 ∶5 000)孵育1 h,TBS洗10 min,共3次。ECL显影液A液和B液1 ∶1混合后,均匀铺在膜上,显影并保存曝光结果。
1.2.3CCK-8细胞毒性实验 常氧和低氧条件下MK-2206与吉西他滨联合处理胰腺癌细胞后使用CCK-8细胞毒性实验检测胰腺癌细胞对吉西他滨敏感性的改变。对数生长期细胞消化后离心,加入2 ml培养基重悬并进行细胞计数。用多通道移液枪斜贴着培养板加入100 μl细胞悬液(MIA PaCa-2 细胞每孔种5 000个细胞,BxPC-3细胞每孔种10 000个细胞),置于培养箱培养24 h。按照实验设定分为DMSO组、MK-2206组、吉西他滨组和MK-2206+吉西他滨组。根据实验分组向96孔板加入DMSO、MK-2206(1 μmol/L)、吉西他滨(10 μmol/L)和MK-2206(1 μmol/L)+吉西他滨(10 μmol/L),并设定空白对照和阴性对照,每个浓度3个复孔。细胞培养板置于常氧和低氧培养箱中孵育48 h后,每孔加入10 μl CCK-8试剂,孵育1 h后使用酶标仪测定450 nm处的光密度(optical density,OD)值。根据以下公式计算细胞活力,细胞活力=(实验组平均OD值-空白对照组平均OD值)/(阴性对照组平均OD值-空白对照组平均OD值)。
2 结果
2.1 低氧处理胰腺癌细胞后HIF-1α蛋白表达变化结果显示常氧培养的MIA PaCa-2细胞中HIF-1α蛋白几乎不表达,而低氧培养MIA PaCa-2细胞48 h后HIF-1α蛋白出现累积,为常氧组HIF-1α蛋白表达水平的3.55倍(经β-actin归一化),差异有统计学意义(t=13.614,P=0.005);BxPC-3细胞在常氧条件下HIF-1α蛋白出现少量累积,而低氧条件下培养BxPC-3细胞48 h后HIF-1α蛋白表达水平为常氧组HIF-1α蛋白的3.86倍(经β-actin归一化),差异有统计学意义(t=15.195,P=0.004)。此外, PANC-1、AsPC-1、CAPAN-2、HPAF-Ⅱ及SW1990等常见的胰腺癌细胞系在低氧条件下培养48 h后HIF-1α蛋白累积增加:其中低氧条件下PANC-1细胞HIF-1α蛋白表达水平是常氧的2.41倍(t=5.455,P=0.032);AsPC-1细胞HIF-1α蛋白表达水平是常氧的1.58倍(t=4.376,P=0.048);CAPAN-2细胞HIF-1α蛋白表达水平是常氧的2.14倍(t=11.549,P=0.007);HPAF-Ⅱ细胞HIF-1α蛋白表达水平是常氧的3.37倍(t=11.103,P=0.008);SW1990细胞HIF-1α蛋白表达水平是常氧的2.15倍(t=7.452,P=0.018)。见图1。上述结果表明通过三气培养箱成功构建起低氧微环境模型。
2.2 低氧条件下胰腺癌细胞Akt信号通路表达改变如图2所示,低氧条件下MIA PaCa-2细胞p-Akt(Ser473)表达水平升高;p-Akt(Ser473)/Akt的相对表达量(经β-actin归一化)是常氧环境的2.43倍,差异有统计学意义(t=7.544,P=0.017)。BxPC-3细胞在低氧条件下培养48 h后p-Akt(Ser473)的表达水平升高;p-Akt(Ser473)/Akt的相对表达量(经β-actin归一化)是常氧条件的3.24倍,差异有统计学意义(t=4.821,P=0.040)。此外,在PANC-1细胞中同样发现低氧条件下p-Akt (Ser473)表达水平较常氧增高,其p-Akt(Ser473)/Akt的相对表达量是常氧环境的31.33倍,差异有统计学意义(t=19.318,P=0.003),见图2。上述结果表明,胰腺癌细胞中Akt信号通路在低氧环境中活化。
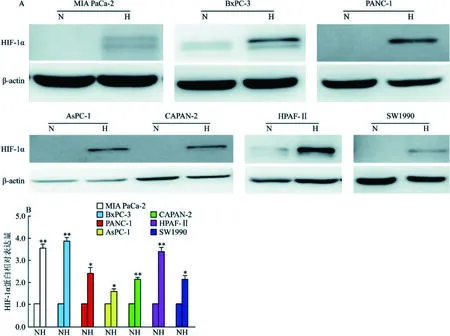
图1 胰腺癌细胞系在物理低氧处理后HIF-1α蛋白表达改变 A:胰腺癌细胞系在物理低氧(1% O2)处理48 h后HIF-1α蛋白表达改变;B:目的蛋白HIF-1α的灰度值以及对应条带的内参β-actin的灰度值(经β-actin归一化);N:常氧处理组; H:低氧处理组;与常氧处理组比较:*P<0.05,**P<0.01
2.3 低氧条件下MK-2206抑制胰腺癌细胞Akt信号通路活化如图3所示,常氧和低氧条件下1 μmol /L MK-2206能抑制MIA PaCa-2和BxPC-3细胞p-Akt(Ser473)的活化。常氧状态下MIA PaCa-2细胞经MK-2206处理后p-Akt(Ser473)/Akt的相对表达量(经β-actin归一化)是DMSO组的0.05倍,差异有统计学意义(t=4.185,P=0.000);低氧条件下MIA PaCa-2细胞经MK-2206处理后p-Akt(Ser473)/Akt的相对表达量(经β-actin归一化)是DMSO组的0.03倍,差异有统计学意义(t=5.553,P=0.000),见图3A、3C。BxPC-3细胞在常氧条件下经MK-2206处理后p-Akt(Ser473)/Akt的相对表达量(经β-actin归一化)是DMSO组的0.17倍,差异有统计学意义(t=2.103,P=0.001);低氧条件下BxPC-3细胞经MK-2206处理后p-Akt(Ser473)/Akt的相对表达量(经β-actin归一化)是DMSO组的0.07倍,差异有统计学意义(t=3.464,P=0.000),见图3B、3D。上述结果表明,在常氧和低氧条件下MK-2206能有效抑制胰腺癌细胞Akt信号通路活化。
2.4 低氧条件下MK-2206增强胰腺癌细胞对吉西他滨敏感性如图4A所示,低氧条件下MIA PaCa-2细胞MK-2206(1 μmol/L)与吉西他滨(10 μmol/L)联用组细胞活力为0.549±0.001,低于DMSO与吉西他滨(10 μmol/L)联用组0.632±0.017,差异有统计学意义(t=12.107,P=0.007);而常氧条件下MIA PaCa-2细胞MK-2206(1 μmol/L)与吉西他滨(10 μmol/L)联用组细胞活力为0.610±0.033,与DMSO和吉西他滨(10 μmol/L)联用组0.556±0.018,差异无统计学意义(t=2.525,P=0.128),见图4A。在BxPC-3细胞中同样发现与DMSO和吉西他滨(10 μmol/L)联用组(细胞活力为0.594±0.106)相比,低氧条件下MK-2206(1 μmol/L)与吉西他滨(10 μmol/L)联用组细胞活力降低(细胞活力为0.508±0.041),差异有统计学意义(t=5.363,P=0.033),见图4B。综上结果表明,低氧条件下使用MK-2206抑制Akt信号通路后能增强胰腺癌细胞对吉西他滨敏感性。
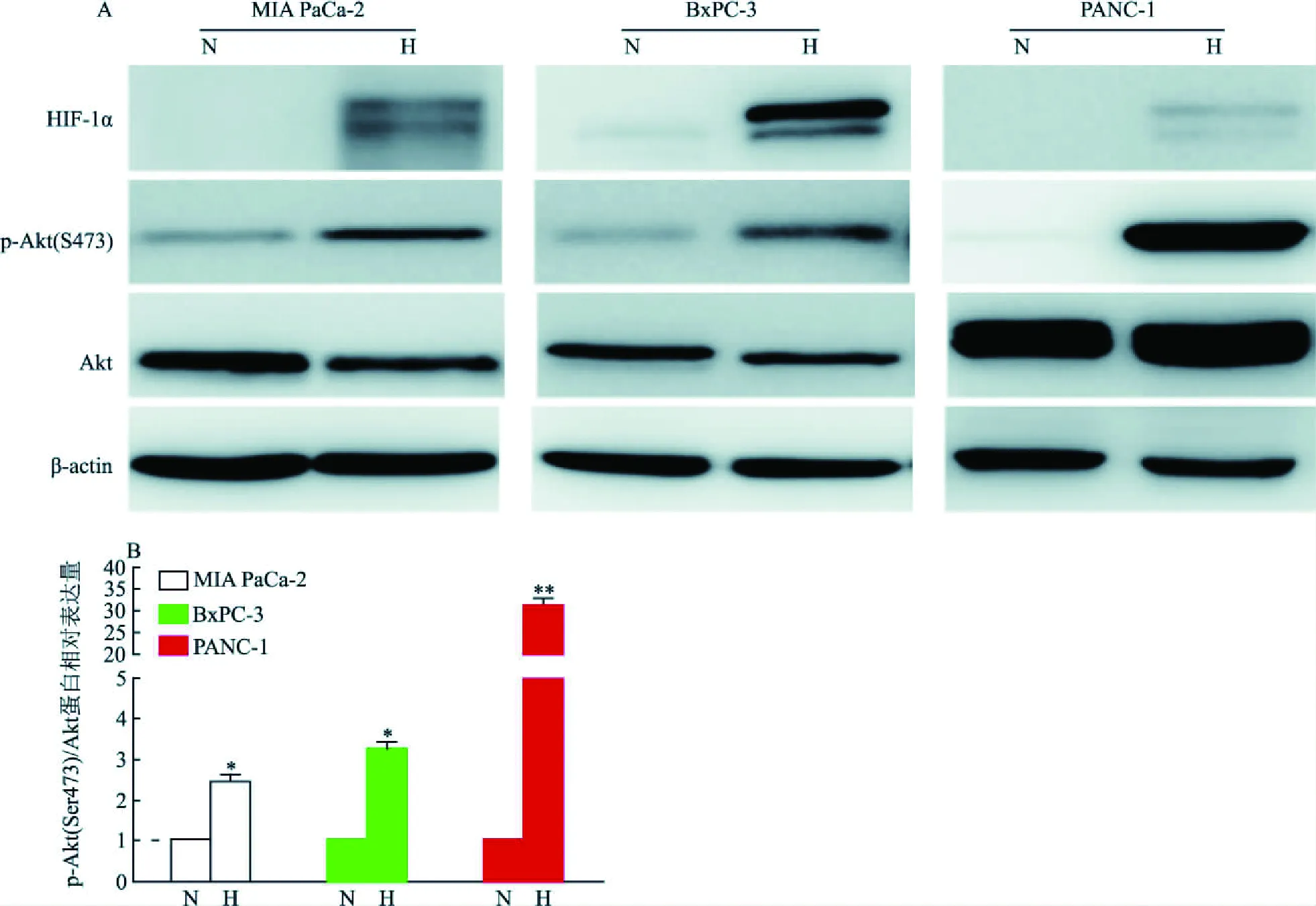
图2 低氧条件下胰腺癌细胞中p-Akt(Ser473)表达改变A:MIA PaCa-2、BxPC-3及PANC-1细胞在常氧(N)和低氧(H)条件下培养48 h后p-Akt(Ser473)的表达改变;B:目的蛋白p-Akt、Akt的灰度值以及对应条带的内参β-actin的灰度值(经β-actin归一化);与常氧处理组比较:*P<0.05,**P<0.01
3 讨论
Akt信号通路的异常活化与胰腺癌吉西他滨耐药密切相关[7]。因此,针对Akt信号通路所研发的靶点抑制剂被认为是具有潜在逆转吉西他滨耐药作用,具有巨大的研究价值以及良好的临床应用前景。MK-2206 是近年来发现的一种新型具有生物活性口服变构类Akt抑制剂。在本研究中课题组发现MK-2206可在体外有效抑制胰腺癌细胞Akt信号通路的活化;此外本课题组还发现MK-2206能抑制胰腺癌细胞增殖(本文未显示相关数据)。这与文献[8]报道MK-2206可以抑制肿瘤细胞增殖结论相符,即MK-2206能有效抑制肿瘤细胞内Akt信号通路活化,发挥抗肿瘤增殖效应。
已经证实低氧恶劣环境下Akt信号通路参与到肿瘤细胞上皮间充质转化(epithelial-mesenchymal transition,EMT)、侵袭转移以及化疗耐药过程[5,9-10]。Yokoi et al[5]首次发现低氧条件下胰腺癌细胞对吉西他滨耐药性增强。本课题组前期研究[11]证实低氧条件下胰腺癌细胞对吉西他滨耐药性增强,这与Yokoi et al[5]的研究结果相符。Yokoi et al[5]进一步研究表明其可能的机制是由于低氧激活了PI3K/Akt信号通路;使用PI3K/Akt信号通路抑制剂LY294002能逆转胰腺癌细胞对吉西他滨的耐药性。在本研究中本课题组发现低氧条件下胰腺癌细胞中Akt信号通路活化;此外,低氧条件下MK-2206能有效抑制Akt信号通路的活化并能增强胰腺癌细胞对吉西他滨的敏感性。
已经有文献[12-13]表明MK-2206能作为肿瘤细胞化疗增敏剂发挥作用。Jin et al[12]发现MK-2206能有效抑制胃癌细胞内Akt信号通路活化,并抑制细胞增殖;进一步研究发现MK-2206与阿霉素或5-氟尿嘧啶(5-Fu)联用能增强胃癌细胞对阿霉素及5-Fu的敏感性。Whicker et al[13]发现MK-2206能抑制顺铂诱导的卵巢癌细胞Akt信号通路活化而发挥化疗增敏剂的作用。上述研究均为MK-2206成为未来临床肿瘤化疗辅助药物提供了有力支持。
尽管本研究显示低氧条件下MK-2206能抑制Akt信号通路活化及增强胰腺癌细胞化疗敏感性,但其作用于体内还应考虑很多因素,例如药物吸收、分布及代谢等。因此,MK-2206能否用于胰腺癌患者目前还不能确定。此外,本研究仅选用了药物的单一浓度(MK-2206 浓度为1 μmol/L;吉西他滨浓度为 10 μmol/L),未进行MK-2206与吉西他滨联合比例的实验研究。在未来的研究中本课题组将通过体内实验进一步探讨MK-2206对胰腺癌吉西他滨敏感性的影响。
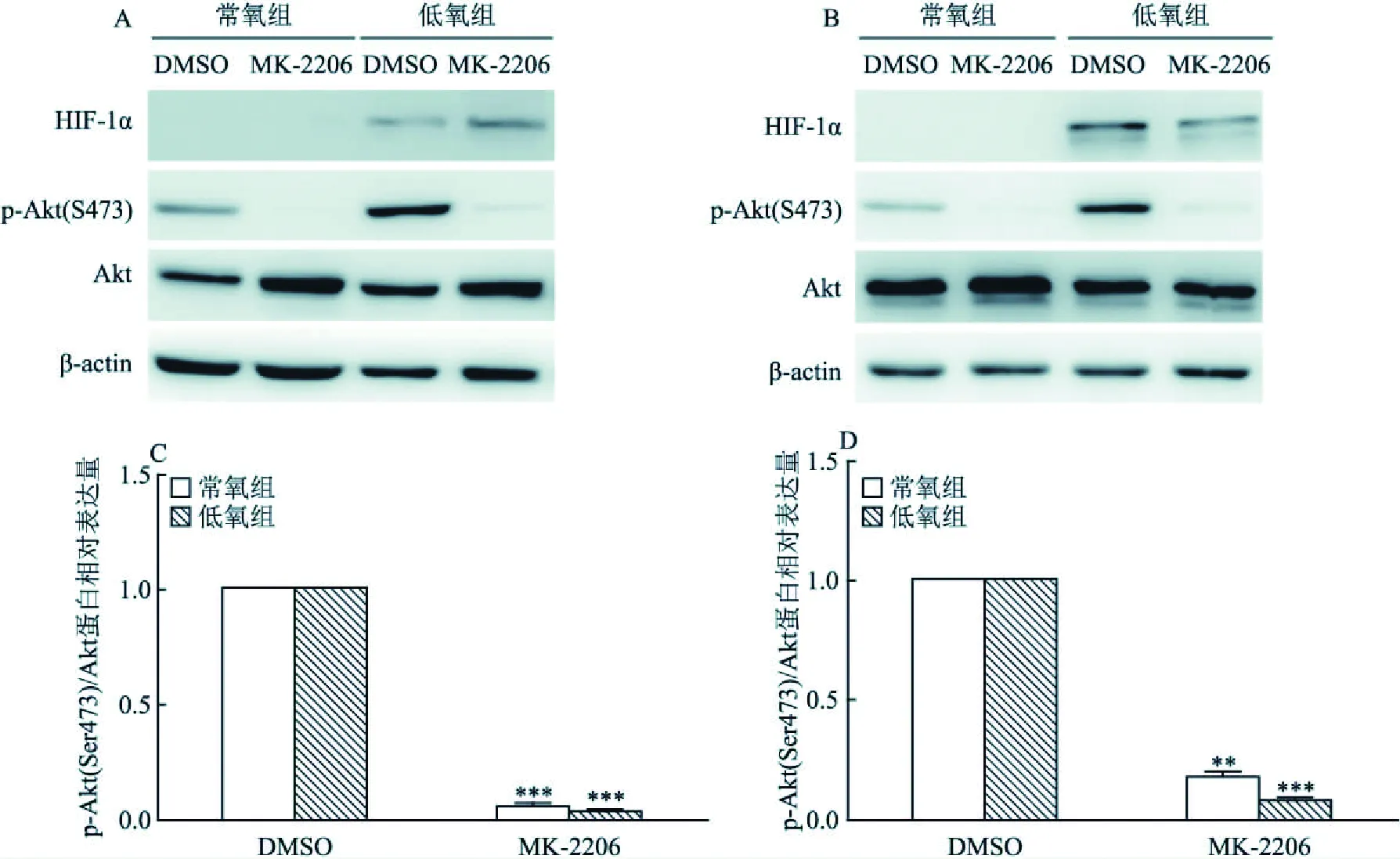
图3 常氧和低氧条件下MIA PaCa-2和BxPC-3细胞经MK-2206处理后p-Akt的表达改变A、B:MIA PaCa-2和BxPC-3细胞经1 μmol/L MK-2206处理后置于常氧和低氧条件下培养48 h后p-Akt、Akt和HIF-1α蛋白表达;C、D:MIA PaCa-2和BxPC-3细胞中目的蛋白p-Akt、Akt的灰度值以及对应条带的内参β-actin的灰度值(经β-actin归一化);与DMSO处理组比较:**P<0.01,***P<0.001
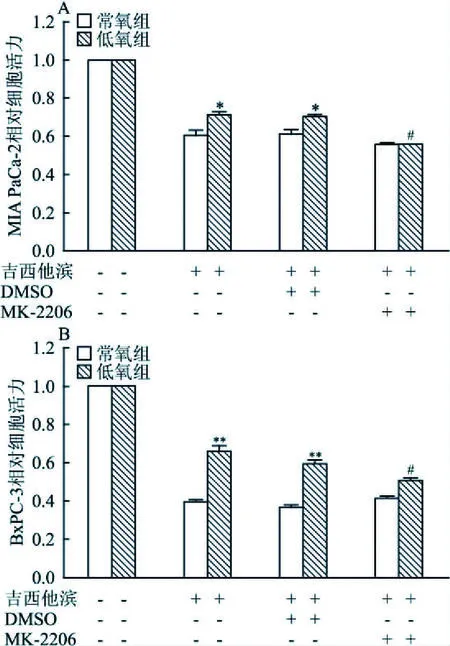
图4 MK-2206和吉西他滨联用后增强MIA PaCa-2和BxPC-3细胞对吉西他滨敏感性A:MIA PaCa-2细胞;B:BxPC-3细胞;与常氧处理组比较:*P<0.05,**P<0.01;与DMSO处理组比较:#P<0.05

