高效液相色谱测定抗坏血酸对映体色谱柱选择
杜瑞 关炳峰 尹红娜 王珂 孙茜茜 陈世伟
摘要[目的]选择L-抗坏血酸和D-异抗坏血酸在高效液相色谱分离中最佳色谱柱。[方法]对比C18柱、HILIC酰胺柱、HILIC聚合物柱、HILIC硅胶柱、氨基柱和氰基柱6种色谱柱填料分析抗坏血酸对映体的分离度和流动相。[结果]HILIC酰胺柱分离度最大,为4.84;其次为氨基柱,分离度为2.80;流动相为0.1%磷酸水和乙腈。[结论]HILIC酰胺柱为分析抗坏血酸对映体的最合适色谱柱填料。
关键词高效液相色谱;L-抗坏血酸;D-异抗坏血酸;色谱柱
中图分类号O657.7+2文献标识码A
文章编号0517-6611(2020)04-0196-03
doi:10.3969/j.issn.0517-6611.2020.04.057
开放科学(资源服务)标识码(OSID):
Determination of Ascorbic Acid Enantiomer Column by High Performance Liquid Chromatography
DU Rui,GUAN Bing-feng,YIN Hong-na et al(Henan Commerce Science Institute Co.,Ltd.,Zhengzhou,Henan 450002)
Abstract[Objective]L-ascorbic acid and D-ascorbic acid were selected as the best chromatographic columns for HPLC separation.[Method]The C18 column,HILIC amide column,HILIC polymer column,HILIC silica column,amino column and cyano column were compared to analyze the ascorbic acid enantiomer resolution and mobile phase.[Result]The highest resolution of the HILIC amide column was 4.84;the second was the amino column with a resolution of 2.80;the mobile phase was 0.1% phosphoric acid water and acetonitrile.[Conclusion]HILIC amide column is the most suitable column packing for the analysis of ascorbic acid enantiomers.
Key wordsHPLC;L-ascorbic acid;D-isoascorbic acid;Chromatographic column
L-抗壞血酸(L-ascorbic acid)又称维生素C(Vitamin C),学名L-3-氧代苏己糖醛酸内酯[1]。L-抗坏血酸在人体内不能合成,主要存在于蔬菜和水果中,天然具有抗氧化性质,是一种营养强化剂和食品添加剂,广泛用于食品加工和保健品行业中[2-3]。D-异抗坏血酸(D-isoascorbic acid)是L-抗坏血酸的对映异构体,与L-抗坏血酸化学性质相似,但生理活性仅有L-抗坏血酸的1/20[4]。D-异抗坏血酸作为食品抗氧化剂和肉制品的防腐助色剂[2,5-6],但摄入过多会造成白细胞的抗病能力下降,使人体受到伤害[7]。
由于L-抗坏血酸、D-异抗坏血酸生理活性不同,因此对抗坏血酸对映异构体分析十分重要。在手性分析中,常用的分离手段有毛细管电泳法[8-10]和高效液相色谱法[11-15]。毛细管电泳分离方法虽然有很高的手性分析能力,但与HPLC相比柱容量小,造成不宜大体积高浓度进样;并且在食品安全检测方面,毛细管电泳没有高效液相色谱普及率高。笔者采用HPLC法测定抗坏血酸对映体,考察不同色谱填料(C18、HILIC、NH2、CN)对抗坏血酸对映体分离的影响。
1材料与方法
1.1材料与试剂
L-抗坏血酸标准品(阿尔塔科技有限公司);D-异抗坏血酸标准品(阿尔塔科技有限公司);偏磷酸、磷酸三钠、磷酸二氢钾、磷酸(分析纯,阿拉丁试剂);十六烷基三甲基溴化铵(色谱纯,阿拉丁试剂);甲醇(色谱纯,迪马科技);乙腈(色谱纯,迪马科技)。偏磷酸溶液(20 g/L):称取20 g偏磷酸,溶于水定容至1 000 mL;0.1%磷酸水溶液:吸取磷酸1mL,加一级水定容至1 000 mL。
1.2仪器与设备
Agilent 1290 高效液相色谱仪,配二极管阵列检测器(美国安捷伦公司)。Agilent 1260 高效液相色谱仪,配二极管阵列检测器(美国安捷伦公司)。色谱柱:Poroshell 120 HILIC,3.0 mm×150mm×2.7 μm(美国安捷伦公司);Accucore150 酰胺 HILIC,4.6 mm×150 mm×2.6 μm(美国Thermo Scientific公司);Polyamino-HILIC,4.6 mm×250mm×5 μm(迪马科技);ZORBAX Eclipse XDB-CN,4.6 mm×150 mm×5 μm(美国安捷伦公司);Ultimate XB-NH2,4.6 mm×250 mm×5 μm(月旭科技);Diamonsil Plus C18,4.6 mm×250mm×5 μm(迪马科技) 。
1.3方法
1.3.1色谱条件。
色谱柱 C18:流动相A为6.8 g磷酸二氢钾和0.91 g十六烷基三甲基溴化铵,用水溶解并定容至1 L(用磷酸调pH 至2.5~2.8);流动相B为100%甲醇;A+B(98+2)。氨基柱、HILIC、氰基柱:流动相A(0.1%磷酸)+B(乙腈)。检测波长245 nm。
1.3.2标准溶液配制。色谱柱 C18:准确称取L-抗坏血酸、D-异抗坏血酸0.01 g(精确至0.01 mg),用20 g/L的偏磷酸溶液定容至10 mL。氨基柱、HILIC、氰基柱:准确称取L-抗坏血酸、D-异抗坏血酸0.01 g(精确至0.01 mg),用0.1%的磷酸水溶液定容至10 mL。
2结果与分析
2.1色谱条件比对
C18色谱柱是实验室常用色谱柱,采用C18分析抗坏血酸对映体过程中,由于抗坏血酸是多羟基化合物,极性大,在C18色谱柱上不保留;在分析检测过程中,通常加入表面活性剂(十六烷基三甲基溴化铵)和缓冲盐(磷酸二氢钾)来改善色谱行为。HILIC亲水作用色谱柱在液相色谱柱中常用来分析强极性和强亲水化合物,常用流动相是水和乙腈,并且乙腈相比例高于60%。
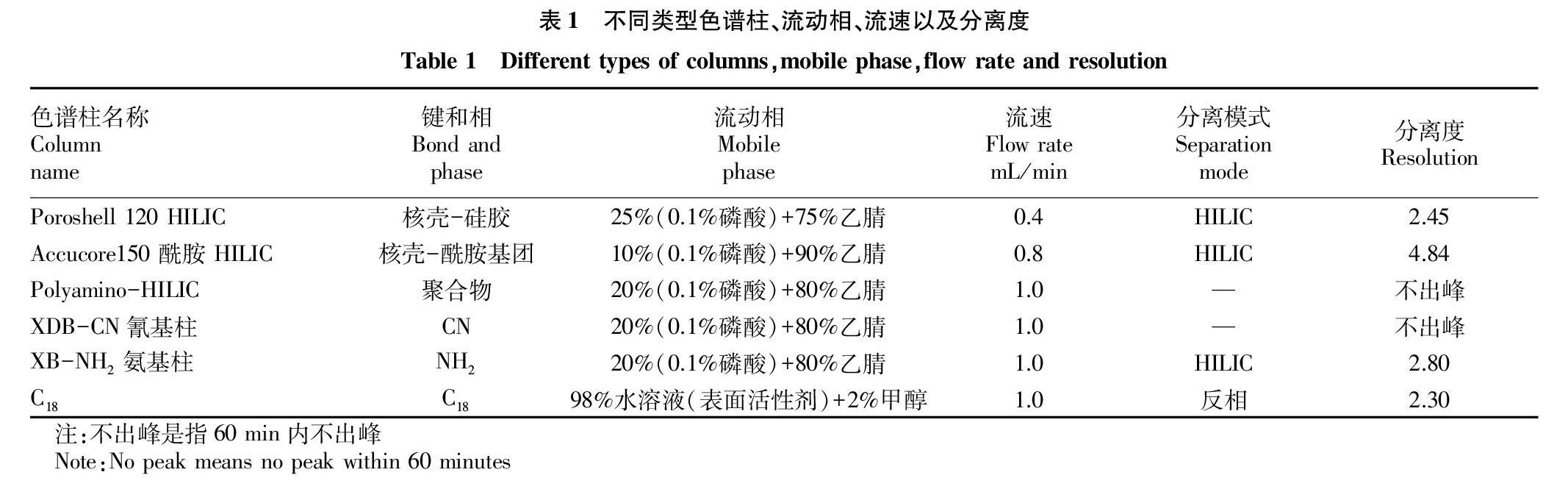
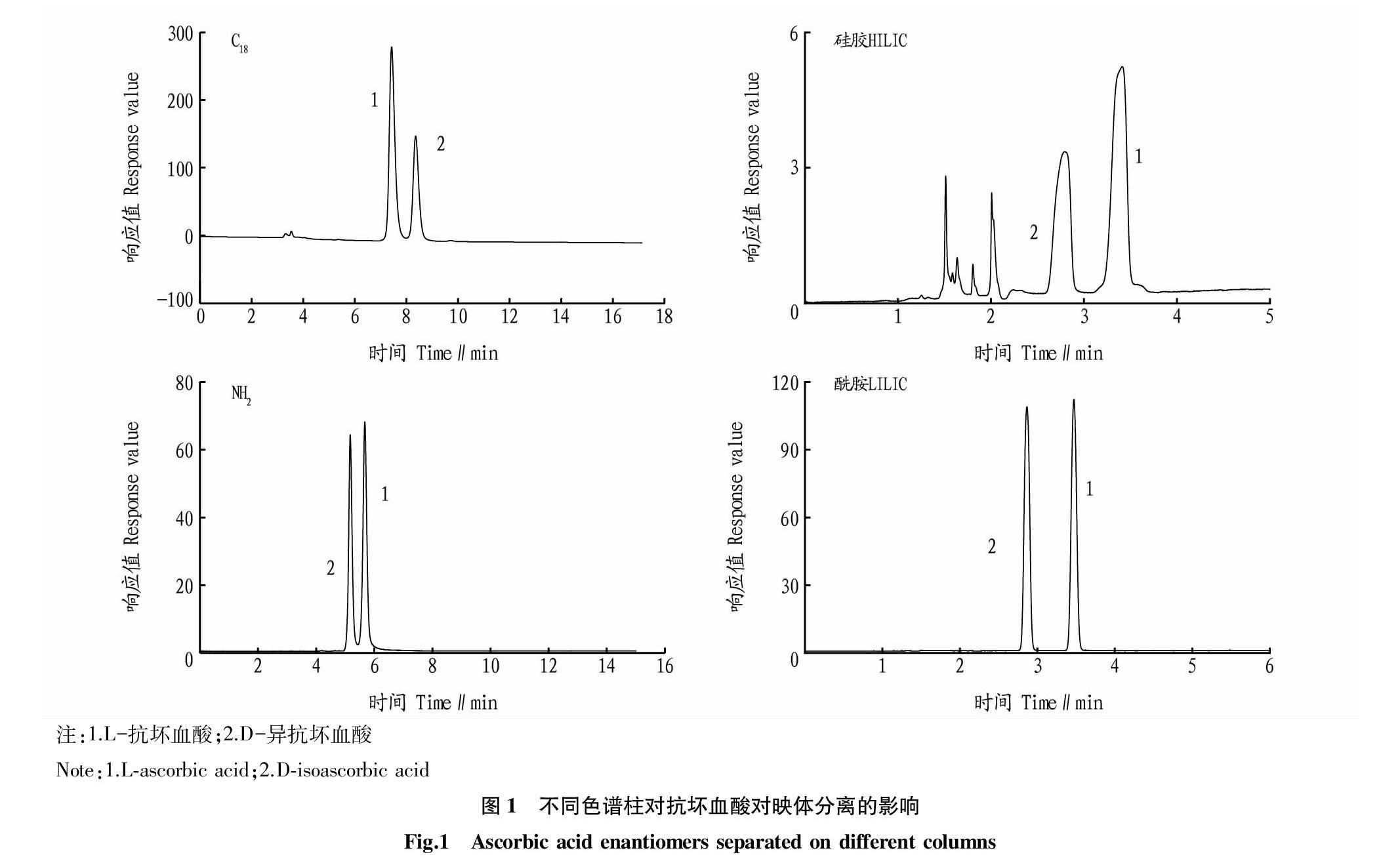
从表1可以看出,在抗坏血酸对映体分析过程中,采用反相模式的是C18色谱柱;采用HILIC 模式的是HILIC硅胶柱、HILIC酰胺柱和NH2柱;而HILIC聚合物柱不出峰。HILIC酰胺柱分离度最大,为4.84;而C18色谱柱分离度最小,为2.30。
从图1可以看出,在不同分离模式下,L-抗坏血酸、D-异抗坏血酸出峰顺序发生变化;反相模式下,L-抗坏血酸先出峰,D-异抗坏血酸后出峰;而在HILIC模式条件下,出峰顺序相反,D-异抗坏血酸先出峰。这主要是由于在反相模式下,流动相采用98%水相;而HILIC模式条件下,流动相采用75%以上的有机相。
在反相模式下,流动相中加入离子对试剂,在运行过程中容易产生气泡,导致基线不稳,影响定性和定量;离子试剂会对色谱柱带来不可逆转的破坏,影响色谱柱寿命。流动相中加入高浓度缓冲盐,长时间运行,会造成液相流路中缓冲盐析出,造成流路堵塞,影响仪器寿命。流动相为高比例水相(98%),常规C18色谱柱长时间使用会造成色谱柱填料“疏水塌陷”,致使色谱柱柱效降低,寿命缩短。因此需要选择在C18色谱固定相键和过亲水基团的色谱柱,但会增加实验室成本。
在HILIC工作条件下,固定相表面会首先建立一个富集水的液体层,待分析物在流动相和亲水层之间进行分配,从而实现分离,其中氢键作用和偶极矩作用是影响保留强弱的主要因素。HILIC固定相的作用主要是固定水,若固定相带电荷,则离子静电作用也会影响化合物在色谱柱保留。对照3种不同类型HILIC(硅胶基质、酰胺基质、聚合物基质)色谱柱,L-抗坏血酸、D-异抗坏血酸的色谱行为差别很大。在HILIC酰胺色谱柱上,抗坏血酸对映体基线分离,且峰型窄而尖;在HILIC硅胶色谱柱上,抗坏血酸对映体基线分离,但响应值很低,且峰型很宽。HILIC聚合物基质色谱柱上,抗坏血酸对映体60 min内不出峰,主要是由于该款色谱柱填料是由乙烯醇多孔聚合颗粒上键合氨基官能团,耐碱性强,而试验条件流动性为酸性。氨基柱在乙腈-水体系中,在高乙腈条件下可以作为HILIC亲水作用色谱固定相。
2.2HILIC模式下流動相比例对拆分的影响
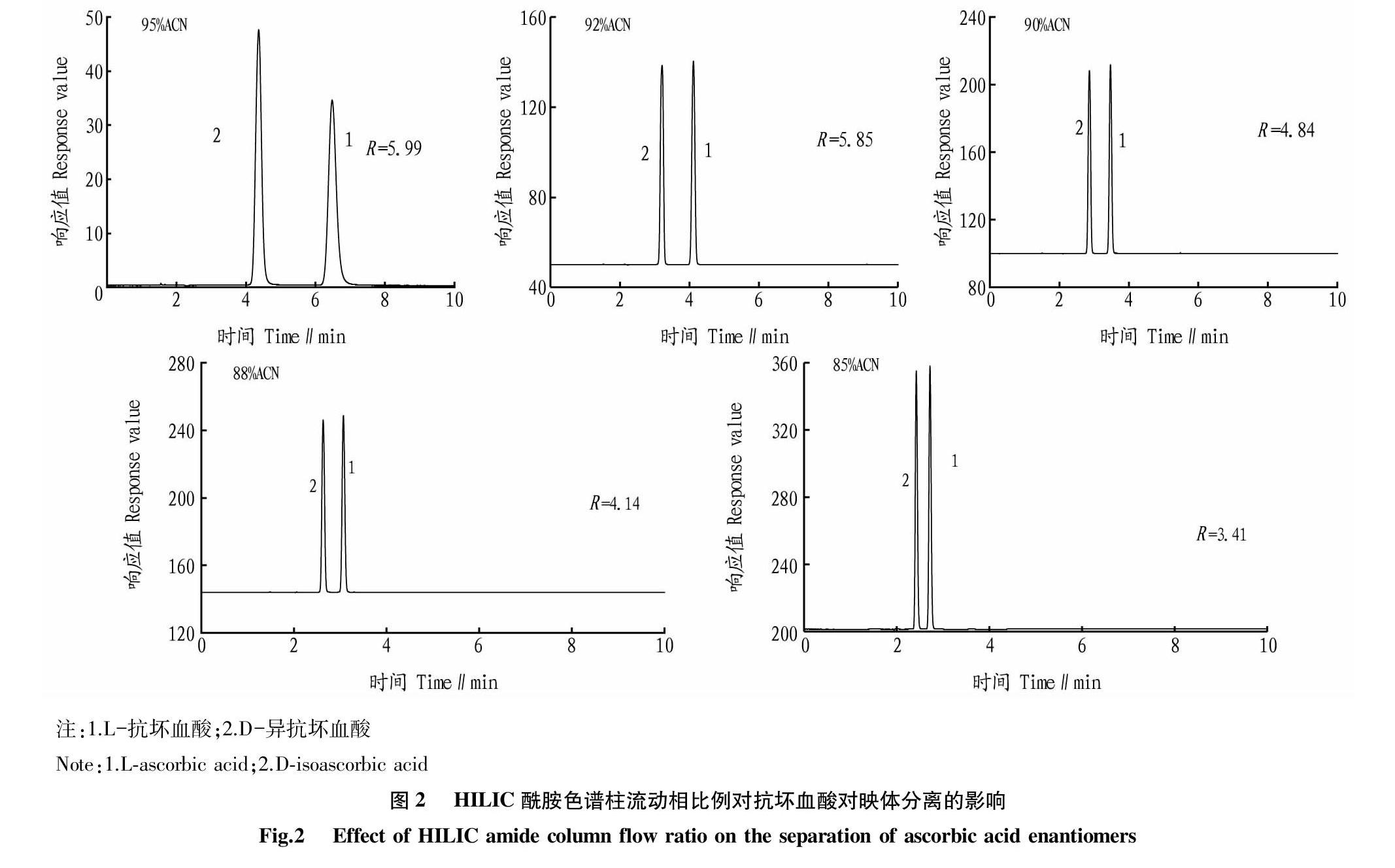
HILIC酰胺色谱柱在乙腈条件下获得很好的分离效果。以乙腈-0.1%磷酸水溶液为流动相,如图2所示,通过增加流动相中乙腈的比例(85%~95%),抗坏血酸对映体分离度增加,但响应值降低。结合抗坏血酸对映体分离度和响应值,HILIC酰胺色谱柱最佳流动相条件为乙腈+0.1%磷酸水(90+10)。
氨基柱在乙腈-水体系下,高乙腈条件下,表现为HILIC模式。试验发现,乙腈比例在75%~80%,分离度和响应值均满足色谱分离要求(图3)。
3结论
从抗坏血酸对映体分离度方面来讲,HILIC酰胺柱、氨基柱和C18色谱柱都能实现基线分离,且分离度均大于2。其中HILIC酰胺柱分离度最高,其次为氨基柱。从流动相方面角度,HILIC酰胺柱和氨基柱,流动相为0.1%磷酸水和乙腈,无需添加离子对试剂和高浓度的缓冲盐,流动相成本更低,前处理简单,对仪器的损伤更小。因此,在实验室分析测定抗坏血酸对映体时,可以优先选择HILIC酰胺柱,其次为氨基柱。
参考文献
[1] 马慧婷,孙芳,彭鹏,等.抗坏血酸与水的相互作用研究[J].化学研究,2017,28(1):92-96.
[2] 李军明,张军.体内维生素的生理功能和日常保健的科学合理摄取[J].中国食物与营养,2009(3):53-55.
[3] 中华人民共和国国家卫生和计划生育委员会.食品安全国家标准 食品添加剂使用标准:GB 2760—2014 [S].北京:中国标准出版社,2014.
[4] 吴春敏,江芳,金鸣,等.维C 银翘片中D-(-)-异抗坏血酸的结构鉴定与筛查[J].中国医学杂志,2012,47(4):300-302.
[5] 周强,魏转,孙文敬,等.D-异抗坏血酸生产技术研究进[J]. 食品科学,2008,29(8):647-651.
[6] 张秀芹,王敏,顾莹,等.HPLC 检测食品中L-抗坏血酸、D-异抗坏血酸及抗坏血酸总量[J].中国卫生检验杂志,2013,23(9):2056-2058,2061.
[7] 刘明霞,周强,陈卫平.D-异抗坏血酸的生产应用现状及前景[J].食品工业科技,2013,34(2):376-381.
[8] 潘聪洁,王伟峰,陈兴国.毛细管电泳在手性化合物分离中的应用进展[J].色谱,2016,34(1):16-20.
[9] 吕迎春,樊竹青,侯云洪.毛细管电泳法分离6种手性化合物[J].云南化工,2014,41(2):13-16.
[10] 吕力琼,步知思,童胜强.多手性中心药物色谱拆分研究进展[J].中国现代应用药学,2018,36(9):1431-1436.
[11] 国家卫生和计划生育委员会.食品安全国家标准 食品中抗坏血酸的测定:GB 5009.86—2016[S].北京:中国标准出版社,2016.
[12] 吉林省质量技术监督局.饮料中抗坏血酸和D-异抗坏血酸的测定 高效液相色谱法:DB 22/T1824—2013[S].吉林省质量技术监督局,2013.
[13] 吉林省卫生厅.食品安全地方标准 食品中D-异抗坏血酸的测定 高效液相色谱法:DBS 22/001—2012 [S].吉林省卫生厅,2012.
[14] ZUO R T,ZHOU S,ZUO Y G,et al.Determination of creatinine,uric and ascorbic acid in bovine milk and orange juice by hydrophilic interaction HPLC[J].Food chemwastry,2015,182:242-245.
[15] 熊小婷,谭建华,李慧勇,等.HPLC-DAD法同时测定化妆品中的3种抗坏血酸类功效成分[J].分析试验室,2016,35(4):410-413.

