微生物降解土壤中多环芳烃的研究进展
吕鑫 孙延瑜 闵军 胡晓珂 马莲菊


摘要 多环芳烃(polycyclic aromatic hydrocarbons,PAHs)在土壤中分布广泛且存留時间长。利用理化手段去除PAHs不仅价格昂贵,还会对土壤、沉积物以及地下水层等自然环境造成二次污染。生物修复主要是利用微生物代谢多样性降解有害污染物,被认为是最具有前景的修复技术。目前已分离鉴定出多种微生物具有降解PAHs的能力。为了更好地应用微生物修复土壤及环境中的PAHs污染,需要更加深入了解降解过程中微生物代谢途径的生理生化以及分子遗传机制。综述了土壤中多环芳烃的微生物降解,在前人研究的基础上,阐述了不同降解途径对不同分子量多环芳烃的生物代谢转化机理,为提高土壤中降解菌的生物修复能力提供了理论依据。
关键词 多环芳烃;微生物降解;土壤
中图分类号 X 172文献标识码 A
文章编号 0517-6611(2020)04-0001-07
doi:10.3969/j.issn.0517-6611.2020.04.001
开放科学(资源服务)标识码(OSID):
Review on the Microbial Degradation of Polycyclic Aromatic Hydrocarbons in Soil
L Xin1,2,3,SUN Yan-yu2,3,MIN Jun2,3 et al (1.Shenyang Normal University,Shenyang,Liaoning 110034;2.Key Laboratory of Coastal Biology and Bioresource Utilization,Yantai Institute of Coastal Zone Research,Chinese Academy of Sciences,Yantai,Shandong 264003; 3.Qing-dao Marine Science and Technology Pilot National Laboratory,Marine Biology and Biotechnology Functional Laboratory,Qingdao,Shandong 266237)
Abstract Polycyclic aromatic hydrocarbons (PAHs) are widely distributed in soil and remain for a long time.The use of physical and chemical means to remove PAHs is not only expensive,but also causes secondary pollution to the natural environment such as soil,sediment and groundwater.Bioremediation is mainly the use of microbial metabolic diversity to degrade harmful pollutants,which is considered to be the most promising repair technology.
At present,many microorganisms have been isolated and identified to have the ability to degrade PAHs.In order to better apply microbial remediation of soil and environmental PAHs pollution,it is necessary to further understand the physiological-biochemical and molecular genetic mechanisms of microbial metabolic pathways during degradation.This paper reviewed the microbial degradation of PAHs in soil,elaborated the transformation of mechanisms under different degradation of biological and metabolic pathways for different molecular weight PAHs,which provided a theoretical basis for enhancing the bioremediation ability of degrading bacteria in soil.
Key words Polycyclic aromatic hydrocarbons;Microbial degradation;Soil
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是指具有2个以上苯环的一类有机化合物,PAHs有着分布范围广、污染种类多的特点。随着工业化发展进程不断加快,石油污染和泄漏在开采、加工、运输过程中频繁发生,并在土壤中长期积累且很难被消除,对生态环境以及人类健康造成严重威胁。我国的农田土壤污染也十分严重,周洁等[1]对北京市郊农田土壤进行研究后发现,16种PAHs全部检出的检出率为74.4%,结果表明京郊农田土壤已经受到PAHs污染,具有潜在的生态风险。目前,生物修复是治理PAHs污染的重要方法之一,微生物可利用其作为碳源进行降解,将其转变为无害的无机物质[2]。
国内外研究者对优化生物修复效果做出了诸多探索,王悦明等[3]采用微生物制剂对不同类型石油污染的土壤进行了原位修复小试和中试,并在修复后的污染地块种植小麦,结果表明混合菌群对农田土壤中的石油具有良好的降解能力。李晓楼等[4]综合分析了土著微生物修复石油污染的影响因素,表明按6∶1的比例添加氮源和磷源处理效果最好。Lin等[5]利用棉花纤维对细菌细胞进行固定,结果显示固定化对原油降解具有促进作用。Mrozik等[6]综述了在生物修复过程中常见的固定化载体材料。然而在修复石油污染土壤过程中,PAHs的降解一直以来都是一大难题。笔者拟对土壤中PAHs的微生物降解进行综述,以期为微生物修复PAHs污染的土壤提供理论基础。
1 PAHs的种类及特性
石油中最容易被微生物降解的是饱和烃类化合物,其次是低分子量的芳香烃类化合物,高分子量的芳香烃类化合物、沥青质和胶质不仅对微生物有一定的毒性,而且最难被降解[7]。Wang等[8]将海洋沉积物与原油共同孵育,利用变性梯度凝胶电泳(DGGE)和克隆文库的方法对比菌群群落变化,结果显示加入石油前后细菌群落结构发生了巨大变化。Douglas等[9]详细描述了在有氧条件下石油各组分的降解过程,试验表明挥发性烃如苯、甲苯等在2 d内完全降解,半挥发性烃如萘、艹屈等PAHs在14 d后可降解完全,石油中的重质组分如沥青质、胶质等在140 d后依然没有完全降解。美国国家环境保护局已于1979年将16种未带分支的PAHs列入优先控制的有毒有机污染物名单[10],其结构如图1所示[11],其基本理化信息如表1所示,生物可降解性如表2所示[11]。
微生物降解可根据氧气参与程度分为厌氧降解、低氧降解、好氧降解。厌氧降解的速率较慢,但产生的中间产物较好氧产物相比更加简单、毒性更小,并且分解更完全[12-14]。
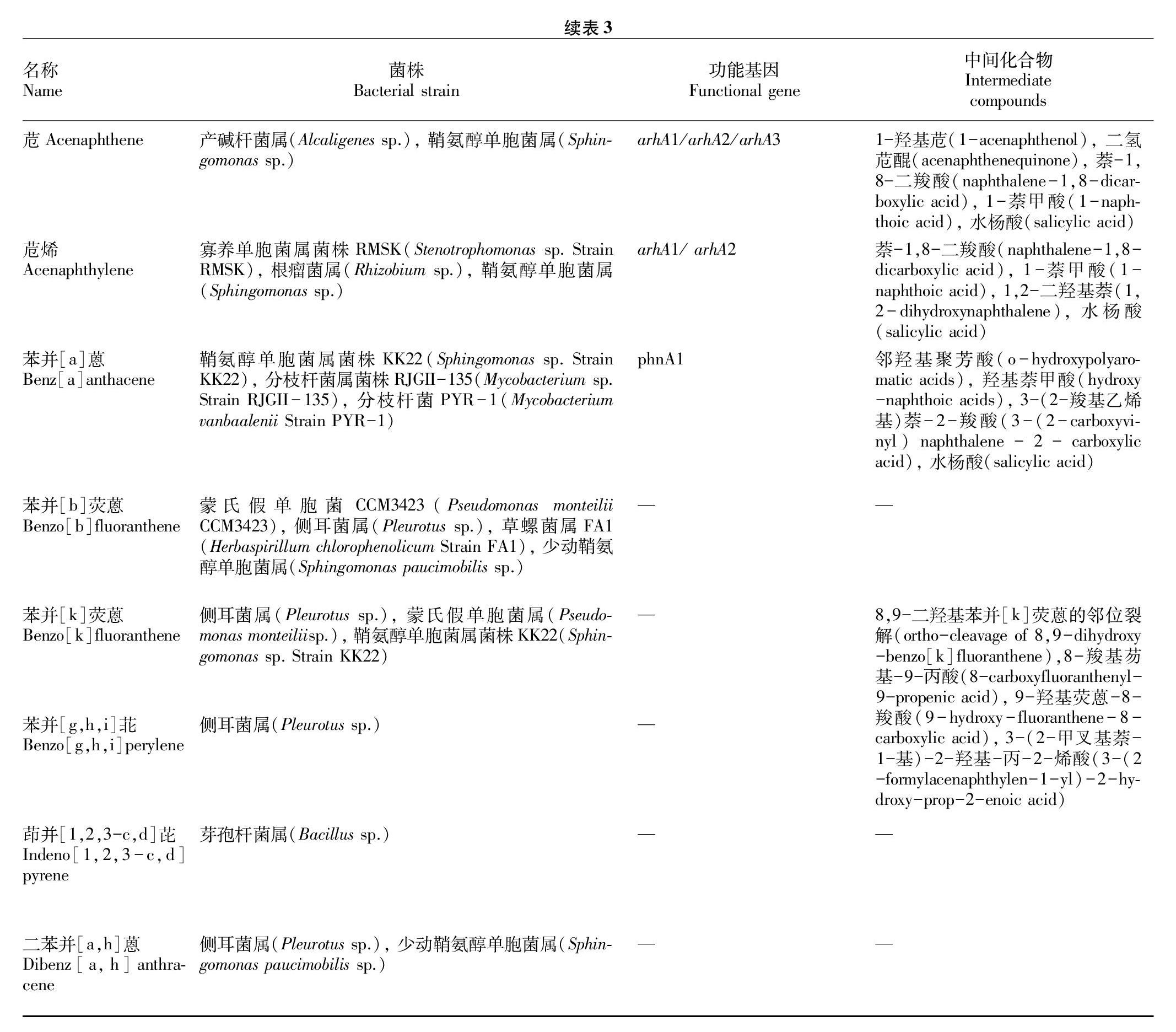
目前,低氧降解PAHs的研究相对较少,但有研究表明在低氧条件下,PAHs的降解速率比在完全厌氧条件下高[15-16]。PAHs的好氧降解研究相对较多,好氧细菌降解PAHs主要是通过产生双加氧酶作用于苯环,在芳环上加入2个氧原子,然后再经过氧化形成顺式二氢二羟基结构,随后继续脱氢形成单纯二羟基化的中间体,而后被进一步代谢为邻苯二甲酸等其他中间产物,最终可降解为H2O和CO2[17],PAHs在好氧条件下的优势降解菌及功能基因等见表3。
2 PAHs的降解
2.1 低相对分子质量PAHs 目前,对于低相对分子质量PAHs的研究已较为透彻,其分子结构简单,水溶性高,能够被许多微生物矿化降解。
2.1.1 萘的降解。萘具有2个苯环,结构简单,有较低的水溶性和较高的固液分配系数,这使得它能够抵抗微生物的利用且促进其在土壤中浓度的增加[18]。
研究表明多种细菌和真菌能够通过不同的机制降解萘,能利用 PAHs为碳源和能源的微生物普遍存在于已污染的水体、土壤、底泥等中,如假单胞菌 (Pseudomonas sp.)、杆菌(Bacillus sp.)、分枝杆菌属(Mycobacterium sp.)等[19]。这些菌中均有萘降解基因如nahAc、nahF、nahV、 nahU、nahH、catA和nahY等。
萘的降解首先通过萘双加氧酶攻击芳环形成顺式二氢萘,随后通过脱氢酶的作用形成1,2-二羟基萘,再经过一系列催化反应形成水杨酸。水杨酸会脱羧形成邻苯二酚或羟基化形成龙胆酸,进而开环降解[20]。
2.1.2 芴的降解。
芴及其衍生物是一类重要的具有刚性平面联苯结构的化合物,具有较大的共轭体系,这种特殊的刚性稠环结构使芴类化合物在光电材料、医药等领域具有潜在的应用前景[21],目前已經筛选出许多高效降解菌并推测其可能的代谢途径[22-25]。能够降解芴的菌属主要包括地杆菌属(Terrabacter sp.)、非脱羧勒克菌属(Leclercia adecarboxylata sp.)、葡萄球菌属(Staphylococcus sp.)、分枝杆菌属。
芴的生物降解主要有2种途径:一是有角度双加氧途径;二是侧面双加氧途径。双加氧酶被认为是芴降解的关键酶,芴在双加氧酶的作用下可以在不同位点加羟基,第一种途径在1、2位点的双加氧反应下最终形成苯并二氢吡喃-3-酮;第二种途径通过在芴的3、4号位加氧反应最终以水杨酸盐形式代谢;第三种途径通过在C-9位上的单加氧反应最终以邻苯二甲酸盐的形式代谢[26]。
2.1.3 菲的降解。菲是一种三环芳烃,具有一个“湾”区(bayregion)和一个“K”(kregion)区,这2种结构与PAHs的致癌性有着非常密切的关系,凭借其独特的化学结构,菲已经成为研究PAHs的模式化合物[27-31]。菲具有生物累积性、致癌、致畸等特性,对生态环境和人类健康构成严重危害[32-33]。菲可以被多种微生物降解和吸附,从石油、煤炭工厂附近污染的土壤、沉积物或水环境中均易分离出菲降解菌。
目前发现的能够降解菲的菌属有很多,主要包括假单胞菌、鞘氨醇单胞菌属(Sphingomonas sp.)、葡萄球菌属等[19]。
菲的降解途径主要为2种:一是水杨酸途径;二是邻苯二甲酸代谢途径。Lin等[34]筛选出的假单胞菌属嗜盐菌Pseudomonas sp.BZ-3,对菲具有高效降解能力,并且得知该菌通过水杨酸代谢途径降解菲。首先,菲在双加氧酶的作用下3、4位碳被羟基化生成顺-3,4-二氢二羟基菲,随后在一系列酶促反应下转化为1-羟基-2-萘甲酸[35]。之后的降解过程有2种,对于既能够以菲为唯一碳源,又能够以萘为唯一碳源的菌株,通过水杨酸途径进行降解,即在羟化酶作用下转化为1,2-二羟萘,再通过与萘类似的途径完成降解。不能以萘为唯一碳源的菲降解菌一般通过邻苯二甲酸途径进行降解,即在一系列酶促反应下转化为原儿茶酸,随后氧化开环进入到TCA循环降解[19]。
2.1.4 蒽的降解。
蒽是PAHs中一种具有代表性的有毒污染物,结构中有3个苯环,同时也是检测PAHs污染的指示物[36]。目前对于蒽降解的研究,主要集中在筛选蒽高效降解菌[37-38]。另外,Hu等[39]利用固定化漆酶对蒽进行降解,也得到了较好的试验结果。
能够降解蒽的菌属主要有假单胞菌属、黄杆菌属(Flavobacterium sp.)、鞘氨醇单胞菌属、气单胞菌属(Aeromonas sp.)等。
蒽首先在双加氧酶的作用下转化为顺式二氢二醇,然后脱氢生成二羟基蒽,接着环氧化裂解,最后形成能够进入TCA循环的小分子物质[19]。
2.1.5 苊烯的降解。
苊烯的降解菌属包括根瘤菌属(Rhizobium sp.)、鞘氨醇单胞菌属、寡养单胞菌属(Stenotrophomonas sp.)等。Poonthrigpun等[40]分离到一株能以苊烯为唯一碳源和能源的菌株,首次推测出苊烯的降解途径。Nayak等[41]也分离到苊烯的降解菌Stenotrophomonas sp.RMSK,并完善了苊烯的代谢通路。首先苊烯的1、2位碳被羟基化,生成1,2-二醇苊,随后脱氢生成1,2-二羟基苊烯。进一步脱氢生成二氢苊醌,二氢苊醌发生氧化生成1,8-萘二羧酸,随后发生脱羧反应生成α-萘甲酸。α-萘甲酸脱羧以及在羟基化酶的作用连续羟基化下转化为1,2-二羟基萘,随后经过一系列酶促反应转化为水杨酸,水杨酸在经过脱羧和羟基化反应后生成最终的芳香族代谢物邻苯二酚,邻苯二酚即可通过1,2-邻苯二酚双加氧酶的催化进入TCA循环。
2.1.6 苊的降解。
苊的降解菌属主要有产碱杆菌属(Alcaligenes sp.)、鞘氨醇单胞菌属、不动杆菌属(Acinetobacter sp.)等。Ghosal等[42]分离到一株能够以苊为唯一碳源和能源的不动杆菌属菌株Acinetobacter sp.strain AGAT-W,并表明苊降解过程中的关键酶是1-羟基苊脱氢酶、水杨醛脱氢酶以及1,2-邻苯二酚双加氧酶。首先在苊的1号碳位置上发生单加氧化作用转变为1-羟基苊,随后在脱氢酶作用下转化为1-苊酮。1-苊酮发生羟基化反应生成1-羟基-2酮苊,随后在2号碳位置发生脱氢作用生成二氢苊醌。二氢苊醌被认为是苊与苊烯降解代谢中重要的中间代谢产物。随后二氢苊醌就可转化为1,8-萘二羧酸、α-萘甲酸、水杨酸,水杨酸转化为邻苯二酚便可以进入TCA循环。
2.2 高相对分子质量PAHs
4环以上的高相对分子质量PAH分子结构复杂、电子云密度高、水溶性差,通常需要采用共代谢(Co-metabolism)的方式进行微生物降解。共代谢是指微生物利用一种容易降解的有机物质作为支持其自身生长繁殖的营养物质,同时降解另一种物质,但微生物不能从后一种物质的降解和转化中获得能量、碳源或其他任何营养物质[19]。
对于高分子质量PAHs的研究已取得诸多成果。唐玉斌等[43]从焦化污泥中筛选出一株可在以艹屈
为唯一碳源的无机盐培养基中生长的高效降解菌 Achromobacter xylosoxidans SQ-1,又考察了艹屈的初始浓度、加菌量、pH对SQ-1菌株降解效果的影响,确定了最佳降解条件。李慧等[44]分离纯化了丝状真菌宛氏拟青霉(Paecilomyces variotii),并对苯并[a]蒽、苯并[a]芘、苯并[b]荧蒽、苯并[k]荧蒽、茚并[1,2,3-c,d]芘的降解效果进行了探究,结果表明该菌对混合体系中5种PAHs的降解率与单一体系的PAHs降解率有一定差异。陈海英等[45]筛选驯化的混合菌群具有很强的PAHs降解能力,缩短了PAHs生物降解的半衰期,且PAHs起始降解速率较快,之后趋于平缓。Wang等[46]在长期受到PAHs污染的土壤和未受到污染的土壤中分别加入11种混合PAHs并采用双液相生物反应器(TLPB),结果表明,在2种土壤中采用双液相生物反应器都可有效缩短PAHs的半衰期。但目前对于苯并[b]荧蒽、苯并[g,h,i]芘、苯并[a,h]蒽的研究主要集中在其致癌性上,关于微生物降解机制的研究较少。
2.2.1 苯并[a]芘的降解。
苯并[a]芘是一种具有5环结构的强致癌性PAHs污染物,其分子結构内苯环高度密集,辛醇-水分配系数高,较难被微生物降解[47]。能够降解苯并[a]芘的菌属主要包括拜叶林克氏菌属(Beijerinckia derx sp.)、红球菌属(Rhodococcus sp.)、假单胞菌属、土杆菌属(Agrobacterium sp.)等。Hu等[48-49]利用固定化漆酶降解苯并[a]芘得到其代谢中间物包括1,6-苯并[a]芘醌、3,6-苯并[a]芘醌、6,12-苯并[a]芘醌。
在细菌降解苯并[a]芘时,首先是苯并[a]芘的2个碳原子通过双加氧酶被羟基化产生二氧化合物中间体,随后被氧化为顺式-2-二氢二醇苯并[a]芘和二羟基化合物,接着再被转化为细胞蛋白质,或者转化为CO2和H2O [19]。
2.2.2 苯并[a]蒽的降解。
目前发现能够降解苯并[a]蒽的菌属有限,主要包括鞘氨醇单胞菌属以及分枝杆菌属。Kunihiro等[50]分离出一株能够降解苯并[a]蒽的菌株Sphingobium sp.strain KK22,该菌株能够在48 h内降解50%浓度为2.5 mg/L的苯并[a]蒽。
从代谢的起始位点来比较,苯并[a]蒽的降解大致分为4种途径。在这些途径中,苯并[a]蒽的转化分别起始于1,2-、3,4-、8,9-、10,11-位,经过双加氧作用分别形成顺式-1,2-二氢二醇苯并[a]蒽,顺式-3,4-二氢二醇苯并[a]蒽,顺式-8,9-二氢二醇苯并[a]蒽,顺式-10,11-二氢二醇苯并[a]蒽。这些二氢二醇式的苯并[a]蒽在一系列酶促反应作用下最终形成水杨酸,完成对苯并[a]蒽的降解。
2.2.3 苯并[k]荧蒽的降解。
目前已知能够降解苯并[k]荧蒽的菌属主要包括假单胞菌属、鞘氨醇单胞菌属、侧耳菌属(Pleurotus sp.)等。Maeda等[51]分离到高分子量PAHs降解菌Sphingobium sp.strain KK22,该菌可降解苯并[k]荧蒽、荧蒽以及苊烯这3种PAHs。
首先,苯并[k]荧蒽的转化在8,9-位经过双加氧作用在邻位开环形成顺式-8,9-二氢二醇苯并[k]荧蒽,随后在一系列酶促反应作用下形成α-萘甲酸,最终完成对苯并[k]荧蒽的降解。
3 展望
利用微生物修复石油污染的土壤是目前最具有应用前景的手段,而现有研究多集中于降解菌种的分离、降解能力的测定、提高某一菌种降解能力的条件以及对单一污染物的降解机制和代谢途径。但菌种的筛选具有偶然性,且单一菌种的降解谱窄,往往只对某种特定的石油污染物具有较好的降解特性。此外,对微生物降解石油污染物的研究大多停留在其分子机制,局限于实验室模拟室外土壤环境,应用于室外土壤原位修复的试验和研究不够深入。未来值得深入研究的方向包括:①可利用具有高效降解能力的细菌、真菌、放线菌甚至藻类构建高效降解菌群,高效降解PAHs污染土壤中的难降解组分;②研究高效降解菌的降解基因以及特殊酶类,利用基因工程手段取代传统筛菌、分离过程;③深入研究高环PAHs以及沥青质、胶质的降解机制,细化代谢途径,实现对其降解过程的有效调控;④将构建好的高效降解菌群投入到遭受PAHs污染的土壤中,探究原位修复的最适降解条件,以期修复我国被污染的土壤,改善耕作土壤条件。
参考文献
[1]
周洁,张敬锁,刘晓霞,等.北京市郊农田土壤中多环芳烃污染特征及风险评价[J].农业资源与环境学报,2019,36(4):534-540.
[2] 何丽媛,党志,唐霞,等.混合菌对原油的降解及其降解性能的研究[J].环境科学学报,2010,30(6):1220-1227.
[3] 王悦明,王继富,李鑫,等.石油污染土壤微生物修复技术研究进展[J].环境工程,2014(8):157-161,130.
[4] 李晓楼.石油污染土壤的土著微生物修复影响因素研究[J].长江大学学报(自科版),2014,11(22):25-27.
[5] LIN M,LIU Y H,CHEN W W,et al.Use of bacteria-immobilized cotton fibers to absorb and degrade crude oil[J].International biodeterioration & biodegradation,2014,88:8-12.
[6] MROZIK A,PIOTROWSKA-SEGET Z.Bioaugmentation as a strategy for cleaning up of soils contaminated with aromatic compounds[J].Microbiological research,2010,165(5):363-375.
[7] 齊永强,王红旗,刘敬奇,等.土壤中石油污染物微生物降解过程中各石油烃组分的演变规律[J].环境科学学报,2003,23(6):834-836.
[8] WANG H,WANG C X,LIN M,et al.Phylogenetic diversity of bacterial communities associated with bioremediation of crude oil in microcosms[J].International biodeterioration & biodegradation,2013,85:400-406.
[9] DOUGLAS G S,HARDENSTINE J H,LIU B,et al.Laboratory and field verification of a method to estimate the extent of petroleum biodegradation in soil[J].Environmental science & technology,2012,46(15):8279-8287.
[10] 尚庆彬,段永红,程荣.中国农业土壤多环芳烃污染现状及来源研究[J].山东农业科学,2019,51(3):62-67.
[11] GHOSAL D,GHOSH S,DUTTA T K,et al.Current state of knowledge in microbial degradation of polycyclic aromatic hydrocarbons (PAHs):A review[J].Frontiers in microbiology,2016,7:1-27.
[12] ZHANG X M,SULLIVAN E R,YOUNG L Y.Evidence for aromatic ring reduction in the biodegradation pathway of carboxylated naphthalene by a sulfate reducing consortium[J].Biodegradation,2000,11(2/3):117-124.
[13] RABUS R,WIDDEL F.A naerobic degradation of ethylbenzene and other aromatic-hydrocarbons by new denitrifying bacteria[J].Archives of microbiology,1995,163(2):96-103.
[14] TSAI J C,KUMAR M,LIN J G.Anaerobic biotransformation of fluorene and phenanthrene by sulfate-reducing bacteria and identification of biotransformation pathway[J].Journal of hazardous materials,2009,164(2/3):847-855.
[15] LI C H,WONG Y S,TAM N F Y.Anaerobic biodegradation of polycyclic aromatic hydrocarbons with amendment of iron(III) in mangrove sediment slurry[J].Bioresource technology,2010,101(21):8083-8092.
[16] BOTHEJU D,LIE B,BAKKE R.Oxygen effects in anaerobic digestion-Ⅱ[J].Modeling identification and control,2010,31(2):55-65.
[17] 侯梅芳,潘栋宇,黄赛花,等.微生物修复土壤多环芳烃污染的研究進展[J].生态环境学报,2014,23(7):1233-1238.
[18] 史延华,任磊,贾阳,等.施氏假单胞菌YC-YH1的萘降解特性及产物分析[J].微生物学通报,2015,42(10):1866-1876.
[19] 姜岩,杨颖,张贤明.典型多环芳烃生物降解及转化机制的研究进展[J].石油学报(石油加工),2014,30(6):1137-1150.
[20] SEO J S,KEUM Y S,LI Q X.Bacterial degradation of aromatic compounds[J].International journal of environmental research and public health,2009,6(1):278-309.
[21] 霍延平,方小明,黄宝华,等.芴类化合物的研究新进展[J].有机化学,2012,32(7):1169-1185.
[22] HADIBARATA T,KRISTANTI R A.Fluorene biodegradation and identification of transformation products by white-rot fungus Armillaria sp.F022[J].Biodegradation,2014,25(3):373-382.
[23] 王晓朝.两株芴高效降解菌的分离鉴定及降解特性研究[D].镇江:江苏科技大学,2010.
[24] 唐玉斌,王晓朝,陈芳艳,等.芴降解优势菌的筛选鉴定及降解特性研究[J].中国环境科学,2010,30(8):1086-1090
[25] 唐玉斌,王晓朝,陈芳艳,等.一株芴降解菌的分离鉴定及其对多环芳烃的降解广谱性研究[J].环境工程学报,2011,5(2):467-471.
[26] 喻婵.大港油田微生物对石油组分降解和代谢的研究[D].北京:北京科技大学,2015.
[27] 艾芳芳,曲媛媛,周集体,等.菲降解菌株的分离鉴定及特性研究[J].环境科学,2008,29(4):1066-1071.
[28] LI J W,SHANG X,ZHAO Z X,et al.Polycyclic aromatic hydrocarbons in water,sediment,soil,and plants of the Aojiang River waterway in Wenzhou,China[J].Journal of hazardous materials,2010,173(1/2/3):75-81.
[29] 刘爽,刘娟,凌婉婷,等.一株高效降解菲的植物内生细菌筛选及其生长特性[J].中国环境科学,2013,33(1):95-102.
[30] 高闯,张全,王继锋.萘降解菌的筛选及其对多环芳烃的降解[J].化工环保,2015,35(1):17-20.
[31] 田华,刘哲,赵璐,等.土壤中多环芳烃菲的自然降解特性[J].环境工程学报,2015,9(8):4055-4060.
[32] WANG B C,WANG Q H,ZHU L C,et al.Degrade naphthalene using cells immobilized combining with low-intensity ultrasonic technique[J].Colloids and surfaces B:Biointerfaces,2007,57(1):17-21.
[33] 杨轩,张威,李师翁,等.多环芳烃降解菌的分离鉴定及其生理特性研究[J].环境科学学报,2012,32(5):1033-1040.
[34] LIN M,HU X K,CHEN W W,et al.Biodegradation of phenanthrene by Pseudomonas sp.BZ-3,isolated from crude oil contaminated soil[J].International biodeterioration & biodegradation,2014,94:176-181.
[35] PINYAKONG O,HABE H,SUPAKA N,et al.Identification of novel metabolites in the degradation of phenanthrene by Sphingomonas sp.strain P2[J].FEMS Microbiology Letters,2000,191(1):115-121.
[36] 王玉芹,周晶,楊军,等.多环芳烃蒽的生物降解研究进展[J].生物学教学,2013,38(9):2-4.
[37] 李修平.蒽降解菌的分离鉴定与降解条件优化[J].安徽农业科学,2014,42(10):2998-3002.
[38] 陶雪琴,党志,卢桂宁,等.污染土壤中多环芳烃的微生物降解及其机理研究进展[J].矿物岩石地球化学通报,2003,22(4):356-360.
[39] HU X K,WANG P,HWANG H M.Oxidation of anthracene by immobilized laccase from Trametes versicolor[J].Bioresource technology,2009,100(21):4963-4968.
[40] POONTHRIGPUN S,PATTARAGULWANIT K,PAENGTHAI S,et al.Novel intermediates of acenaphthylene degradation by Rhizobium sp.strain CU-A1:Evidence for naphthalene-1,8-dicarboxylic acid metabolism[J].Applied and environmental microbiology,2006,72(9):6034-6039.
[41] NAYAK A S,VEERANAGOUDA Y,LEE K,et al.Metabolism of acenaphthylene via 1,2-dihydroxynaphthalene and catechol by Stenotrophomonas sp.RMSK[J].Biodegradation,2009,20(6):837-843.
[42] GHOSAL D,DUTTA A,CHAKRABORTY J,et al.Characterization of the metabolic pathway involved in assimilation of acenaphthene in Acinetobacter sp.strain AGAT-W[J].Research in microbiology,2013,164(2):155-163.
[43] 唐玉斌,孙常宇,陈芳艳,等.一株高效降解菌的分离鉴定及其降解特性[J].微生物学通报,2009,36(4):593-597.
[44] 李慧,蔡信德,罗琳,等.一株可同时降解多种高环PAHs的丝状真菌——宛氏拟青霉(Paecilomyces variotii)[J].生态学杂志,2009,28(9):1842-1846.
[45] 陈海英,丁爱中,豆俊峰,等.混合菌降解土壤中多环芳烃的试验研究[J].农业环境科学学报,2010,29(6):1111-1116.
[46] WANG C Y,WANG F,WANG T,et al.PAHs biodegradation potential of indigenous consortia from agricultural soil and contaminated soil in two-liquid-phase bioreactor (TLPB)[J].Journal of hazardous materials,2010,176(1/2/3):41-47.
[47] 盛下放,何琳燕,胡凌飞.苯并[a]芘降解菌的分离筛选及其降解条件的研究[J].环境科学学报,2005,25(6):791-795.
[48] HU X K,ZHAO X H,HWANG H M.Comparative study of immobilized Trametes versicolor laccase on nanoparticles and kaolinite[J].Chemosphere,2007,66(9):1618-1626.
[49] HU X K,ZHANG Y,ZHAO X H,et al.Biodegradation of benzo a pyrene with immobilized laccase:Genotoxicity of the products in HaCaT and A3 cells[J].Environmental and molecular mutagenesis,2007,48(2):106-113.
[50] KUNIHIRO M,OZEKI Y,NOGI Y,et al.Benz[a] anthracene biotransformation and production of ring fission products by Sphingobium sp.strain KK22[J].Applied and environmental microbiology,2013,79(14):4410-4420.
[51] MAEDA A H,NISHI S,HATADA Y,et al.Biotransformation of the high-molecular weight polycyclic aromatic hydrocarbon (PAH)benzo[k]fluoranthene by Sphingobium sp.strain KK22 and identification of new products of non-alternant PAH biodegradation by liquid chromatography electrospray ionization tandem mass spectrometry[J].Microbial biotechnology,2014,7(2):114-129.

