白藜芦醇治疗脓毒症大鼠急性肺损伤的作用及机制研究
郑凤霞 刘 迪 张莉红
脓毒症(sepsis)是临床常见的急危重症,急性肺损伤(acute lung injury,ALI)是脓毒症最常见的伴发症[1]。炎性因子的大量激活是脓毒症患者器官损伤的主要机制,急性肺损伤也与炎性因子的过度激活密切相关[2]。抑制炎性反应可以保护脓毒症大鼠的肺功能已被研究所证实[3]。核因子 κB(nuclear factor-kappa B,NF-κB)通路是脓毒症炎性因子激活释放的主要调节通路[4]。白藜芦醇是多酚类化合物,主要来源于花生、葡萄(红葡萄酒)、虎杖、桑椹等植物,具有抗炎、抗氧化的作用,可以作为动脉粥样硬化、心脑血管疾病的化学预防剂[5]。实验研究观察到白藜芦醇对脓毒症大鼠急性肺损伤具有治疗作用[6],本研究观察白藜芦醇对对脓毒症大鼠急性肺损伤的保护作用,并探讨NF-κB炎性通路在其中的可能作用。
材料和方法
1.实验动物:健康雄性SD大鼠购自华中科技大学同济医学院动物实验中心,体质量210~240g(2月龄),共 80只,在动物中心清洁级适应性喂养3天后,进行后续实验造模和研究。
2.脓毒症造模:80只SD大鼠随机分为假手术组(20只)和造模组(60只),盲肠结扎穿刺术制作脓毒症大鼠实验模型。简述如下:备皮消毒后,30mg/kg戊巴比妥钠腹腔注射麻醉,沿腹正中线做1.5cm切口,找到盲肠,游离肠系膜,距盲肠末端1/3处用 4 号手术线结扎,穿刺盲肠肠管,将盲肠还纳腹腔,关闭腹腔,术后皮下注射0.9%NaCl注射液抗休克治疗。20只假手术组大鼠仅仅分离盲肠,不做结扎和穿孔。造模组SD大鼠术后12h开始出现竖毛、蜷缩、少动、精神倦怠、少食、腹泻、眼角渗出物等表现,成功率100%。术后60只造模SD 大鼠随机分为脓毒症模型组、低剂量白藜芦醇干预组(Rec,20mg/kg)和高剂量白藜芦醇干预组(Rec,40mg/kg),每组20只,白藜芦醇干预组大鼠于术后60min按照分组分别尾静脉注射无菌白藜芦醇(20mg/kg或40mg/kg,美国Sigma公司产品),假手术组和脓毒症模型组大鼠尾静脉注射等量0.9%NaCl注射液。24h后进行相关指标检测。
3.肿瘤坏死因子-α (TNF-α)、白细胞介素-6(IL-6)的ELISA法检测:大鼠外周血TNF-α、IL-6的表达的ELISA法检测。ELISA检测试剂盒购自武汉博士德生物科技技术有限公司(批号:20180732),造模前和造模24h后抽取大鼠尾静脉血液0.4ml,交由检验科严格按照试剂盒说明书操作,加入相关试剂,上海巴玖实业有限公司SAF-680T酶标仪检测各样品的吸光度值变化,对照标准品,计算各样品TNF-α和IL-6的表达水平。
4.肺损伤评分:造模24h后,所有大鼠均断颈处死,取左肺下叶组织,4%甲醛固定肺组织24h后,送病理科制作HE染色切片,镜下见肺组织血管充血,间质水肿出血,肺泡坏死,肺泡腔范围消失,淋巴细胞、中性粒细胞和巨噬细胞等炎性细胞浸润[7]。显微镜下进行肺损伤评分,按照正常(0分)、轻度(1分)、中度(2分)、重度(3分)从肺泡水肿、肺泡出血、肺不张、炎性细胞浸润、透明膜形成5个方面进行评分,总分15分,评分越高损伤越严重[8]。
5.肺组织细胞核P65的Western blot法检测:造模24h后,所有大鼠均断颈处死,取50mg左肺下叶组织,液氮下研磨后,PBS洗涤2次,细胞核蛋白提取试剂盒购自北京碧云天生物科技有限公司(批号:20180321),严格按照试剂盒说明书操作,提取细胞核蛋白,加入蛋白裂解液,取10μg核蛋白进行SDS-PAGE凝胶电泳,电泳后电转至PVDF膜,加入兔抗鼠P65抗体(武汉博士德生物科技技术有限公司,批号:20180716)孵育12h,加入羊抗兔辣根过氧化物酶标记二抗(武汉博士德生物科技技术有限公司,批号:20180227),化学发光后使用上海金鹏公司生产JP-K300型化学发光成像系统拍照,Quantity One V4.3.0软件,扫描条带,以组蛋白为内参计算各样品的相对表达量。同一大鼠在不同部位取材3次,实验重复3次,然后求平均值。
6.统计学方法:采用SPSS 18.0统计学软件对数据进行统计分析,计量资料采用t检验,多组均数比较使用方差分析,组间相互比较使用LSD-t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
结 果
1.白藜芦醇对脓毒症模型大鼠存活率的影响:假手术组无大鼠死亡,存活率为100.0%,脓毒症模型组死亡9只,存活11只,存活率为55.0%,低剂量Rec干预组死亡5只,存活15只,存活率为75.0%,高剂量Rec干预组死亡2只,存活18只,存活率为90.0%,4组间存活率比较,差异有统计学意义(P<0.05)。其中低剂量和高剂量Rec干预组存活率显著高于脓毒症模型组(P<0.05),高剂量Rec干预组存活率显著高于低剂量Rec干预组(P<0.05)。
2.白藜芦醇对脓毒症模型大鼠肺组织损伤的影响:肺损伤评分在假手术组、脓毒症模型组、低剂量Rec干预组和高剂量Rec干预组分别为1.04±0.22分、12.25±2.14分、8.63±1.36分和5.18±1.13分,4组比较,差异有统计学意义(P<0.01),其中低剂量和高剂量Rec干预组肺损伤评分显著低于脓毒症模型组(P<0.01),高剂量Rec干预组肺损伤评分显著低于低剂量Rec干预组(P<0.01),详见图1。
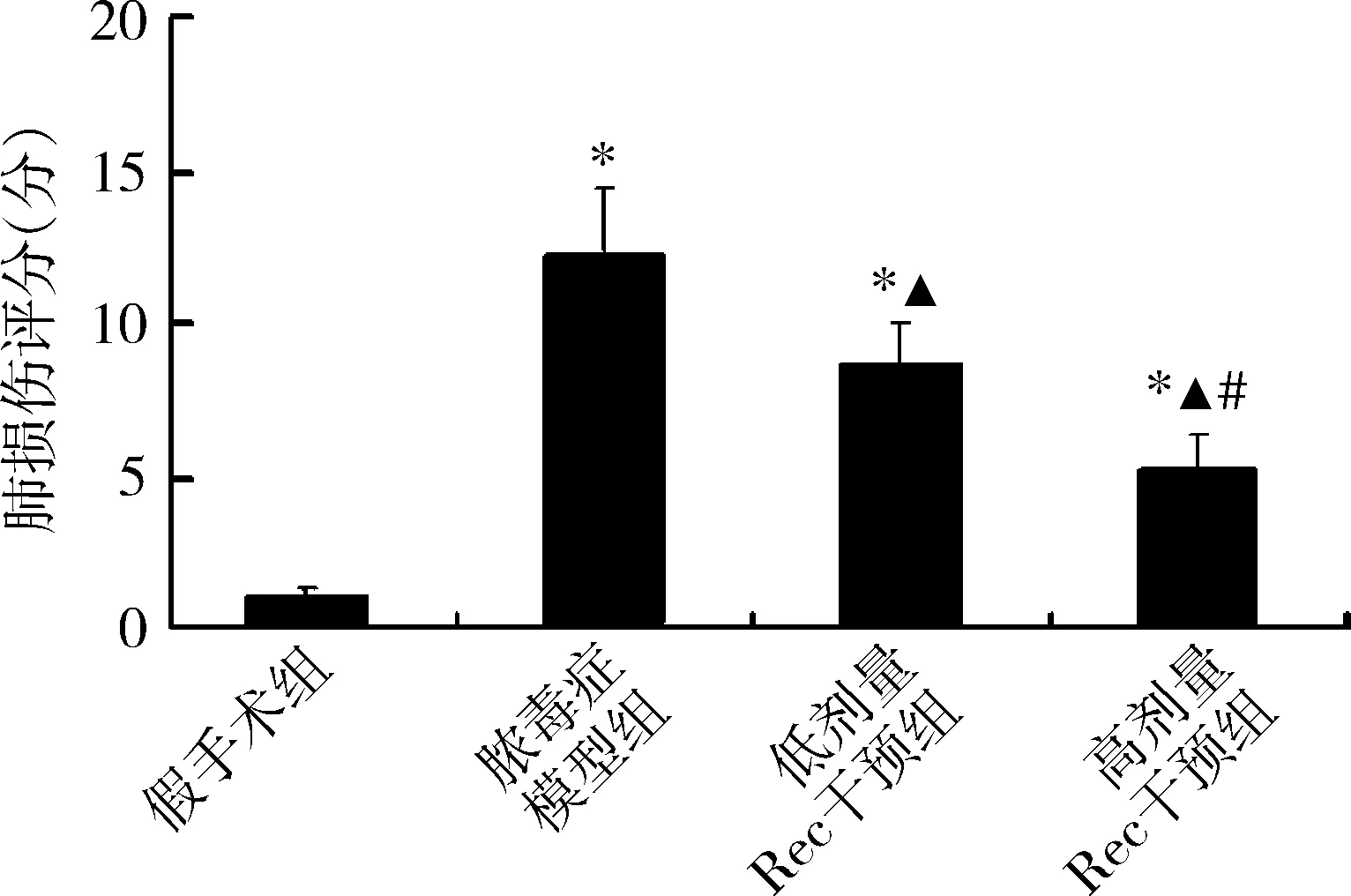
图1 4组造模24h后肺损伤评分的比较与假手术组比较,*P<0.01;与脓毒症模型组比较,▲P<0.01;与低剂量Rec干预组比较,#P<0.01
3.白藜芦醇对脓毒症模型大鼠TNF-α、IL-6炎性因子表达的影响:假手术组、脓毒症模型组、低剂量Rec干预组和高剂量Rec干预组造模前大鼠外周血TNF-α和IL-6表达比较,差异无统计学意义(P>0.05),造模24h后低剂量和高剂量Rec干预组TNF-α和IL-6表达显著低于脓毒症模型组(P<0.01),高剂量Rec干预组TNF-α和IL-6表达显著低于低剂量Rec干预组(P<0.01),详见表1。
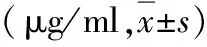
表1 4组TNF-α和IL-6表达的比较
与假手术组比较,*P<0.01;与脓毒症模型组比较,▲P<0.01;与低剂量Rec干预组比较,#P<0.01;与造模前比较,&P<0.05,&&P<0.01
4.白藜芦醇对脓毒症模型大鼠肺组织细胞核P65的表达:肺组织细胞核P65相对灰度值在假手术组、脓毒症模型组、低剂量Rec干预组和高剂量Rec干预组分别为0.14±0.03、0.82±0.15、0.56±0.09、0.25±0.06,各组间比较差异有统计学意义(P<0.01)。其中假手术组肺组织细胞核P65表达显著低于低剂量和高剂量Rec干预组(P<0.01),低剂量和高剂量Rec干预组P65表达显著低于脓毒症模型组(P<0.01),高剂量Rec干预组P65表达显著低于低剂量Rec干预组(P<0.01),详见图2。

图2 4组大鼠肺组织细胞核P65表达的Western blot法检测
讨 论
脓毒症是临床上的急危重症,急性肺损伤是急性呼吸窘迫综合征的早期阶段,20%的急性肺损伤是伴发于脓毒症患者,其病死率高达50%~70%[9]。脓毒症激发的全身炎性反应综合征是导致多器官功能障碍的重要原因,研究已发现脓毒症急性肺损伤患者体内炎性反应的激活[10]。NF-κB信号通路是机体内一条重要的炎性调节通路,在脓毒症时处于激活状态,并且可以参与到肺损伤的致病过程中[11,12]。王国全等[13]研究证实抑制NF-κB信号通路可以对脓毒症急性肺损伤大鼠发挥保护作用。白藜芦醇是一种含有芪类结构的非黄酮类多酚化合物,其抗炎作用已被大多数实验所证实[14]。于红等[15]研究显示,白藜芦醇可以显著降低内质网应激和血管内皮损伤标志蛋白的表达,对急性肺损伤小鼠发挥保护作用。本研究也观察到白藜芦醇干预组肺损伤评分显著低于脓毒症模型组,说明脓毒症时给予白藜芦醇对模型鼠肺组织具有保护作用。
NF-κB信号通路中的主要效应蛋白是P65和P50,二者形成二聚体进入细胞核发挥转录因子的作用,调节下游炎性因子例如TNF-α和IL-6 等的表达[16]。因此研究中检测细胞核中P65蛋白的表达就可以反应出NF-κB信号通路的激活情况[17]。本研究的检测显示模型组大鼠肺组织细胞核P65表达显著高于假手术组,其中白藜芦醇干预组肺组织细胞细胞核P65表达显著低于非干预的脓毒症模型组,说明白藜芦醇抑制了NF-κB信号通路中关键蛋白P65的核移位,下游的炎性因子TNF-α和IL-6在相应的在白藜芦醇干预组也显著低于非干预的脓毒症模型组。杨剑榆等[18]的研究也发现白藜芦醇可以通过抑制NF-κB活性减轻大鼠肠缺血再灌注模型中继发的肺损伤,综合上述研究提示白藜芦醇对脓毒症大鼠肺损伤的保护作用可能是通过调节NF-κB通路来实现的,但是其具体的机制还需要开展进一步实验来证实。
综上所述,本研究显示白藜芦醇下调脓毒症大鼠肺组织细胞核P65蛋白的表达,抑制炎性反应,对肺损伤具有保护作用。

