病原相关分子模式对人3D皮肤皮脂腺模型表皮细胞增殖与分化影响的研究
李 昕 曹 珂 魏子妤 侯霄枭 胡婷婷 潘展砚 吴 琼 Christos C. Zouboulis 鞠 强
1上海交通大学医学院附属仁济医院皮肤科,上海,200127;2上海交通大学医学院附属仁济医院南院皮肤科,上海,201112;3 Departments of Dermatology, Venereology, Allergology and Immunology, Dessau Medical Center, Brandenburg Medical School Theodor Fontane, Germany
人皮肤上定殖了多样的微生物菌群,可能与痤疮、玫瑰痤疮、特应性皮炎、银屑病等皮肤疾病有关[1-3]。作为寄居在人表皮的正常生物菌群,微生物也参与了皮肤正常生理功能的发挥与调节如参与皮肤屏障功能[4,5],但微生物对于表皮的作用是否具有普遍性以及与微生物的量之间的关系还缺乏相关研究。病原相关分子模式(pathogen-associated molecular patterns,PAMPs)是病原微生物表面结构恒定且进化保守的分子结构,包括革兰氏阳性菌的细胞壁成分脂磷壁酸(lipoteichoic acid,LTA)和肽聚糖(peptidoglycan,PGN)以及革兰氏阴性菌的细胞壁的成分脂多糖(lipopolysaccharide,LPS),为微生物生存必需和宿主天然免疫细胞特异性识别的分子基础和微生物致病的主要结构。为了探究皮肤微生物对表皮的增殖与分化的影响以及微生物的量与其之间的关系,我们使用了皮肤和皮脂腺细胞共培养的3D离体皮肤模型。研究不同浓度的PAMPs对皮肤表皮细胞增殖及分化的影响,评估皮肤微生物作为皮肤屏障的一部分,对人表皮的保护与调节作用。
1 材料与方法
1.1 试剂和仪器 LPS(Sigma,来源于大肠杆菌055:B5),溶于磷酸盐缓冲液中,分装后-20℃备用;LTA(Sigma,来源于金黄色葡萄球菌),溶于双蒸水中,分装后-20℃备用;PGN(Sigma,来源于金黄色葡萄球菌),溶于PBS中配成混悬液,分装后-20℃备用;兔抗人Ki67一抗(Servicebio,GB13030-2),鼠抗人CK10(Cytokeratin 10)一抗(Santa Cruz Biotechnology,sc-23877)。免疫组化试剂盒(博士德),DAB显色剂(博士德),石蜡包埋机(Leica),自动脱水机(Leica),石蜡切片机(Leica),正置荧光显微镜(OLYMPUS)。
1.2 方法
1.2.1 细胞培养 SZ95人皮脂腺细胞由德国Dessau临床医学中心皮肤科Zouboulis教授馈赠,将稳定传代的30~40代细胞用于实验。细胞培养在Sebomed基础培养基中(德国 Biochrom公司),添加10%胎牛血清、5 μg/L表皮生长因子、100 U/mL青霉素、100 mg/L 链霉素(美国Gibco公司)、l mM CaCl2(美国Sigma公司)。置于37℃、5% CO2培养箱中,培养液每两天更换一次。新鲜配制工作培养基。
共培养之前,先将细胞按照3.5×105个/孔接种至24孔板中,培养基换为无激素培养基(Sebomed基础培养基中加入10%无激素胎牛血清,5 μg/L表皮生长因子、100 U/mL青霉素、100 mg/L 链霉素、l mM CaCl2)培养24 h,直至细胞密度长至100%。
1.2.2 离体皮肤准备 10份皮肤标本取自20~70岁志愿者头面部,皮肤标本新鲜健康,无皮肤炎症,创伤,肿瘤等。皮肤取下后,在PBS中进行处理,去除皮下脂肪血管等结缔组织后将皮肤切开均分为相同大小直径为3~5 mm的等份。制备好的皮肤表皮朝上将其漂浮在无激素培养基中进行单独培养过夜。
1.2.3 皮肤与SZ95皮脂腺细胞共培养 将过夜培养后的皮肤表皮层朝上移至24孔板中直接接触密度为100% 的SZ95皮脂腺细胞。培养基换为无血清培养基(Sebomed基础培养基中加入0.1% 牛血清白蛋白,5 μg/L表皮生长因子、100 U/mL青霉素、100 mg/L 链霉素、l.5 mM CaCl2, 1.5×10-7M亚油酸,10-6M视黄醇),每孔250 μL,并根据皮肤的不同性别年龄加入相应激素,具体方法见参考文献[6]。
1.2.4 石蜡切片,苏木素-伊红染色 培养7天后,皮肤组织立即放入4% 多聚甲醛中固定24 h以上。固定完全后对组织进行脱水和包埋,在石蜡切片机切出连续完整的3~5 μm的切片,进行HE(Haematoxylin-eosin)染色,水洗5 min,梯度过酒精和二甲苯后用中性树脂封片,通风橱吹干,次日显微镜下观察。
1.2.5 免疫组化(immunohistochemistry,IHC) 取待用切片,脱水后在柠檬酸钠溶液中微波炉高火10 min进行抗原修复,冷却至室温。滴加3% 过氧化氢,室温孵育10 min,PBS洗3次。取出切片,滴加5% BSA,室温封闭30 min,甩去血清,滴加用PBS稀释的一抗,湿盒中4℃过夜,次日转入PBS中洗3次。滴加二抗,室温孵育1 h后PBS洗3次。显微镜下进行DAB显色,苏木素复染,盐酸酒精分化,梯度脱水过二甲苯后中性树脂封片,次日显微镜下观察。
1.2.6 统计学方法 每个组织在相同放大倍数下随机选取6个不重复视野,HE染色图片用Photoshop软件勾选出每个视野中所见的表皮面积,表皮面积下界为真皮乳头与基底细胞边界,上界为皮肤角质层表面[6]。免疫组化使用ImageJ软件计算染色面积,Image-Pro Plus软件计算每张图片的累积光密度(IOD),采用SPSS 19.0进行数据分析,两组间比较采用t检验,每组实验至少重复3次,结果以P<0.05有统计学意义。采用Graphpad 7.0作图。
2 结果
2.1 3D皮肤皮脂腺模型更好的维持了表皮完整性 为了证实该模型下表皮的完整性,我们采用HE染色和Ki67研究体外培养7天后表皮完整性的情况(见图1)。结果显示:A组 与皮脂腺共培养(A2)的皮肤与单独培养(A3)相比较,其表皮表现出更加完整的皮肤结构和增殖活性。共培养的离体皮肤组织具有完整的基底细胞带和表皮角质层(图A2黑箭头);单独培养的皮肤组织基底细胞出现空泡变性(图A3红箭头),退化甚至局部基底细胞带消失(图A3蓝箭头)同时皮肤组织角质层变薄,角质层与表皮发生脱离(图A3黑箭头)。B组 共培养的皮肤组织(B2)与新鲜皮肤组织(B1)具有相似的Ki67表达(图B1,B2黑箭头),表明共培养模型可以保持表皮细胞增殖活性,单独的离体皮肤组织(B3红箭头)几乎检测不到Ki67表达。
2.2 LTA,LPS,PGN呈浓度依赖性诱导表皮增厚 为观察PAMPs在不同浓度下对表皮厚度的影响,体外组织培养7天后,HE染色并计算表皮面积,两组间比较使用t检验。结果显示:在0~200 μg/mL浓度间,PAMPs对表皮增厚(面积,单位μm2)的影响呈浓度依赖性增长。各浓度相对于对照组,增长的差异均有统计学意义(P<0.05),其中,LTA在200 μg/mL 时表皮面积为43401±754.9 μm2,表皮面积增长较2 μg/mL(31404±1542 μm2) 和2 μg/mL(18477±691.7 μm2)有明显差异(P<0.0001); LPS在200 μg/mL时表皮面积为86178±6656 μm2,表皮面积增长较2 μg/mL(65388±1222 μm2) 和2 μg/mL(69814±6842 μm2)有明显差异(P<0.01);PGN在20 μg/mL浓度时表皮增厚(54363±3104 μm2)高于2 μg/mL(35859±1083 μm2)(P<0.001),与200 μg/mL浓度时表皮增厚(46617±1725 μm2)比较无统计学差异(见图2)。
2.3 LTA,LPS,PGN对表皮细胞增殖与分化影响的研究 为确认PAMPs对表皮细胞增殖和分化的影响,我们对组织进行增殖指标Ki67 和分化指标CK10免疫组化染色,并使用ImageJ软件分析染色面积,Image-Pro Plus软件分析累积光密度(IOD)。结果见图3。在浓度为2、20、200 μg/mL的LTA, LPS,PGN刺激下,表皮基底层及角质层Ki67及CK10的表达增加。LTA在20 μg/mL浓度时Ki67的染色面积(75.67±3.288 μm2)和IOD(17.01±0.7255)均最大,结果与2 μg/mL (染色面积:52.7±2.591 μm2;IOD:11.74±0.4534)时有显著差异(P<0.01),与200 μg/mL(染色面积:67.2±2.935 μm2;IOD:15.77±1.463)无明显差别;LPS和PGN均在200 μg/mL时染色面积和IOD值最大,结果相较于其他两个浓度有明显差异(P<0.01)。LTA在200 μg/mL浓度下CK10的染色面积(10.13±0.3602 μm2)最大,在2 μg /mL时IOD(119±1.174)最大,数据相较于其他两个浓度有显著差异(P<0.01);LPS在20 μg /mL浓度时染色面积(3.933±0.087 μm2)和IOD(55.31±5.844)均最大,染色面积数值较2 μg/mL(1.074±0.097 μm2)有显著差异(P<0.01),但与200 μg/mL(3.824±0.1047 μm2)间无统计学意义。PGN在20 μg/mL时染色面积和IOD值均最大,与其他两个浓度比较,均有明显差异(P<0.01)。
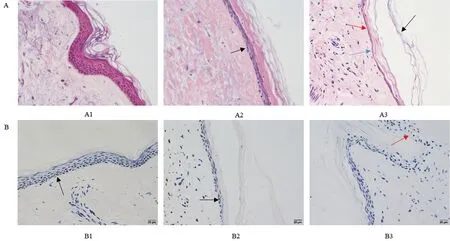
A组:A1 新鲜对照组,A2 皮肤与皮脂腺细胞共培养7天,A3 单独培养离体皮肤7天(HE,×400); B组:Ki67免疫组化染色,B1 新鲜对照组,B2 皮肤与皮脂腺共培养7天,B3 单独培养离体皮肤7天(免疫组化,×400)
图1 3D皮肤皮脂腺模型对表皮完整性与基底细胞增殖活性的影响

图2 2 μg/mL、20 μg/mL、200 μg/mL的磷壁酸,脂多糖,肽聚糖对表皮增厚的影响 (HE,×400)
3 讨论
表皮具有防止水分流失、维持体温、隔离病原体的重要功能[7]。皮肤微生物是人体微生态的重要组成,包括葡萄球菌属、丙酸杆菌属、马拉色菌属以及链球菌属等等[8],微生物群广泛参与了皮肤的免疫调节和维持局部稳态[7,9],不同的皮肤微生物可以以不同的分布和数量稳定分布[10]在皮肤各层,构成不同的微生物群落,参与皮肤生理学作用。痤疮丙酸杆菌主要聚集在毛囊皮脂腺单位,具有调节皮脂腺的分化及脂质合成,维持皮肤表面温度和脂质平衡[11];葡萄球菌属和链球菌分布在角质层深层,可能在表皮修复方面有重要作用[12]。不仅如此,皮肤微生物还可以分解代谢产物和调节免疫反应[13,14],其自身和分解的代谢产物可以调节淋巴细胞归巢和脂质代谢[15]。已有研究证实,马拉色菌和益生菌均可以促进表皮分化蛋白的表达,为微生物对表皮屏障的保护作用提供了依据[16,17]。
3D皮肤皮脂腺模型是近年来发展起来的用于皮肤生理病理及药物评价的体外模型[18]。该方法在原皮肤组织培养的基础上,增加了和永生化SZ95人皮脂腺细胞共培养[19]。皮脂腺具有向皮脂腺细胞和角质形成细胞双向分化潜能的干细胞功能[20],带有完整皮脂腺的模型可以更好地维持表皮的完整性,为实验的可持续性提供可能。我们对该模型进行形态学及基底细胞增殖评估,验证了该模型比单纯的皮肤组织培养可以更好的维持表皮完整和生物学活性。
我们在该模型上进一步探索微生物对表皮增殖与分化的作用。结果表明,三种PAMPs在0~200 μg/mL范围内剂量依赖性地促进表皮增殖。其中,LTA和LPS在200 μg/mL浓度时表皮增厚最大,而PGN在20 μg/mL即达到最高值,我们推测,革兰氏阳性菌的胞壁成分对促进表皮细胞分化可能具有更加明显的作用。PGN是革兰氏阳性菌如包括丙酸杆菌细胞壁的重要组成部分,在一项通过胶带粘贴剥离的表皮屏障损伤模型中,在皮肤去除角质层后的起始阶段观察到了丙酸杆菌的相对增加[19],我们推测,相对于其他皮肤微生物,丙酸杆菌在皮肤修复方面可能具有更加即时的反应[12]。此外,LTA和LPS在较低浓度时即可对表皮细胞产生明显的促分化作用,但两者的表皮增厚最明显在200 μg/mL浓度,可能LTA和LPS在较低浓度时促进表皮细胞的分化,但只有在高浓度时才可以最大程度地促进表皮细胞增殖,说明微生物浓度的变化影响了表皮增殖和分化。PGN在20 μg/mL浓度时表皮增殖及促分化作用均达到最大,这可能是痤疮丙酸杆菌定殖与增殖的变化在皮肤疾病中具有明显作用的原因之一。

A组:新鲜对照,空白对照及在2、20、200 μg/mL浓度刺激下,LTA,LPS,PGN增殖指标Ki67免疫组化染色(IHC,×400);B组:表皮在对照组及不同浓度LTA,LPS,PGN刺激下,分化指标CK10免疫组化染色(IHC,×400)
图3 病原相关分子模式对表皮细胞增殖和分化的影响
人皮肤微生物的种类和数量会随着年龄性别的不同而产生差异。新生儿皮肤的微生物是获得性的,根据生产的方式可以从母体获得一定的微生物[21],到青春期时,由于激素水平的刺激,皮肤微生物的菌群结构和分布会发生很大的改变,例如,促进皮脂分泌的痤疮丙酸杆菌就会占主导作用[22,23]。另外,由于年龄性别以及与疾病易感性的个体差异,不同年龄段会发生不同,最常见的就是青春期痤疮的高发率[24];特应性皮炎常常起病于儿童或青春期前,并可能持续终生[25]。这表明微生物的种类和量的变化可以对人皮肤生理产生不同的影响,一旦微生物的种类或者微生物的量发生了实质性改变,就有可能会造成病理变化。我们的实验结果也说明了微生物可以促进表皮增厚,这可能是微生物对表皮细胞增殖和分化影响的结果。
总之,本研究探讨了皮肤微生物对表皮细胞有促进增殖和调节分化的作用,并剂量依赖性诱导表皮增厚,这可能是微生物参与皮肤生理、保护皮肤屏障的机制之一。微生物是皮肤屏障和功能的重要组成,对于相关疾病,我们不应以单纯消灭微生物为治疗目的。

