从临床药物中筛选抑制梨果实采后青霉病的活性物质
张时馨,彭丽桃,范 明,杨书珍,闫 等
(华中农业大学食品科学技术学院,湖北 武汉 430070)
扩展青霉是引起采后水果腐烂变质的重要病原真菌之一,其在侵染果实的过程中会产生大量具有致癌致畸风险的展青霉毒素,对人们生活造成很大的安全隐患。目前,有关采后扩展青霉防治方法的报道主要集中在以生防酵母为主的生物防治方法;以热处理、低温贮藏、涂膜保鲜等为主的物理防治方法以及以化学杀菌剂为主的化学防治。化学防治方法操作方便、价格低廉,目前是农业生产中控制果实采后青霉病的主要方式,其中,噻菌灵、嘧霉胺和咯菌腈等化学杀菌剂最为常用。但由于长期、大量地使用化学杀菌剂会引起抗性菌株逐渐增加。Baraldi等从商业包装房贮存的感病梨果实中分离出41 种噻苯达唑抗性菌株和9 种敏感性菌株[1];也有学者发现从商业包装箱贮存的染病苹果中分离的扩展青霉在0~500 μg/mL嘧霉胺处理后抗性逐渐增加[2];Amiri等在华盛顿州苹果包装房中分离的扩展青霉在不同浓度的咯菌腈处理后其敏感性也显著降低[3]。化学杀菌剂剂量增加、农药残留等问题日渐突出[4]。因此,研究安全、低毒、高效的抗扩展青霉杀菌剂对于减少采后水果的腐烂变质和安全生产具有重要的意义。
新型杀菌剂开发耗时长、成本高,且药物安全性无法保障。“老药新用”的快速发展为解决这一难题提供了契机。与传统新药研发相比,药物再利用具有研究成本低、风险小、效率高等优势。近年来,研究发现了许多传统药物的新功能。如作为经典镇痛剂的阿司匹林具有抗血栓的作用[5];抗疟疾药物氯喹能治疗由禽流感H5N1病毒等引起的A549细胞自噬性死亡[6];洛沙坦可治疗高血压和用作糖尿病肾病的血管紧张素II受体拮抗剂,并可显著缓解H5N1病毒引起的小鼠急性肺损伤[7]。因此,“老药新用”在药物开发中具有广阔的应用前景。
细胞膜的主要功能是维持细胞稳定代谢的胞内环境,调节和选择物质进出细胞。很多临床药物通过干扰细胞膜的功能来发挥其药理作用。唑类药物通过干扰细胞膜中羊毛甾醇14-α-脱甲基酶的稳定性而选择性地抑制麦角甾醇的产生,从而破坏细胞膜结构[8-9]。特比萘芬和萘替芬等烯丙胺类药物主要以细胞膜上的角鲨烯环氧酶为作用靶标[4]。此外,干扰能量代谢也是许多临床疾病治疗药物的主要作用方式。如强心苷、依布硒等药物主要通过转换心肌能量代谢方式,改善患者心肌缺血及心脏功能,达到治疗作用[10-11]。胺碘酮、吩噻嗪类等药物通过干扰能量代谢达到抗心律失常和镇静作用[12-13]。但是,目前对于以细胞膜功能和能量代谢为主要作用方式的临床药物在其他生物体上的作用研究较少,尤其在水果采后病原菌的应用研究中鲜有报道。因此,本实验从26 种以干扰细胞膜功能和能量代谢为主要作用机制的传统临床药物中筛选对扩展青霉具有显著抑菌效果的抗菌药物,并对其抑菌特性进行研究,以期筛选出有效控制扩展青霉的抗菌剂,为传统临床药物在采后水果防腐保鲜方面的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
扩展青霉(Penicillium expansum)购自中国农业微生物菌种保藏管理中心。将菌种接种于马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基上,(26±2)℃培养3~4 d后,继续传代培养,4 ℃冰箱保存。梨果实(Pyrus bretschneideri Rehd.)品种为‘皇冠梨’,购于湖北省武汉市洪山区狮子山街梧桐路中百超市。
联苯苄唑(纯度(下同)≥98%) 阿达玛斯试剂有限公司;氟康唑(98%)、硝酸咪康唑(98%)、酮康唑(≥98%)、克霉唑(99%)、香芹酚(99%)、纳他霉素(≥95%)、穿心莲内酯(98%)、5-氟胞嘧啶(99%)、兰索拉唑(≥98%)、盐酸异丙嗪(≥98%)、辛伐他汀(98%)、洛伐他汀(98%)、三氟拉嗪二盐酸盐(≥98%)、丁香酚(98%)、麝香草酚(98%)、N,N-二环己基碳二亚胺(98%)、制霉菌素(99%) 上海麦克林生化科技有限公司;奋乃静(99%) 北京百灵威科技有限公司;新穿心莲内酯(≥98%)、脱水穿心莲内酯(≥98%)、甲硝唑(98%) 上海源叶生物科技有限公司;盐酸氯丙嗪(≥98%)、依布硒(≥98%) 阿拉丁(上海)试剂公司;泮托拉唑硫酸盐(≥98%)、胺碘酮盐酸盐(≥98%) 梯希爱(上海)化成工业发展有限公司。
1.2 仪器与设备
YX-280立式高压灭菌锅 合肥华泰医疗设备有限公司;SPX-150BIII生化培养箱 北京鑫润科诺仪器仪表有限公司;EX20 Thermo Fisher显微镜 宁波舜玉仪器有限公司;SW-CJ-1FD超净工作台 苏州净化设备有限公司;SHZ-82A气浴恒温振荡器 江苏省金坛市宏华仪器厂;BS-210S分析天平 赛多利斯科学仪器(北京)有限公司。
1.3 方法
1.3.1 抗菌药物的筛选
抗菌药物的筛选采用孢子萌发法[14]进行。将40 μL 1×106个/mL的P. expansum孢子菌悬液接种在含有不同质量浓度抑菌剂的PDA培养基上,置于26 ℃下培养9 h,在显微镜下观察孢子萌发状态,统计孢子萌发数量,计算孢子萌发率和抑制率,以药物质量浓度为横坐标,孢子萌发抑制率为纵坐标,根据药物毒力回归方程计算药物抑菌的半最大效应浓度(the median effective concentration,EC50)[15]。
1.3.2 联苯苄唑对扩展青霉菌丝生长的影响
将培养24 h的菌饼反贴于含有联苯苄唑的PDA培养基上,置于26 ℃下培养,并定期测定菌饼直径[16]。以培养2 d时完全没有菌丝生长的最低浓度作为最小抑菌浓度(the minimum inhibitory concentration,MIC),以培养4 d时肉眼看不到菌丝生长的最低浓度作为最小杀菌浓度(the minimum fungicidal concentration,MFC)[17]。
菌丝体生物量测定实验:称取1.5 g于26 ℃条件下培养24 h的菌丝,分别加入含12.8 μg/mL联苯苄唑药液的马铃薯液体培养基(potato dextrose broth,PDB)和不含药液的PDB(对照)中,于26 ℃恒温摇床中120 r/min培养24 h,并在0、6、12、24 h收集菌丝,生物量以菌丝干质量表示。每个组设3 次重复。
1.3.3 联苯苄唑对扩展青霉的抑菌稳定性研究
在研究pH值对联苯苄唑抑菌稳定性的影响时,用1 mol/L NaOH和HCl溶液将pH值调节至3.5、4.5、5.5、6.5、7.5的PDA与1.6 μg/mL联苯苄唑药液混合;在研究温度对联苯苄唑抑菌稳定性的影响时,将1.6 μg/mL联苯苄唑药液在4、25、50、75、100 ℃水浴处理30 min;在研究无机离子对联苯苄唑抑菌稳定性的影响时,将0.5 mol/L的NaCl、MgCl2、KCl、CaCl2、ZnCl2、FeCl3与1.6 μg/mL联苯苄唑的PDA混合;在研究紫外线照射对联苯苄唑抑菌稳定性的影响时,将1.6 μg/mL的联苯苄唑药液在紫外强度为1 200 lx的紫外灯下20 cm处分别照射1、2、3、4 h[18-19]。上述5 种处理中,以不做处理的1.6 μg/mL的联苯苄唑为对照,经过不同处理的联苯苄唑溶液与已灭菌的PDA培养基混合均匀,待培养基凝固后,按照菌饼法[16]将于26 ℃下培养24 h的菌饼反贴于含药培养基上,置于26 ℃下培养,并定期测定菌饼直径。在测定无机离子对联苯苄唑抑菌稳定性时,在第4天测定菌饼直径。每个处理设3 次重复。
1.3.4 联苯苄唑处理对‘皇冠梨’果实青霉病的防治效果
挑选无病虫害、无机械伤且大小、色泽、成熟度等外观品质一致的‘皇冠梨’果实,用体积分数为0.2%的次氯酸钠溶液浸泡2 min,蒸馏水洗净后于超净工作台中晾干。在果实腰部对果皮均匀造成0.3 cm×0.3 cm的伤口并接种15 μL 128 μg/mL的联苯苄唑药液和5 μL 1×105个/mL P. expansum孢子悬浮液后放于保鲜盒内并用保鲜袋封口,于室温下存放。5 个果实为一组,每组重复3 次,以接种等体积蒸馏水作对照(CK),分别在第1、3、5、7天观察并记录病斑直径。
1.4 数据处理与分析
利用Excel软件进行数据处理,数据结果以平均值±标准差表示。采用SPSS 20软件进行单因素方差分析,应用最小显著性差异(least significant difference,LSD)法检验差异显著性(P<0.05)。
2 结果与分析
2.1 扩展青霉抗菌物质的筛选

表 1 不同抗菌药物对P. expansum孢子萌发的抑制活性Table 1 Inhibitory activity of drugs against spore germination of P. expansum
本实验通过孢子萌发法对26 种传统临床药物对扩展青霉的抑菌活性进行了评价,结果如表1所示。26 种传统临床药物对扩展青霉孢子萌发均表现出不同程度的抑制作用,但不同药物之间的抑菌活性具有较大差异。其中硝酸咪康唑、克霉唑、酮康唑、联苯苄唑、纳他霉素、5-氟胞嘧啶、依布硒6 种药物对扩展青霉表现出强烈的抑菌效果,EC50均小于2 μg/mL,其中硝酸咪康唑和联苯苄唑的EC50分别为0.02 μg/mL和0.04 μg/mL。而甲硝唑、洛伐他汀对扩展青霉的抑制效果相对较弱,EC50大于100 μg/mL。此外,从结果可以看出,所试药物的抑菌活性与药物的种类相关,咪唑类药物抑菌效果最强,平均EC50达到0.094 μg/mL。其次为吩噻嗪和酚类药物,平均EC50分别为23.108 μg/mL和36.667 μg/mL,而内酯类药物的平均EC50是酚类药物的3 倍,抑菌效果较差。本研究还发现,依布硒、纳他霉素和5-氟胞嘧啶具有较强的抑菌效果,其中5-氟胞嘧啶EC50达到0.084 μg/mL,也是具有杀菌潜力的药物之一。
在8 种唑类药物中,咪唑类药物硝酸咪康唑、克霉唑、酮康唑、联苯苄唑的抑菌效果最强,其次是三唑类的氟康唑,再次是苯并咪唑和硝基咪唑。4 种吩噻嗪类药物也表现出不同抑菌活性,奋乃静的EC50为4.998 μg/mL,远高于其他3 种药物。内酯类药物中,辛伐他汀的EC50为12.182 μg/mL,抑菌活性高于其他4 种内酯类药物,而洛伐他汀对扩展青霉则无明显抑菌效果。在3 种酚类化合物中,虽然香芹酚和麝香草酚作为同分异构体,但两者的抑菌活性却有较大差异,麝香草酚的EC50是香芹酚的2 倍。
2.2 联苯苄唑对扩展青霉菌丝生长的影响
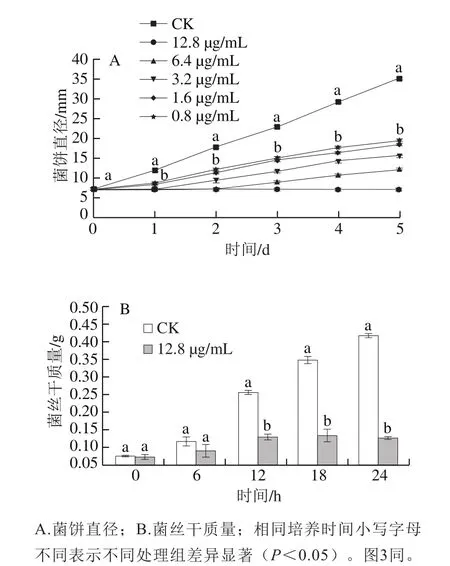
图 1 联苯苄唑对P. expansum菌丝生长的影响Fig. 1 Effect of bifonazole on the growth of P. expansum mycelium
由于联苯苄唑具有价格低廉、对扩展青霉抑制效果显著的优点;因此,本实验对联苯苄唑的抑菌特性进行了深入研究。如图1A所示,联苯苄唑能显著抑制在固体PDA培养基中培养的扩展青霉菌丝体的生长,且具有明显的浓度效应,其MIC和MFC分别为6.4 µg/mL和12.8 µg/mL。同时,联苯苄唑处理显著降低了液体PDB培养基中培养的菌丝体生物量。对照组菌丝体生物量随着培养时间的延长均匀增加,而处理组菌丝体生物量增长缓慢,联苯苄唑处理12 h后均显著低于对照组(P<0.05)(图1B)。因此,联苯苄唑处理对扩展青霉菌丝体的生长具有显著的抑制作用。
2.3 联苯苄唑对扩展青霉的抑菌稳定性的影响
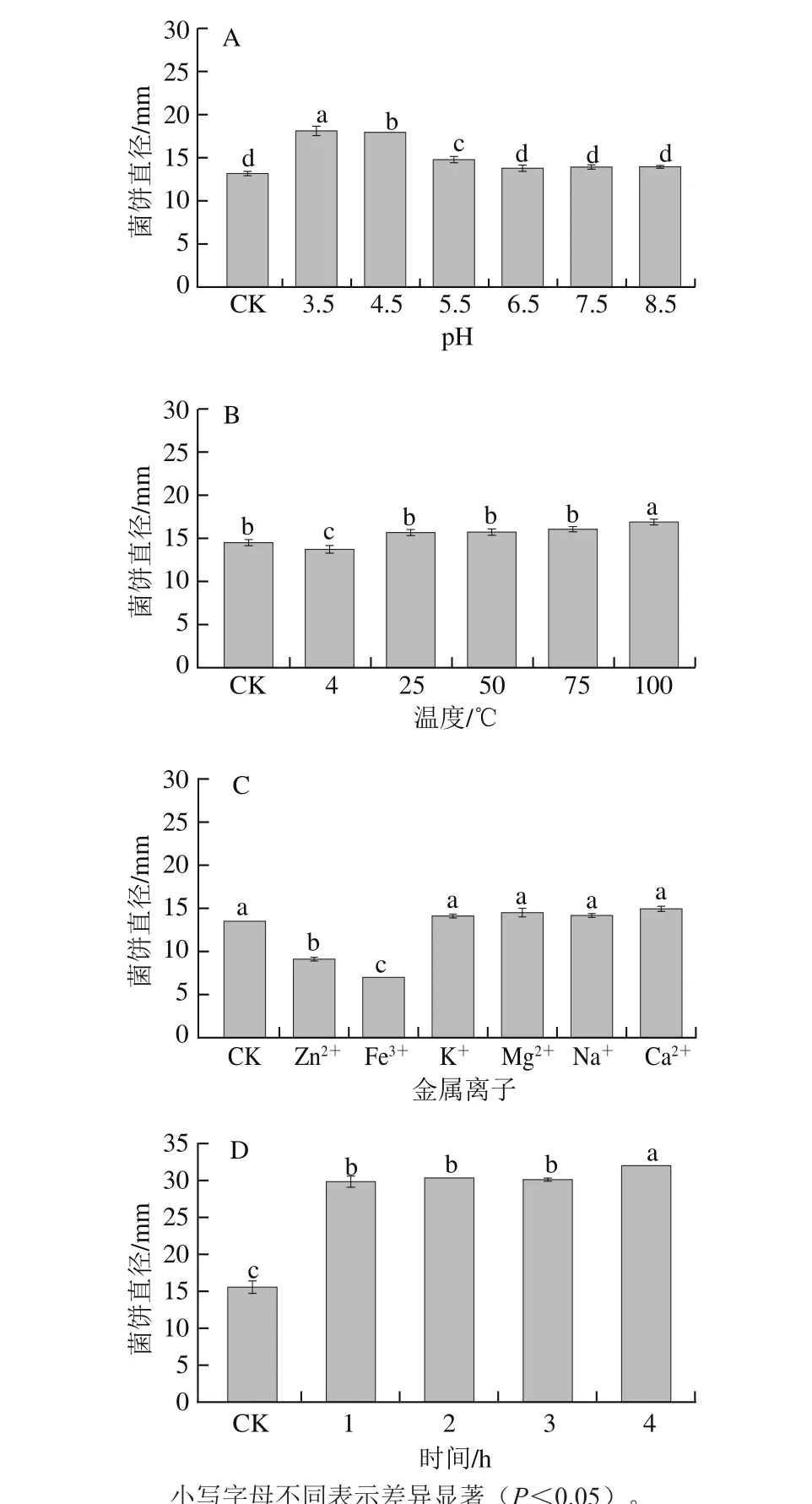
图 2 pH值(A)、温度(B)、金属离子(C)、紫外照射时间(D)对联苯苄唑的抑菌稳定性的影响Fig. 2 Effects of pH (A), temperature (B), metal ions (C) and UV irradiation time (D) on bacteriostatic stability of bifonazole
为了研究影响联苯苄唑对扩展青霉抑菌稳定性的因素,本实验测定了在不同pH值、温度、离子和紫外照射下联苯苄唑对扩展青霉抑菌活性的影响,结果如图2所示。pH 6.5~8.5时,联苯苄唑处理组菌饼直径与对照组无显著性差异(P>0.05),pH 3.5~5.5时,菌饼直径显著高于对照组(P<0.05)。表明联苯苄唑在中性及弱碱性条件下稳定,对酸敏感。在25、50、75 ℃时,联苯苄唑处理组与对照组菌饼直径无显著性差异(P>0.05),在4 ℃时,处理组菌饼直径显著低于对照组(P<0.05),表明低温能增强联苯苄唑的抑菌活性;而在100 ℃时,处理组菌饼直径显著高于对照组(P<0.05),表明高温下联苯苄唑热稳定性较低。在Zn2+、Fe3+的作用下,联苯苄唑处理组菌饼直径分别减小了32.52%和48.15%,表明Zn2+、Fe3+能增强联苯苄唑的抑菌活性,而K+、Mg2+、Na+、Ca2+处理组与对照组无显著性差异(P>0.05)。同时,紫外照射1 h后,各处理组菌饼直径均显著高于对照组(P<0.05),表明联苯苄唑对紫外照射敏感。
2.4 联苯苄唑处理对‘皇冠梨’果实青霉病的防治效果

图 3 联苯苄唑处理对‘皇冠梨’果实青霉病的防治效果Fig. 3 Inhibitory effect of bifonazole on blue mold caused by Penicillium expansum on ‘Huangguan’ pear fruit
本实验采用人工接种的方法研究了联苯苄唑对‘皇冠梨’果实青霉病的防治效果。如图3A所示,随着贮藏时间的延长,对照组和联苯苄唑处理组梨果实病斑直径均逐渐增大,处理组果实病斑直径前3 d变化缓慢,3 d以后才有所增加,同时在整个贮藏过程中,处理组果实的病斑直径显著低于对照组(P<0.05)。接种后第3天时,对照组果实病斑直径为9.73 mm,是处理组的2.92 倍,第5天和第7天分别是处理组的1.68 倍和1.40 倍。从防治效果看,处理后第3天,对照组果实开始发生腐烂,伤口处先变软,随后病斑直径迅速增大;而处理组果实腐烂程度明显低于对照组(图3B)。因此,联苯苄唑处理对‘皇冠梨’果实青霉病具有明显的防治效果。
3 讨 论
在美国食品药品监督管理局批准的新药中,70%~80%是具有新用途的已批准药物,即“老药新用”[20]。许多临床药物的有效性与安全性在长期的临床实验中已被证实,其作用方式、药理作用也更详尽,在此基础上研发新用途,“老药新用”显然更具优势,也为新药开发提供了捷径。本实验从26 种以干扰细胞膜功能和能量代谢的传统药物中筛选抗扩展青霉活性物质,发现以细胞膜为主要作用靶标的那他霉素、咪唑类等药物对扩展青霉具有强烈的抑菌作用;同时,依布硒、胺碘酮、吩噻嗪类等干扰能量代谢的药物也具有较强的抑菌活性。因此,从以细胞膜为靶标和干扰能量代谢为主要作用机制的传统药物筛选水果采后杀菌剂是可行的。
唑类药物作为临床上常用的广谱抗真菌剂,对白色念珠菌、光滑念珠菌、热带假丝酵母等许多病原菌表现出强烈的抗真菌活性[21]。在本实验中发现,咪唑类药物对扩展青霉的抑菌活性最强,是用于果蔬保鲜最有吸引力的抗菌药物种类。其对扩展青霉的抑菌效果显著高于三唑类药物氟康唑。Nenoff等研究了几种常见的头皮分离菌株对唑类抗真菌药物的体外药物敏感性实验,发现几种头皮分离菌株的药物敏感性为联苯苄唑>咪康唑>氟康唑[22]。在本实验的4 种咪唑类药物中,咪康唑和联苯苄唑的抑菌效果强于克霉唑和酮康唑,表明前两种药物的应用潜力更大。其次,吩噻嗪类药物作为临床抗精神病类药物对扩展青霉也具有抑菌效果,其中奋乃静的抑菌效果明显高于其他3 种药物,是“老药新用”中有潜力的药物。据报道,奋乃静和三氟拉嗪对结核杆菌、热带假丝酵母菌、金黄色葡萄球菌也具有很强的抑制作用[23]。也有研究表明,一些四环吩噻嗪和五环吩噻嗪类化合物因吩噻环的数量不同也表现出不同的抗菌活性[24]。此外,纳他霉素、依布硒和5-氟胞嘧啶对扩展青霉也具有较强的抑菌活性。张小华等发现纳他霉素对黄曲霉、黑曲霉、丝孢酵母等11 种腐败菌均具有显著的抑菌活性[25]。Thangamani等的研究结果也表明,依布硒不仅能抑制肠球菌生长,还显示出对金黄色葡萄球菌细胞内抗性的清除作用[26]。因此,从老药中筛选有效控制扩展青霉的抗菌活性物质具有潜在的应用价值。
联苯苄唑是一种高效、安全且耐受良好的咪唑类抗真菌药物,具有广谱的抗真菌活性,可抑制皮肤真菌、酵母菌、霉菌的生长[27-28],对少数细菌也具有抑菌活性,且抑菌活性强于克霉唑和咪康唑[29]。此外,在临床癣菌感染治疗中,联苯苄唑的治疗效果显著优于克霉唑、益康唑、咪康唑等抗真菌药物,且具有较高的安全性[30]。在动物实验中也发现,对家猫身上涂抹联苯苄唑30 h后,体内血液中联苯苄唑的质量浓度依然可以达到140 ng/mL,具有良好的治疗效果,而在组织细胞中的储存量极少,且毒副反应较小,提高了用药安全性[31]。也有研究报道,联苯苄唑不仅作用于真菌细胞膜14-α-脱甲基酶,还作用于羟甲基麸氨酸辅酶A还原酶,这种对真菌细胞膜的特异性双重抑菌作用与其他药物相比也具有更高的安全性[32],但在果蔬采后病原菌的应用中却鲜见报道。在本实验中,通过对联苯苄唑抑菌特性进一步研究发现,联苯苄唑能够显著抑制果实采后重要病原真菌扩展青霉菌丝体的生长,且在温度25、50、75 ℃,含K+、Mg2+、Na+、Ca2+的环境及中性、弱碱性条件下抑菌活性稳定。在‘皇冠梨’果实的体外接种实验结果中也表明联苯苄唑处理对‘皇冠梨’果实青霉病具有明显的防治效果。
综上所述,本实验从26 种传统药物中筛选出了硝酸咪康唑、克霉唑、联苯苄唑、酮康唑、5-氟胞嘧啶、纳他霉素、依布硒等对扩展青霉具显著抑菌效果的药物,为新型杀菌剂的研究和“老药新用”提供了参考。此外,联苯苄唑具有稳定的抑菌效果,对‘皇冠梨’果实青霉病的显著抑制效果也表明其在果蔬采后病害控制中存在的应用价值,该研究为联苯苄唑在水果采后病害防治中的进一步研究提供了参考。

