三种益生菌发酵剂固态发酵对豆粕营养品质的影响
王 梅,谢全喜*,侯楠楠,雷春红,谷 巍
(山东宝来利来生物工程股份有限公司 山东省动物微生态制剂省级重点实室,山东 泰安 271000)
豆粕是大豆经浸提脱油后的副产物,蛋白质和氨基酸含量较高,且其组成合理、均衡,是一种优质植物性蛋白源[1],也是动物主要的蛋白质饲料之一,广泛应用于动物养殖中[2]。但豆粕中含有多种抗营养因子,严重影响了动物机体对豆粕中营养物质的吸收和利用,对动物机体的某些器官造成影响和损伤[3]。豆粕经发酵后可显著降低或钝化其抗营养因子,将大分子蛋白分解为小肽或氨基酸,提高豆粕的消化率,降低饲料成本[4-5]。
发酵豆粕的首要任务是发酵菌种的选择,一般筛选具有特殊能力的菌种,如能将淀粉等大分子分解为小分子的微生物,降解大分子蛋白较强的微生物,以及能够产生特殊风味的微生物等[6]。赵彩艳等[7]选用枯草芽孢杆菌(Bacillus subtilis)发酵豆粕制备益生菌饲料,筛选出适宜发酵的最优条件;史玉宁等[8]研究发现,选用米曲霉(Aspergillus oryzae)和酿酒酵母(Saccharomyces cerevisiae)复合菌种发酵豆粕,粗蛋白含量提高21.27%、酸溶蛋白含量提高695.97%;曾亚桐等[9]选用枯草芽孢杆菌与产朊假丝酵母(Candida utilis)单菌和混合菌种发酵,发现混合发酵豆粕能够大幅度提高降解抗营养因子的速度,其混合发酵的最佳时间为60~72 h;毛银等[10]研究发现,利用植物乳杆菌(Lactobacillus plantarum)发酵豆粕显著提高了有机酸含量,改善了豆粕品质。
发酵豆粕一般采用固态发酵技术,固态发酵技术更接近自然条件,操作简单,成本较低。目前,国内许多企业都在生产发酵豆粕,吴明海等[11]研究了好氧与厌氧两种方式对发酵豆粕品质的影响发现,厌氧发酵粗蛋白、活菌数和色泽优于好氧发酵,更适合幼畜使用。张代等[12]研究了不同厂家发酵豆粕品质的差异,发现不同厂家发酵豆粕产品理化指标差异较大,可能与不同厂家发酵菌种和生产工艺不同。目前,市面上的益生菌发酵剂良莠不齐,生产工艺不同,生产的发酵豆粕品质差异较大[13]。本研究选用不同的益生菌组合发酵剂对豆粕进行固态厌氧发酵,对发酵后的豆粕的感官品质、pH值、有益微生物含量、营养指标及卫生指标进行分析比较,筛选出最适发酵剂,以此提高豆粕的营养价值,为发酵豆粕的生产加工提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
国产去皮豆粕:市场。黄色,无霉变,无结块,无异味,粉碎后过筛。
1.1.2 益生菌发酵剂
益生菌发酵剂A:由乳酸菌、酵母菌、中性蛋白酶和酸性蛋白酶等组成,活菌总数≥30.0×108CFU/g;益生菌发酵剂B:由乳酸菌、芽孢菌和中性蛋白酶等组成,活菌总数≥20.0×108CFU/g;益生菌发酵剂C:由乳酸菌、酿酒酵母和中性蛋白酶等组成,活菌总数≥15.0×108CFU/g。其中A款和B款发酵剂为市场上销售的两款益生菌发酵剂,C款益生菌发酵剂由山东宝来利来生物工程股份有限公司提供。
1.1.3 培养基
MRS固体培养基:葡萄糖20 g/L,蛋白胨10 g/L,牛肉膏8 g/L,酵母膏4 g/L,硫酸镁0.5 g/L,硫酸锰0.3 g/L,柠檬酸铵2 g/L,乙酸钠5 g/L,吐温-80 1 mL/L,琼脂1.5 g/L,pH值6.0,121 ℃灭菌20 min。
酵母膏蛋白胨培养基、孟加拉红选择性培养基、伊红美蓝培养基:青岛海博生物技术有限公司。
1.1.4 试剂
氢氧化钠(分析纯):天津凯通化学试剂有限公司;氯化钠(分析纯):天津博迪化工股份有限公司;柠檬酸铵(分析纯):上海抚生实业有限公司;硫酸(分析纯):天津市致远化学试剂有限公司;硫酸镁、硫酸锰(均为分析纯):济南汇丰达化工有限公司;乙酸钠(分析纯):青岛捷世康生物科技有限公司;蛋白胨(生化试剂):北京奥博星生物技术有限责任公司;酵母膏(生化试剂):天津市英博生化试剂有限公司;葡萄糖(生化试剂):山东祥瑞药业有限公司。
1.2 仪器与设备
PHS-3C雷磁精密pH计:上海仪电科学仪器股份有限公司;DHP-9082数显恒温培养箱:上海一恒科学仪器有限公司;DHG-9140A电热鼓风干燥箱:常州诺基仪器有限公司;KDN-103F自动定氮仪、HYP308消化炉:上海纤检仪器有限公司;HH-4恒温水浴锅:国华电器有限公司;SHB-ⅢS循环水式多用真空泵:郑州长城科工贸有限公司;XW-80A旋涡混合器:上海弛唐电子有限公司;SD120D超声波清洗机:宁波新芝生物科技股份有限公司;SX2-4-10箱式电阻炉:龙口市电炉制造厂;LD5-2A低速离心机:北京京立离心机有限公司;LC-20A高效液相色谱(high performance liquid chromatography,HPLC)仪:日本津岛公司。
1.3 方法
1.3.1 发酵豆粕的制作
准确称取200 g粉碎豆粕,按料水比5∶4(g∶mL)加入蒸馏水,混匀,按豆粕质量的2‰接种发酵剂,以不接种任何发酵剂的空白料为对照,32 ℃恒温密封发酵72 h后,65 ℃烘干粉碎,得到发酵豆粕样品,备用。
1.3.2 发酵豆粕的感官评价
在光线正常且无异味的环境中,称取发酵豆粕样品于平皿中,通过眼观、鼻嗅及手捻等方式对发酵豆粕颜色、气味和手感特征等进行评价,具体评价标准参考NY/T 2218—2012《饲料原料发酵豆粕》中对发酵豆粕感官性状的要求。
1.3.3 pH值测定
准确称取10 g发酵豆粕样品于90 mL灭菌后的生理盐水中,搅拌均匀后直接采用玻璃电极pHS-3C型pH计测定pH值。
1.3.4 发酵剂和发酵豆粕中微生物含量的检测
分别按GB 4789.35—2016《食品微生物学检验乳酸菌》、GB 4789.15—2016《食品微生物学检验酵母菌计数测定》、DB32/T 2583—2013《饲料中饲用芽孢杆菌的测定》对发酵剂和发酵豆粕中的乳酸菌、酵母菌及芽孢杆菌的含量进行测定。其中乳酸菌计数选用MRS固体培养基,芽孢菌计数选用酵母膏蛋白胨培养基,酵母菌计数选用孟加拉红选择性培养基进行。
1.3.5 发酵豆粕营养指标的检测
水分含量:按GB/T 6435—2014《饲料中水分的测定》测定;粗蛋白质含量(以干物质计):按GB/T 6432—2018《饲料中粗蛋白的测定凯氏定氮法》测定;粗灰分含量(以干物质计):按照GB/T 6438—2007《饲料中粗灰分测定方法》测定;酸溶蛋白含量(以干物质计):采用三氯乙酸(trichloroacetic acid,TCA)法测定;总酸含量(以乳酸计):参照GB/T 12456—2008《食品中总酸的测定》测定;有机酸含量:参照GB 5009.157—2016《食品中有机酸的测定》,采用高效液相色谱法检测;中性蛋白酶活性、酸性蛋白酶活性:参照SB/T 10317—1999《蛋白酶活力测定》测定。
1.3.6 发酵豆粕卫生指标的检测
大肠杆菌:按照GB/T 18869—2002《饲料中大肠菌群的测定》测定;霉菌:按照GB 4789.15—2010《食品微生物学检验测定》测定。其中大肠杆菌计数选用伊红美蓝培养基,霉菌计数选用孟加拉红培养基。
1.3.7 数据处理与分析
试验数据用Excel软件进行初步处理后,采用SPSS13.0进行统计分析,采用One-way ANOVA进行方差分析,LSD法进行组间多重比较,结果以“平均值±标准差”表示,P<0.05表示差异显著。
2 结果与分析
2.1 三种益生菌发酵剂的比较

表1 三种益生菌发酵剂的比较Table 1 Comparison of three probiotic fermentation starters
由表1可知,益生菌发酵剂C主要由乳酸菌和酵母菌两种菌株组成,活菌总数为15.8×108CFU/g,中性蛋白酶活性为26 379.02 U/g,酸性蛋白酶活性未检测出。与益生菌发酵剂C相比,益生菌发酵剂A在组成菌株类型上相同,但活菌总数高达26.0×109CFU/g,中性蛋白酶活性为36 891.12 U/g,酸性蛋白酶活性为23 282.80 U/g;益生菌发酵剂B组成菌株类型则不同,主要由乳酸菌和芽孢杆菌组成,乳酸菌活菌数(10.0×108CFU/g)相近,芽孢菌活菌数为12.5×108CFU/g,中性蛋白酶间差异不大。
2.2 三种益生菌发酵剂固态发酵对发酵豆粕感官性状的影响
三种益生菌发酵剂固态发酵72 h后取样观察,发酵豆粕的感官性状见表2。
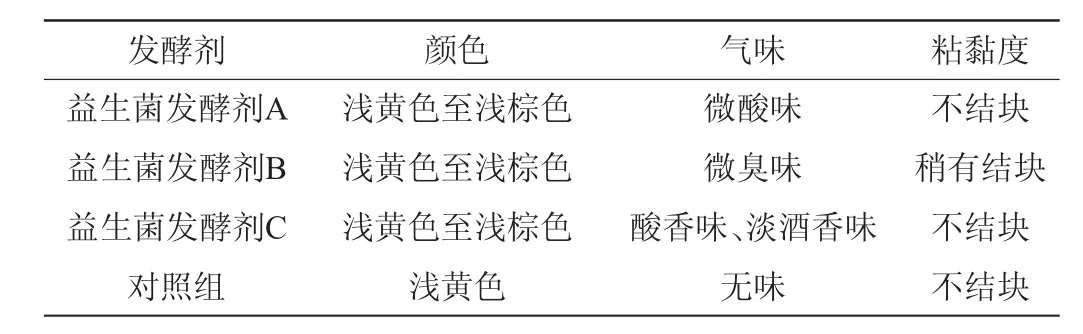
表2 三种益生菌发酵剂对发酵豆粕感官性状的影响Table 2 Effects of three probiotic fermentation starters on sensory trait of fermented soybean meal
由表2可知,三种益生菌发酵剂发酵豆粕后颜色差异不大,均为浅黄色至浅棕色,且色泽均匀一致;益生菌发酵剂C发酵豆粕后具有酸香味,还有淡淡的酒香味。益生菌发酵剂A具有微酸味,而益生菌发酵剂B发酵豆粕后具有微臭味,可能与发酵剂B中的芽孢杆菌有关;除益生菌发酵剂B稍有粘黏外,其余两种益生菌发酵剂发酵豆粕后均不黏连,这可能与益生菌发酵剂B中含有芽孢杆菌有关。
2.3 三种益生菌发酵剂对发酵豆粕pH值和有益微生物的影响
三种益生菌发酵剂固态发酵对发酵豆粕pH值和有益微生物的影响见表3。
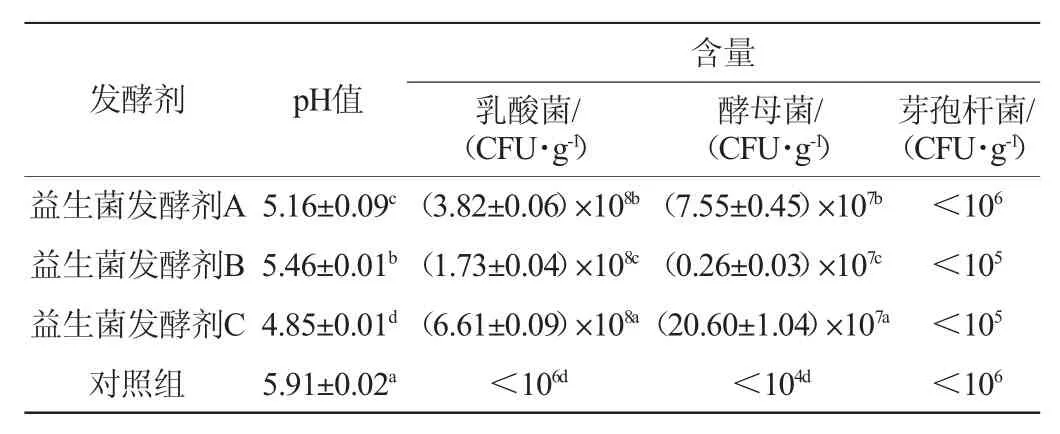
表3 三种益生菌发酵剂对发酵豆粕pH值和有益微生物的影响Table 3 Effects of three probiotic fermentation starters on pH and beneficial microorganisms of fermented soybean meal
由表3可知,三种益生菌发酵剂均能够显著降低发酵豆粕的pH值,其中以益生菌发酵剂C最低(4.85),且显著低于其余各组(P<0.05)。有益微生物含量方面:乳酸菌以益生菌发酵剂C最高(6.61×108CFU/g),其次是益生菌发酵剂A(3.82×108CFU/g),益生菌发酵剂B(1.73×108CFU/g)最低,三种益生菌发酵剂均显著高于对照组(P<0.05);酵母菌以益生菌发酵剂C最高(20.60×107CFU/g),其次是益生菌发酵剂A(7.55×107CFU/g),益生菌发酵剂B(2.6×106CFU/g)最低,三种益生菌发酵剂均显著高于对照组(P<0.05);芽孢杆菌数量均<106,其中益生菌发酵剂B中含有芽孢杆菌,说明芽孢杆菌未成功发酵。由pH值和有益微生物含量来看,益生菌发酵剂C固态发酵豆粕效果较优。
结果表明,三种益生菌发酵剂发酵豆粕,均能显著降低pH值(P<0.05),促进乳酸菌和酵母菌的生长繁殖。这与其他学者的研究报道一致[14]。酵母菌作为兼性厌氧菌,在发酵豆粕的前期利用豆粕提供的营养物质大量繁殖,消耗氧气,为乳酸菌的生长繁殖制造厌氧环境[15],有利于乳酸菌的生长。乳酸菌在发酵过程中能够将豆粕中的葡萄糖或乳糖转化为乳酸等有机酸,进而降低了发酵豆粕的pH值[15-16]。益生菌发酵剂B是由乳酸菌和芽孢杆菌复配而成,因此发酵效果不理想。
2.4 三种益生菌发酵剂对发酵豆粕营养指标的影响
三种益生菌发酵剂固态发酵对发酵豆粕营养指标的影响见表4。
由表4可知,三种益生菌发酵剂对水分和粗灰分的影响无显著性差异(P>0.05);粗蛋白含量以益生菌发酵剂C组最高(47.11%),显著高于益生菌发酵剂B(44.86%)和对照组(44.31%)(P<0.05),但与益生菌发酵剂A(46.10%)差异不显著(P>0.05),说明益生菌发酵剂C能够显著提高发酵豆粕的粗蛋白含量。与空白对照相比,三种益生菌发酵剂均能够显著提高发酵豆粕的酸溶蛋白含量(P<0.05),但三种益生菌发酵剂间差异不显著(P>0.05)。益生菌发酵豆粕能够改善豆粕的营养结构,其在繁殖过程中能够将豆粕中的非蛋白氮转化成营养价值更高的菌体蛋白,同时能够将大分子蛋白质转化成小分子肽,更有利于动物的消化吸收。SONG Y S等[17]研究发现,酿酒酵母(Saccharomyces cerevisiae)发酵豆粕总蛋白含量提高23.4%;马文强等[4]研究发现,使用乳酸菌、酵母菌和枯草芽孢杆菌混合对豆粕进行发酵,发酵后粗蛋白含量提高13.48%;侯楠楠等[18]研究表明,乳酸菌和酵母菌固态发酵豆粕使得粗蛋白质含量显著高出空白对照组6.07%,酸溶蛋白含量是对照的3.87倍。本试验与上述研究一致,三种益生菌发酵剂均能显著提高发酵豆粕的粗蛋白和酸溶蛋白含量,以益生菌发酵剂C效果较优。
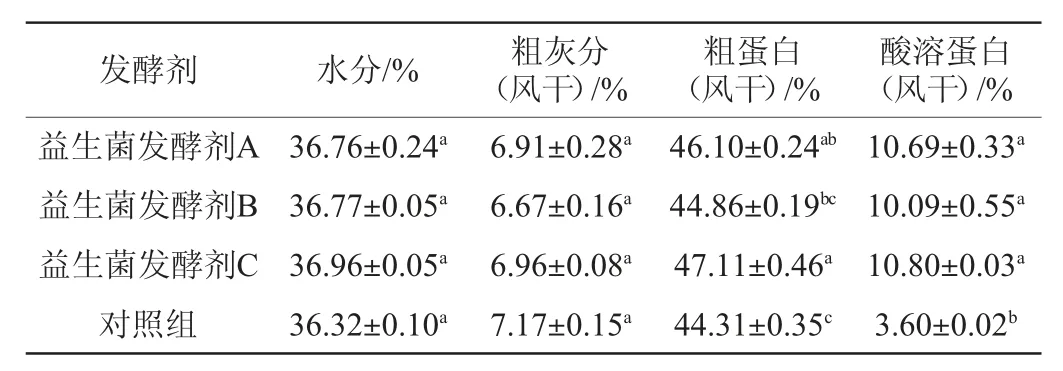
表4 三种益生菌发酵剂对发酵豆粕营养指标的影响Table 4 Effects of three probiotic fermentation starters on nutritional index of fermented soybean meal
2.5 三种益生菌发酵剂对发酵豆粕有机酸的影响
三种益生菌发酵剂固态发酵对发酵豆粕有机酸的影响见表5。

表5 三种益生菌发酵剂对发酵豆粕有机酸的影响Table 5 Effects of three probiotic fermentation starters on organic acid of fermented soybean meal
乳酸具有维持肠道菌群平衡,减少腹泻,促进钙质吸收的功能。乙酸是一种很好的抗微生物剂和酸味剂。酒石酸具有抗氧化和增强酸味的作用。柠檬酸具有抗氧化,增加酸味,抑制细菌生长的作用,是一种良好的食物酸味剂。琥珀酸可以产生酸味,可用作防腐剂使用。苹果酸是一种很好的稳定剂,具有较好的抗氧化能力,在酸性条件下,杀菌性很强,能促进氨基酸的吸收。由表5可知,三种益生菌发酵剂发酵豆粕的总酸含量均显著高于对照组(P<0.05),其中益生菌发酵剂C最高(19.81 g/kg),其次是益生菌发酵剂A(18.40 g/kg),两者差异均显著(P<0.05);三种益生菌发酵剂发酵豆粕中主要有6种有机酸,其中以乳酸、乙酸、酒石酸和柠檬酸为主。与对照组未发酵豆粕相比,三种益生菌发酵剂发酵豆粕均能够显著提高乳酸、乙酸、酒石酸和琥珀酸含量(P<0.05)。与益生菌发酵剂B相比,益生菌发酵剂A和益生菌发酵剂C均能够显著提高乳酸、乙酸、酒石酸和琥珀酸含量,在提高有机酸含量方面效果较优。与益生菌发酵剂A相比,益生菌发酵剂C能够显著提高有机酸乳酸、乙酸、酒石酸和柠檬酸含量(P<0.05)。综合比较,益生菌发酵剂C在提高发酵豆粕有机酸含量上效果较好。张明峰等[19]研究发现,发酵豆粕中乳酸含量提高,降低了发酵豆粕的pH值,改变了适口性;付亭亭[14]研究发现,使用产朊假丝酵母(Candida utilis)发酵豆粕后乳酸含量提高5倍,使用屎肠球菌(Enterococcus faecium)发酵豆粕后乳酸含量提高34倍。
2.6 三种益生菌发酵剂对发酵豆粕大肠杆菌和霉菌的影响
三种益生菌发酵剂固态发酵对发酵豆粕大肠杆菌和霉菌的影响见表6。
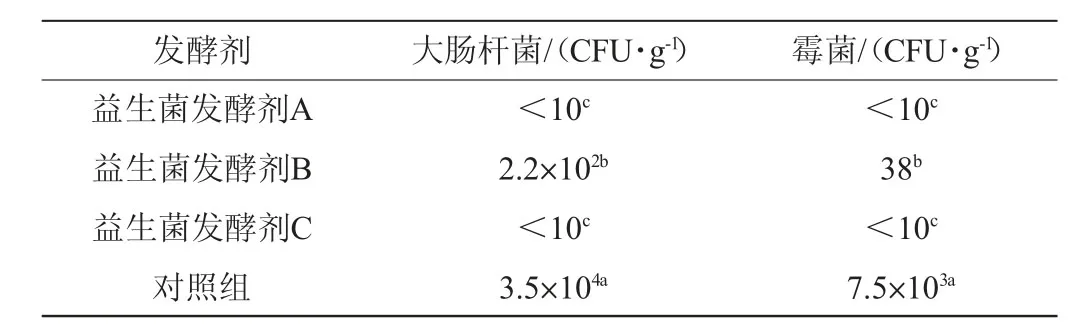
表6 三种益生菌发酵剂对发酵豆粕大肠杆菌和霉菌的影响Table 6 Effects of three probiotic fermentation starters on Escherichia coli and mold of fermented soybean meal
由表6可知,三种益生菌发酵剂发酵豆粕中大肠杆菌及霉菌含量均显著低于对照组(P<0.05),且益生菌发酵剂A和C效果较优。分析原因可能是益生菌发酵豆粕由于大量乳酸菌的生长繁殖,产生乳酸等有机酸,使得pH值显著降低,从而抑制大肠杆菌和霉菌等有害微生物的生长。侯楠楠等[18]研究表明,发酵豆粕较高的乳酸菌含量能够抑制大肠杆菌和霉菌的繁殖;王龙昌等[20]研究发现,发酵豆粕抑制大肠杆菌的繁殖,降低肉鸡的腹泻情况。本试验结果与上述研究相一致,使用复合益生菌乳酸菌和酵母菌复配发酵豆粕显著降低了大肠杆菌和霉菌数量。
3 结论
益生菌发酵剂A和C对发酵豆粕的感官性状影响不大,三种益生菌发酵剂均能够显著降低发酵豆粕的pH值、大肠杆菌和霉菌数量(P<0.05),显著提高有益微生物数量、粗蛋白、酸溶蛋白、总酸和有机酸含量(P<0.05)。三种益生菌中以益生菌发酵剂A和益生菌发酵剂C效果即乳酸菌和酵母菌固态发酵豆粕效果较好,结合成本考虑优先选择益生菌发酵剂C。

