直肠癌组织14-3-3 zeta、PUMA蛋白表达变化及其临床意义
余胜,钱海华
1 安徽医科大学第一附属医院,合肥230000;2 江苏省中医院
直肠癌是消化系统常见的恶性肿瘤之一。近年来,我国直肠癌的发病率有逐年上升趋势。恶性肿瘤是由肿瘤细胞无限增殖引起的,是细胞凋亡受到抑制的结果,因而细胞凋亡抑制被认为是恶性肿瘤形成的一个重要机制。已有研究证实,直肠癌的发生、发展与细胞凋亡异常密切相关[1]。14-3-3蛋白家族是真核生物细胞中普遍存在的一类高度保守的调节性蛋白家族,几乎参与生命体所有的生理过程。14-3-3 zeta蛋白是14-3-3蛋白家族成员之一,能够通过抑制细胞色素酶C释放来抑制半胱天冬酶和凋亡复合体活化,进而发挥抗细胞凋亡作用。14-3-3 zeta蛋白还能靶向于线粒体的核凋亡结构,通过干预线粒体核前凋亡蛋白,发挥抗细胞凋亡作用[2]。近年研究发现,14-3-3 zeta蛋白在胃癌、胶质母细胞瘤等恶性肿瘤的发生、发展中发挥重要作用[3,4]。Bcl-2家族蛋白是在细胞凋亡过程中起关键性作用的一类蛋白质。p53上调凋亡调节因子(PUMA)蛋白是新发现的Bcl-2家族蛋白成员,具有强大的促细胞凋亡作用。PUMA蛋白可通过依赖p53途径或非依赖p53途径促进细胞凋亡,其低表达或表达缺失能够促进胰腺癌、淋巴瘤、黑色素瘤等恶性肿瘤的发生、发展[5]。目前,14-3-3 zeta、PUMA蛋白与直肠癌发生、发展的关系尚不明确。为此,本研究观察了直肠癌组织14-3-3 zeta、PUMA蛋白表达变化,并进一步探讨其临床意义。现报告如下。
1 资料与方法
1.1 临床资料 选择2015年6月~2017年5月安徽医科大学第一附属医院收治的原发性直肠癌患者80例。所有患者经术后组织病理检查明确诊断。纳入标准:①符合原发性直肠癌诊断;②初诊;③接受直肠癌切除手术;④术前未接受任何抗肿瘤治疗;⑤临床病理资料完整。排除标准:①转移性直肠癌者;②合并其他部位恶性肿瘤者;③合并心、肝、肾等重要脏器严重功能不全者;④术前接受其他抗肿瘤治疗者;⑤临床病理资料不完整者。其中,男43例、女37例,年龄38~75岁(≤60岁52例、>60岁28例);肿瘤直径:≤5 cm 50例,>5 cm 30例;病理类型:腺癌62例,黏液腺癌18例;临床分期:Ⅰ、Ⅱ期47例,Ⅲ、Ⅳ期33例;组织分化程度:高中分化49例,低未分化31例;浸润深度:侵及浆膜层32例,未侵及浆膜层48例;有淋巴结转移54例,无淋巴结转移26例。本研究经安徽医科大学第一附属医院医学伦理委员会批准,患者或其家属知情同意。
1.2 14-3-3 zeta、PUMA蛋白表达检测 采用免疫组化法。取手术切除的直肠癌组织及其配对的癌旁组织(距肿瘤组织边缘>5 cm,经组织病理检查证实为正常直肠组织),中性甲醛固定,常规脱水、透明、浸蜡和包埋,4 μm厚连续切片。将切片置于60 ℃烘箱烤片30 min,二甲苯脱蜡,梯度乙醇水化,EDTA抗原修复液加热抗原修复,3% H2O2消除内源性过氧化物酶活性。5% BSA室温封闭30 min,分别加入14-3-3 zeta、PUMA一抗(稀释比均为1∶1 000),4 ℃孵育过夜。次日,加入辣根过氧化物酶标记的羊抗兔IgG二抗(稀释比1∶4 000),室温孵育60 min,DAB显色,苏木精复染,1%盐酸乙醇分化,自来水返蓝,梯度乙醇脱水,二甲苯透明,中性树胶封固,显微镜下观察。以PBS代替一抗作为阴性对照,用已知阳性切片作为阳性对照。
采用双盲法由两位病理科医师独立阅片,意见不一致时需协商讨论并取得一致意见。14-3-3 zeta蛋白阳性染色定位于细胞质,PUMA蛋白阳性染色定位于线粒体外膜,均呈浅黄色至棕褐色颗粒状[5]。采用半定量积分法评估染色强度和阳性细胞比例。染色强度评分标准:无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。每张切片随机选取5个200倍视野,计数阳性细胞数,计算阳性细胞比例。阳性细胞比例评分标准:无阳性细胞为0分,≤10%为1分,>10%~50%为2分,>50%~75%为3分,>75%为4分。以染色强度和阳性细胞比例综合评价,二者评分乘积≥3为14-3-3 zeta或PUMA蛋白阳性表达。
1.3 统计学方法 采用SPSS16.0统计软件。计数资料比较采用χ2检验或精确概率检验。相关性分析采用Spearman秩相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 直肠癌组织与癌旁正常组织14-3-3 zeta、PUMA蛋白表达比较 直肠癌组织与癌旁正常组织14-3-3 zeta蛋白阳性表达率分别为76.25%(61/80)、22.50%(18/80),PUMA蛋白阳性表达率分别为31.25%(25/80)、65.00%(52/80)。直肠癌组织14-3-3 zeta蛋白阳性表达率高于癌旁正常组织,PUMA蛋白阳性表达率低于癌旁正常组织(χ2分别为46.231、18.251,P均<0.05)。
2.2 直肠癌组织14-3-3 zeta蛋白阳性表达与PUMA蛋白阳性表达的关系 直肠癌组织14-3-3 zeta蛋白阳性表达者中,PUMA蛋白阳性表达17例、阴性表达44例;直肠癌组织14-3-3 zeta蛋白阴性表达者中,PUMA蛋白阳性表达8例、阴性表达11例。Spearman秩相关分析显示,直肠癌组织14-3-3 zeta蛋白表达与PUMA蛋白表达无明显相关性(r=-0.131,P>0.05)。
2.3 直肠癌组织14-3-3 zeta、PUMA蛋白表达与患者临床病理特征的关系 见表1。
3 讨论
直肠癌是发生于齿状线至直肠与乙状结肠交界处的恶性肿瘤,其发病多在40岁以后,以男性多见[6]。尽管手术、靶向治疗及放化疗已在直肠癌的治疗中取得了满意疗效,但患者5年总体生存率仍无法令人满意[7]。目前,直肠癌的发病机制尚不完全清楚。有研究认为,从正常直肠上皮细胞到直肠癌细胞的演变是多基因参与、多步骤发展的结果,而细胞凋亡异常在其发生、发展过程中扮演重要角色[8]。因此,深入研究与细胞凋亡相关的蛋白对揭示直肠癌发病的分子机制具有重要意义。
14-3-3蛋白家族是真核生物细胞中普遍存在的一类高度保守的调节性蛋白家族,几乎参与生命体所有的生理过程,如细胞周期调控、细胞信号转导、细胞凋亡等,在多种肿瘤的发生、发展过程中亦具有重要作用。14-3-3 zeta蛋白是该蛋白家族中的重要成员,通常以同源或异源二聚体形式存在[9]。细胞凋亡抑制和黏附力丧失是肿瘤形成过程中重要的生物学改变。14-3-3 zeta蛋白作为信号转导的中心环节,能够促进多种肿瘤细胞的增殖、黏附并抑制其凋亡。有研究报道,肝细胞癌组织14-3-3 zeta蛋白表达明显高于癌旁正常组织,且其表达与肿瘤组织学分级和血管浸润程度有关[10]。14-3-3 zeta蛋白与人表皮生长因子受体共同作用,能够促进乳腺癌的转移和复发[11]。Bcl-2家族蛋白是在细胞凋亡过程中起关键性作用的一类蛋白质。PUMA蛋白是新发现的Bcl-2家族蛋白成员,可通过依赖p53途径或非依赖p53途径促进细胞凋亡。在缺氧诱导的肿瘤模型中,PUMA蛋白丢失能够引起染色体的不稳定,提高肿瘤的发生概率[12,13]。已知在超过50%的人类肿瘤中发现p53基因突变或缺失,p53基因突变或缺失后失去诱导下游凋亡基因PUMA表达的功能,从而丧失了抑制肿瘤的作用[14]。在口腔鳞癌细胞中,上调PUMA蛋白表达可抑制肿瘤细胞增殖、侵袭,并促进其凋亡[15,16]。有研究还发现,14-3-3 zeta蛋白能够结合Bcl-2家族蛋白靶向于线粒体的核凋亡结构,通过干预线粒体核前凋亡蛋白发挥抗细胞凋亡作用[17,18]。由此推测,14-3-3 zeta、PUMA蛋白可能协同促进多种肿瘤的发生、发展,但二者与直肠癌的关系鲜见报道。
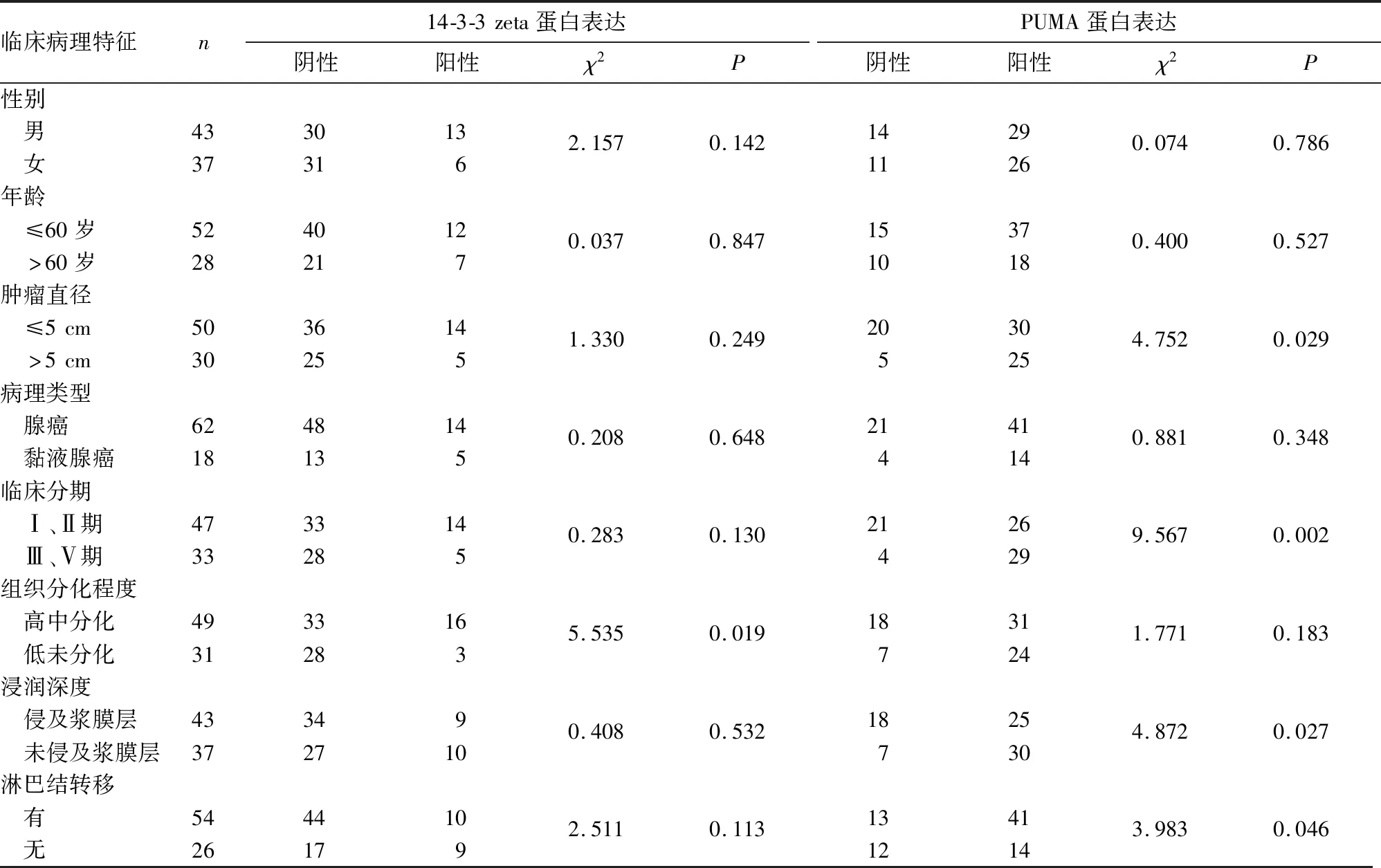
表1 直肠癌组织14-3-3 zeta、PUMA蛋白表达与患者临床病理特征的关系(例)
本研究结果显示,直肠癌组织14-3-3 zeta蛋白阳性表达率高于癌旁正常组织,PUMA蛋白阳性表达率低于癌旁正常组织,提示在直肠癌的发生、发展过程中14-3-3 zeta蛋白具有促癌作用、PUMA蛋白具有抑癌作用。本研究直肠癌组织14-3-3 zeta蛋白表达与组织分化程度有关,而与性别、年龄、肿瘤直径、病理类型、临床分期、浸润深度、淋巴结转移无关;直肠癌组织PUMA蛋白表达与肿瘤直径、临床分期、淋巴结转移、组织分化程度有关,而与性别、年龄、病理类型、浸润深度无关。提示14-3-3 zeta、PUMA蛋白表达与直肠癌的恶性进展有关。Spearman秩相关分析显示,直肠癌组织14-3-3 zeta蛋白表达与PUMA蛋白表达无明显相关性,表明在直肠癌中14-3-3 zeta、PUMA蛋白抗细胞凋亡作用可能是通过不同通路引起的,但其具体通路还不清楚,尚需进一步研究。
综上所述,直肠癌组织14-3-3 zeta蛋白高表达、PUMA蛋白低表达,二者表达变化能够促进直肠癌恶性进展。

