远隔缺血处理对脑缺血再灌注大鼠认知功能障碍的神经保护作用
徐耀铭,周文静,2,赵林,山花,赵文博,吉训明
脑缺血再灌注损伤(i s c h e m i c -reperfusion injury,I-RI)可以导致局灶性神经功能缺损和血管性认知障碍,对患者危害较大。血管性认知障碍(vascular cognitive impairment,VCI)病理生理机制异常复杂,临床上发现多数卒中患者都出现了不同程度的VCI症状,约30%发展为痴呆[1],目前仍缺乏有效的治疗措施。远隔缺血处理(remote ischemic conditioning,RIC)通过使器官短暂非损伤性的适度缺血刺激,达到缺血-再灌注进而激活机体内部的保护机制,使远隔脏器可以耐受较长时间的缺血性损伤,减轻脑组织损伤[2],但能否减轻脑I-RI所致的认知障碍仍结果未知。本研究通过建立血管认知功能障碍动物模型,研究RIC是否在脑组织缺血再灌注VCI中发挥神经保护作用。
1 实验材料与方法
1.1 实验动物 清洁级健康雄性SD大鼠,体重220~260 g。所有实验大鼠均为在入组前进行Morris水迷宫实验并测定为反应正常的大鼠。本实验经通辽市医院动物伦理委员会批准进行。
1.2 实验方法 应用双侧颈总动脉闭塞(bilateral common carotid arteries occlusion,BCCAO)方法制备脑缺血再灌注致VCI模型。将SD大鼠分为假手术组、对照组(VCI组)及RIC组(VCI+RIC组),每组8只SD大鼠,对照组为VCI成功建模的大鼠,RIC组为对VCI模型实施RIC的大鼠。三组分别进行Morris水迷宫行为学测定以评估认知功能,并在实验结束后每组随机选取5只取脑组织进行HE染色,电镜下观察各组大鼠脑白质及海马病理改变及神经元凋亡情况。
1.2.1 实验模型的建立 采用BCCAO方法制备SD大鼠VCI模型[3],具体方法:各组大鼠经肛门注入10%水合氯醛(300 mg/kg)麻醉。麻醉后大鼠仰卧位并固定,消毒后行颈部纵向正中切口,依次分离皮下各组织,充分暴露双侧颈动脉鞘。采用4-0号手术缝合线做线扣阻断双侧颈总动脉血流先进行缺血20 min,然后恢复再灌注10 min;如此重复3次。在第一次结扎双侧颈总动脉20 min内,在大鼠尾尖约1 cm处断尾,放血约0.3 mL。3次脑缺血-再灌注结束后观察大鼠30 min,状态平稳后逐层缝合手术切口。假手术组大鼠手术步骤同上,不进行双侧颈总动脉结扎及断尾放血。
1.2.2 远隔缺血处理 术后24 h,对RIC组大鼠行双侧后肢同时RIC处理。弹力绳线加压捆绑鼠双后肢根部,阻断血流,以皮肤发紫、远端肢体皮温下降、脉搏消失为缺血标志,持续5 min;松开线绳,以皮肤潮红、远端温度回升、脉搏再现为再灌注标志,持续5 min,4次/日,连续干预21 d[4]。
1.2.3 Morris水迷宫的行为学评定 三组大鼠均于RCI结束后立即进行认知功能评估。Morris水迷宫实验观察各组大鼠空间学习记忆能力,包括逃避潜伏期、穿越平台次数和目标象限停留时间。本实验由设计圆形水池、图像自动采集处理系统、水下平台组成。记录大鼠运动曲线轨迹及分析处理信息,通过记录观察大鼠在目标象限中停留的相关轨迹曲线图判断其探索运动的规律性。水池直径110 cm,高40 cm,水温(22±2)℃。水下圆形站台直径10 cm,高22 cm,距池壁28 cm。将水池人为划分为4个象限,目标象限为第3象限,记录大鼠找到平台的时间,将120 s内未找到平台的大鼠引导至平台停留10 s。定位航行试验连续进行5 d,第6天在水迷宫中没有平台的情况下进行空间探索试验。
(1)定位航行试验:历时5 d,观察大鼠120 s时限在迷宫内寻找到平台的时间。大鼠面壁从第3象限置入池内开始计时,到登上站台终止记录。记录各组大鼠第1天、第3天、第5天上台所需的逃避潜伏期,计算平均时间。
(2)空间探索试验:检测大鼠学会寻找平台后对平台空间位置的记忆能力,包括目标象限停留时间、穿越原平台位置次数。在第6天移除水下平台,第3象限大鼠面壁入池,记录120 s内的运动曲线轨迹、目标象限停留时间以及穿越平台的次数。
1.2.4 HE染色 Morris水迷宫实验完成后切取大鼠脑部白质和海马组织用于检测,经包埋切片、脱蜡、染色等步骤,显微镜下观察,200×镜下拍照。每个部位选择5张切片,对每张玻片视野内的海马CA1和CA3区,计数神经元数量,取平均值。
1.3 统计学方法 应用SPSS 25.0统计软件进行数据的分析处理,计量资料进行正态性检验,所有数据符合正态分布,以表示,多组间比较采用单因素方差分析及重复测量方差分析,组间两两比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 一般情况 假手术组大鼠术后反应及活动基本正常,在术后24 h开始进食水。对照组大鼠术后精神状态较差,反应相对迟钝,进食进水较少,5 d后开始逐渐好转。RIC组大鼠术后2 d后状态开始好转,介于假手术组和对照组之间。至术后4周,对照组大鼠死亡2只;RIC组大鼠死亡1只;假手术组无死亡。
2.2 Morris水迷宫实验结果 第1天、第3天、第5天对照组及RIC组大鼠逃避潜伏期较假手术组均有延长,差异均具有统计学意义。除假手术组外,其他两组大鼠逃避潜伏期时间随着训练次数增加逐渐缩短。第1天、第3天两组间差异无统计学意义,第5天RIC组成绩好于对照组,两组间差异具有统计学意义。第6天空间探索实验中,目标象限停留时间假手术组与RIC组相近(47.2±10.2 s vs 41.2±9.7 s,P>0.05),均优于对照组(33.5±11.3 s),差异均具有统计学意义;穿越平台次数假手术组与RIC组相近(5.3±1.6 vs 4.7±1.2,P>0.05),均多于对照组(2.8±1.3),差异均具有统计学意义(表1)。
在空间探索实验中,与假手术组相比,对照组大鼠的运动曲线轨迹缺乏目的性而呈现出杂乱无章的平台搜索轨迹,RIC组较对照组具有明确的目的性呈现出较规则曲线(图1)。
2.3 HE染色结果 假手术组大鼠脑皮层组织神经细胞无明显病理改变。对照组可见皮层中锥体细胞出现明显的形态学改变,细胞皱缩,细胞核固缩、深染,细胞间质疏松,神经纤维稀疏。RIC组较对照组相比,皮层细胞间质疏松,神经纤维变细,破碎细胞较少,细胞略皱缩。假手术组大鼠海马区神经元排列均匀紧密,核仁着色清晰,无明显病理改变(图2)。在对照组中,可见部分海马区神经细胞有明显的空泡样变性,着色较浅,细胞体积皱缩。而RIC组较对照组,海马区神经细胞可见少量空泡样变性,细胞体积轻度皱缩(图3)。
定量计数各组大鼠海马CA1区和CA3区锥体神经元存活数目,与假手术组(CA1:93.53±5.01;CA3:104.63±8.26)相比,对照组CA1区和CA3区存活的锥体神经元数目(CA1:51.03±4.95;CA3:78.53±5.31)明显减少(均P<0.05);而与对照组相比,RIC组大鼠CA1区和CA3区锥体神经元存活数目(CA1:80.57±7.30;CA3:92.43±8.16)明显增加(均P<0.05)。
3 讨论
脑I-RI是脑组织缺血区再灌注导致的二次损伤,其机制复杂涉及能量代谢障碍、氧化应激反应、炎性反应、兴奋毒性氨基酸、细胞凋亡等[3]不同机制,多种机制共同参了神经元超微结构的损伤,特别是涉及线粒体结构[5],最终导致神经元凋亡而出现VCI。目前治疗VCI尚缺乏有效的方法,在防治领域探索新机制新方法是本研究的目的所在。
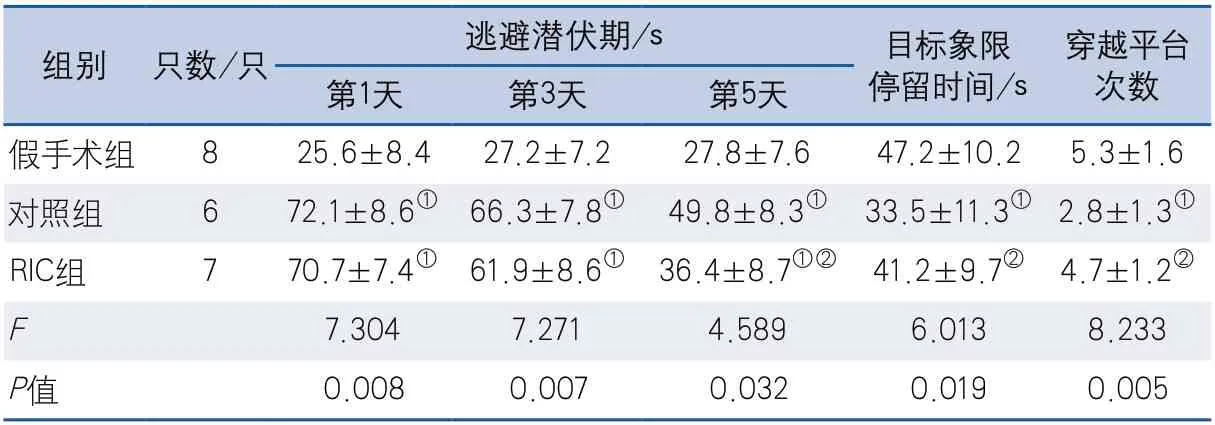
表1 三组大鼠行为学评定

图1 各组空间探索实验时的游泳轨迹
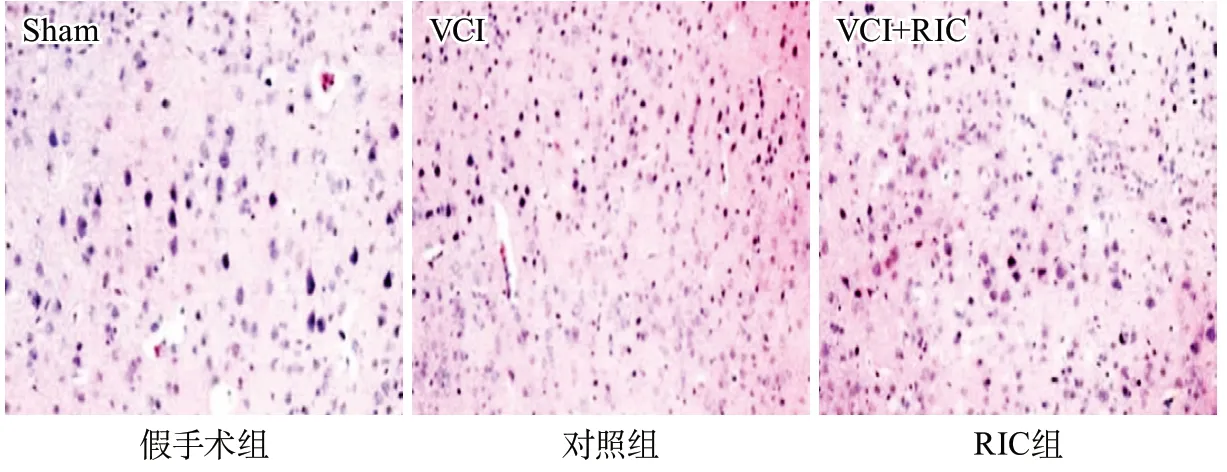
图2 各组大鼠脑皮层病理变化(HE染色,×200)

图3 各组大鼠海马区病理变化(HE染色,×200)
建立一个稳定的VCI动物模型至关重要,目前最常用于复制VCI患者神经病理和行为学改变的是BCCAO模型。夹闭双侧颈总动脉会引起脑血流量的急剧下降,造成急性脑缺血。鉴于大鼠脑部侧支循环较丰富,通过剪尾放血降低血压可以增加模型的稳定性。BCCAO法建立的动物模型死亡率低,术后会出现明显的学习和记忆功能减退等临床表现,组织病理学研究显示脑I-RI可以引起海马神经元数量的减少。这些与人类VCI的临床表现和病理特点相似,因此BCCAO模型可以作为研究VCI发病机制及相应治疗的可靠模型。术后大鼠表现出显著的认知功能障碍,已经被证实可以作为研究VCI治疗较为理想的动物模型[6-7]。Morris水迷宫实验常用于测试啮齿类动物空间学习和记忆功能情况的装置之一。反复训练动物学习利用附近的位标寻找到水下隐匿的平台,并测试寻找原来的平台位置时穿越平台的次数以及在平台所在象限的时长来判断其记忆力[8-10]。本研究发现,BCCAO术后的对照组大鼠其逃避潜伏期延长,并出现穿越平台区域次数明显减少及目标象限停留时间明显缩短的情况,提示脑I-RI可以引起大鼠的记忆力减退,建立了可靠的VCI模型。
RIC对缺血再灌注后远隔器官的保护机制尚不明确,而且不同形式的缺血处理使脑组织对严重缺血发生保护性耐受。目前认为RIC的神经保护机制是多维度的。首先,RIC后可激活细胞因子、改变基因表达等多个环节产生神经保护作用;另外,RIC可以减轻血脑屏障的破坏,减轻脑I-RI。国内外学者证实,RIC的神经保护机制在发病3 h内为第一阶段(即时相),此阶段内源性物质释放去甲肾上腺素、缓激肽、腺苷等发挥神经保护作用;第二阶段(延迟相),释放后的内源性物质通过调控基因蛋白表达或介导细胞内新蛋白合成实现神经保护作用,此阶段可持续48~96 h,甚至数周[11-12]。
本研究结果提示RIC可以明显改善VCI大鼠的认知功能障碍。在Morris水迷宫实验结果中,RIC后脑I-RI大鼠的逃避潜伏期缩短,穿越平台区域次数增加,在目标象限停留时间延长;组织病理学上RIC减轻了VCI大鼠海马部位CA1区和CA3区结构损伤和海马神经元丢失减少。以上结果说明RIC可以改善VCI模型大鼠的学习及记忆能力,可以减轻脑I-RI引起的海马神经元损伤,这提示了RIC具有神经保护作用。
脑组织特别是海马组织对血流量的依赖性强,对缺血缺氧性损伤较为敏感。研究发现脑I-RI会损伤神经元,以海马CA1区神经元损伤最为显著,因此可导致学习和记忆功能障碍[13-15]。脑I-RI导致海马部位发生的病理学损伤,在第2周、第4周以及第6周其神经元的排列和数目发生明显改变,以脑I-RI后第4周的神经元损伤最为严重[6]。在本研究中,SD大鼠I-RI后海马组织发生了类似的改变,与以往的研究结果一致。
Dave等[2]在2006年首次报道了远隔缺血预处理可减轻脑组织损伤,发挥神经保护作用,发现大鼠心脏骤停前48 h,对大鼠实施双下肢缺血预处理,组织学结果提示处理后脑部损失的神经元数显著减少。另一研究显示,RIC可以减少线粒体内细胞凋亡关键物质向细胞质的释放,阻断了细胞凋亡从而减轻脑细胞损伤[16]。研究还发现,RIC治疗脑缺血-再灌注大鼠后,醌氧化还原酶-1、组织核因子E2相关因子2、血红素加氧酶-1表达上调,脑组织水肿和梗死体积减小,SOD活性增强。这些结果显示RIC通过激活组织核因子E2相关因子2-抗氧化反应元件通路以及通过减少氧化应激减轻脑缺血再灌注损伤[17]。缺血处理可以使蛋白激酶B大量活化,蛋白激酶B通路被激活发挥神经元保护作用。再灌注后海马CA1区检测到磷酸化蛋白激酶B及磷酸化一氧化氮的表达,推测为RIC通过磷酸肌醇3激酶/蛋白激酶B通路上调了一氧化氮水平,减轻了神经元损伤[18]。
本研究显示RIC可以改善VCI动物模型的学习记忆功能,减轻神经细胞的变性坏死,减轻脑白质脱髓鞘。但目前RIC对VCI的临床疗效及其具体机制尚不十分明确。在本实验中显示出RIC后脑I-RI大鼠海马CA1区和CA3区神经元损伤减轻,存活的锥体神经元数目明显增多,这表明RIC可以减轻VCI大鼠海马部位的神经元损伤。
综上所述,RIC可以明显改善脑I-RI后VCI大鼠的认知功能障碍,可以减轻相应脑区或海马部位的神经元损伤。提示RIC具神经保护作用,有望成为VCI有效的治疗方法。本实验不足之处为样本量较少,其结果可能存在一定程度的偏倚。另外,本研究只观察了RIC改善VCI大鼠模型的认知功能障碍及脑组织病理变化,未对具体机制进行研究。下一步应从加大样本量及具体机制方面开展更加深入的研究工作。
《中国卒中杂志》订阅费用上调通知
感谢广大读者朋友一直以来对我刊的关注和支持!
我刊自2006年创刊以来,本着质量第一、读者至上的精神,坚持为广大读者提供高质量的产品和服务。在众多学术界专家、作者及读者的支持下,我刊也得以迅速发展。
为保证期刊产品质量,坚持使用铜版纸四色印刷。随着近年来物价飞涨,我刊的办刊成本大幅上涨。为保证印刷质量,缓解办刊的经济压力,保证刊物的正常运转,同时也为了更好地服务广大读者,我刊从2020年第1期起调整杂志的零售价。每期售价由20元调整为36元,全年订价由240元调整为432元。
我们将一如既往以高质量的产品和优质服务全力回报读者的厚爱和支持!
《中国卒中杂志》编辑部
【点睛】远隔缺血处理可改善脑缺血再灌注损伤所致血管性认知障碍动物模型的认知障碍,发挥神经保护作用。

