腹腔镜与开腹肝切除术治疗结直肠癌肝转移效果和安全性比较的Meta分析
高本见, 罗 佳, 刘 莹, 杨小李, 苏 松, 李 波
西南医科大学附属医院 a.肝胆外科; b.肿瘤科, 四川 泸州 646000
结直肠癌是常见的恶性疾病,据全球癌症统计数据,其发病率和死亡率分别居于恶性肿瘤的第4位和第2位[1]。肝脏是结直肠癌远处转移最常见的靶器官,15%~25%的结直肠癌患者发生同时性肝转移,约20%的患者发生异时性肝转移[2-3]。肝转移也是结直肠癌患者最主要的死亡原因。目前手术切除肝转移灶是治疗结直肠癌肝转移(colorectal liver metastases,CRLM)的最佳方法,肝转移灶可完全切除患者的5年存活率可达30%~50%[4]。开腹肝切除术(open liver resection,OLR)是治疗CRLM的传统手术方式,其临床疗效得到了广泛认可。随着微创外科的发展,腹腔镜肝切除术(laparoscopic liver resection,LLR)已经成为一种安全、有效的治疗肝脏肿瘤的常规手术方式[5]。相对于OLR,LLR具有创伤小、疼痛轻、出血少及术后全身反应轻等优势[6-7]。而关于LLR治疗CRLM的研究大多为回顾性、单中心报道,其安全性和有效性仍存在争议。因此,本研究通过Meta分析对LLR与OLR治疗CRLM的近期、远期疗效及安全性进行比较,旨在为临床实践提供参考。
1 资料与方法
1.1 检索策略 检索的英文数据库包括PubMed、Cochrane library、Embase,中文数据库包括知网、万方、维普,检索时间为数据库建立至2019年6月,中文检索词:结直肠癌肝转移、腹腔镜肝切除术、开腹肝切除术;英文检索词:colorectal cancer,colorectal liver metastases,laparoscopic hepatectomy,laparoscopic liver resection,open hepatectomy,open liver resection。根据检索所得到文献的参考文献进行再检索,以提高符合条件的文献检出率。
1.2 纳入与排除标准 纳入标准:(1)研究对象为因CRLM接受肝切除术的患者;(2)文献报道了LLR(观察组)和OLR(对照组)在治疗CRLM疗效方面的比较,且观察指标至少包括1项分析指标;(3)关于两种手术要有足够的数据,每组病例数不低于10例;(4)如果研究是基于重叠的患者,则纳入最新的或完整的研究,语种包括中文和英文。排除标准:(1)原发性肝癌或除CRLM外的其他转移性肝癌;(2)合并可能影响研究结果的其他疾病;(3)文献报道的数据只是LLR或者OLR之一,没有比较两组临床疗效的数据可供提取;(4)综述、评论、病例报告等非对照性研究的文献。
1.3 数据提取与文献质量评估 2位研究人员独立提取纳入研究的数据并比较结果,如有分歧则通过讨论或征求第3位研究人员协助解决。采用标准化数据采集方法,仔细提取数据。提取文献的内容如下:(1)文献的基本特征。第一作者、发表年份、国家、研究类型、病例数、平均年龄、男女比例、肿瘤大小;(2)分析指标。手术时间、术中出血量、输血率、术后并发症、围手术期病死率、术后住院时间、R0切除率、总体生存率以及无瘤生存率。采用Jadad量表评估随机对照试验(randomized controlled trial,RCT)研究的质量,包括随机化(0~2分)、致盲(0~2分)和提取(0~1分)。高质量研究被定义为1项研究的质量分数≥3分。使用纽卡斯尔-渥太华量表(the Newcastle-Ottawa scale,NOS)评估回顾性队列研究(retrospective cohort study,RCS),分别从患者选择、研究组的可比性及结果评估3个方面进行文献质量评分,总分9分,评分≥5分时认为是高质量研究[8]。
1.4 统计学方法 采用Revman5.3软件进行统计分析。研究中的连续性变量及二分类变量分别采用均数差(MD)及比值比(OR)为效应分析统计量,各统计量均计算95%可信区间(95%CI),P<0.05为差异有统计学意义。纳入研究结果间的异质性采用χ2检验进行分析,同时结合I2定量判断异质性大小:P≥0.10,I2≤50%为各研究间无明显异质性,采用固定效应模型进行分析;若P<0.10,I2>50%,认为各研究间有明显异质性,首先分析异质性来源,如无明显临床异质性,则采用随机效应模型分析。采用漏斗图分析其发表偏倚。
2 结果
2.1 文献筛选过程及纳入文献的基本特征 共检索出英文文献422篇,中文文献36篇,最终纳入23篇文献[9-31],其中1篇为RCT,22篇为RCS,共4204例患者(LLR组1558例,OLR组2646例)。文献筛选流程见图1,纳入文献的基本特征见表1。
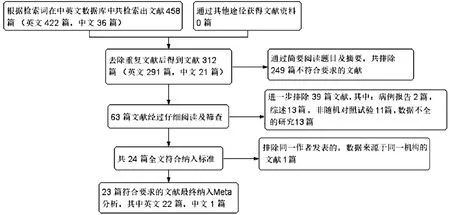
图1文献筛选流程图

表1 纳入文献的基本特征及质量评价
注:“-”表示未报道。
2.2 Meta分析结果
2.2.1 手术时间 纳入文献中有20篇[9-15,17-22,25-31]报道了手术时间,包括3649例患者,各研究间存在异质性(P<0.001,I2=86%),采用随机效应模型进行分析。Meta分析结果显示,LLR组与OLR组手术时间差异无统计学意义(MD=4.42,95%CI:-9.05~17.88,P=0.52)(图2)。

图2 2组手术时间的Meta分析
2.2.2 术中出血量 纳入文献中有21篇[9,11-22,24-31]报道了术中出血量,包括3778例患者,各研究间存在异质性(P<0.001,I2=90%),采用随机效应模型进行分析。Meta分析结果显示,LLR组术中出血量少于OLR组,差异有统计学意义(MD=-145.48,95%CI:-190.96~-100.00,P<0.001)(图3)。

图3 2组术中出血量的Meta分析
2.2.3 输血率 纳入文献中有13篇[10-14,16,22,24,26,28-31]报道了输血率,包括1402例患者,各研究间不存在异质性(P=0.55,I2=0),采用固定效应模型进行分析。Meta分析结果显示,LLR组输血率低于OLR组,差异有统计学意义(OR=0.41,95%CI:0.29~0.60,P<0.001)(图4)。

图4 2组输血率的Meta分析
2.2.4 术后并发症 纳入文献中有23篇[9-31]报道了术后并发症,包括4204例患者,各研究间不存在异质性(P=0.11,I2=28%),采用固定效应模型进行分析。Meta分析结果显示,LLR组术后并发症发生率低于OLR组,差异有统计学意义(OR=0.55,95%CI:0.47~0.65,P<0.001)(图5)。
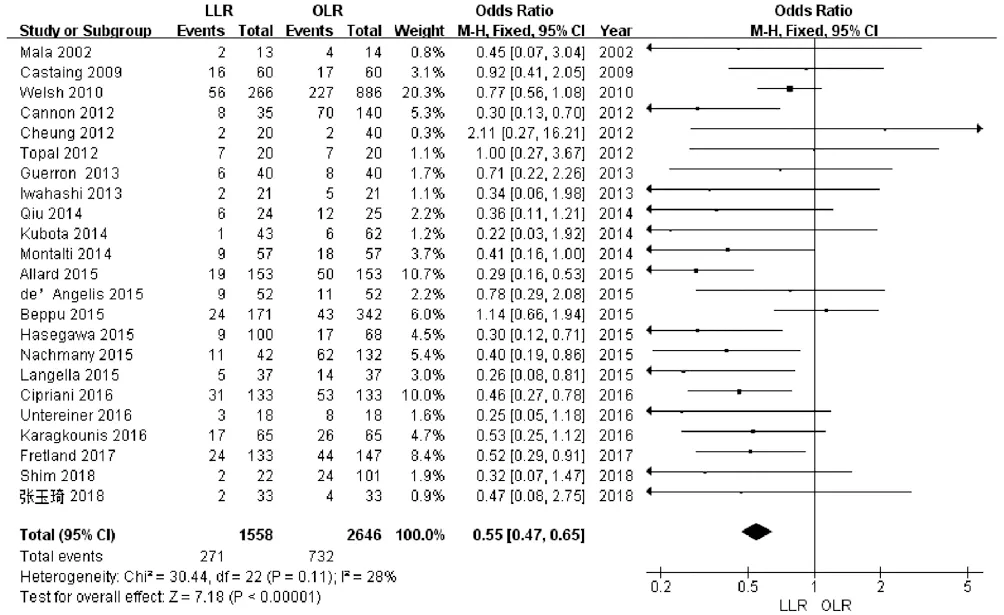
图5 2组术后并发症的Meta分析
2.2.5 围手术期病死率 纳入文献中有16篇[9-10,12,15-18,20,22,24-28,30-31]报道了围手术期病死率,包括3217例患者,各研究间不存在异质性(P=0.99,I2=0),采用固定效应模型进行分析。Meta分析结果显示,LLR组与OLR组围手术期病死率差异无统计学意义(OR=0.67,95%CI:0.29~1.58,P=0.37)(图6)。

图6 2组围手术期病死率的Meta分析
2.2.6 术后住院时间 纳入文献中有20篇[9-15,17-18,20-28,30-31]报道了术后住院时间,包括3707例患者,各研究间存在异质性(P<0.001,I2=69%),采用随机效应模型进行分析。Meta分析结果显示,LLR组术后住院时间短于OLR组,差异有统计学意义(MD=-2.69,95%CI:-3.29~-2.10,P<0.001)(图7)。

图7 2组术后住院时间的Meta分析
2.2.7 R0切除率 纳入文献中有10篇[9-10,12,16,20-21,25-28]报道了R0切除率,包括2784例患者,各研究间存在异质性(P=0.01,I2=58%),采用随机效应模型分析。Meta分析结果显示,LLR组与OLR组R0切除率差异无统计学意义(OR=1.36,95%CI:0.84~2.21,P=0.21)(图8)。

图8 2组R0切除率的Meta分析
2.2.8 总体生存率 纳入文献中有8篇[9-10,16,19,21-22,26-27]比较了1年总体生存率,10篇[9-10,12,16-17,19,21,23,27-28]比较了5年总体生存率。1、5年总体生存率各研究间不存在异质性(P值分别为0.96、0.75,I2值均为0),采用固定效应模型进行分析。Meta分析结果显示,LLR组与OLR组1年总体生存率(OR=1.24,95%CI:0.76~2.02,P=0.40)和5年总体生存率(OR=1.14,95%CI:0.94~1.39,P=0.18)差异均无统计学意义(图9)。
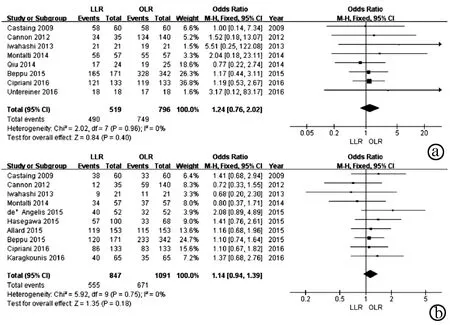
注:a,1年总体生存率;b,5年总体生存率。
2.2.9 无瘤生存率 纳入文献中有8篇[9-10,16,19,21-22,26-27]比较了1年无瘤生存率,9篇[9-10,12,16-17,19,21,23,27]比较了5年无瘤生存率。1、5年无瘤生存率各研究间不存在异质性(P值分别为1.00、0.13,I2值分别为0、37%),采用固定效应模型进行分析。Meta分析结果显示,LLR组与OLR组1年无瘤生存率(OR=0.87,95%CI:0.67~1.12,P=0.27)和5年无瘤生存率(OR=0.90,95%CI:0.74~1.11,P=0.33)差异均无统计学意义(图10)。
2.3 敏感度分析及发表偏倚 对有高度异质性的结局指标(手术时间、术中出血量、术后住院时间、R0切除率)进行敏感度分析,采用逐一排除文献的方法,剔除权重最轻、最重或者标准差变化较大的研究,以检验相关结果的稳定性。在排除过程中每组异质性变化不明显,没有检测到导致异质性的来源,并且该方法不会改变最初总体分析的结果。根据手术时间、术后并发症2组数据绘制漏斗图观察发表偏倚,图像两侧基本对称,表明该分析无明显发表偏倚(图11)。

注:a,1年无瘤生存率;b,5年无瘤生存率。

注:a,手术时间;b,术后并发症。
3 讨论
肝转移是影响结直肠癌患者预后的重要因素,也是治疗上的难点问题。尽管在系统治疗方面取得了显著的进展,但手术切除肝转移灶仍是目前唯一能达到治愈的治疗手段[32-34]。自1991年Reich等报道了首例LLR以来,微创技术在肝脏肿瘤的手术治疗中得到了越来越多的应用,其安全性和微创性也得到了充分肯定[6,35]。与原发性肝癌不同,CRLM患者常伴有综合治疗及腹部手术史,这对LLR术中分离黏连、肝实质离断和断面止血等提出了挑战[36]。目前,临床上对于CRLM的最佳手术方式仍有争议。因此,本研究通过系统评价的方法客观地比较LLR与OLR在治疗CRLM中的有效性及安全性。
本Meta分析显示,与OLR比较,LLR在治疗CRLM中有较好的应用效果及安全性,主要表现在以下几个方面:(1)减少术中出血量,原因可能在于腹腔镜的高清晰度及视野放大作用有助于术中精细操作,增加的腹内压一定程度上减少创面渗血以及腹腔镜戳孔替代腹部切口减少了腹壁血管损伤出血[29,37]。(2)降低输血率,由于术中出血量的减少,及术中精细操作可能降低术后腹腔出血的概率,从而降低了输血率。有研究[38]表明,术中大量失血(≥700 ml)、输血是影响肝癌患者总体生存的独立预后因素,而是否也会降低结直肠癌患者的长期存活率目前仍存在争论。(3)LLR组术后并发症较少,这可能与开腹手术切口较大、术野暴露时间长,易导致电解质紊乱及延缓胃肠功能恢复,术后疼痛明显不利于早期活动、排痰,导致下肢深静脉血栓形成、肺不张等有关[7]。此外,LLR术后炎症反应较开腹手术轻,这与良好的免疫功能状态相关,从而可能降低术后并发症的风险[39]。(4)缩短术后住院时间,这可能与LLR术后胃肠道功能恢复较快,疼痛较轻以及并发症少等因素有关,使患者在术后得到快速康复,因此术后住院时间更短。而两组在手术时间、围手术期病死率、R0切除率及1、5年总体生存率和无瘤生存率等方面并无明显差异。
本研究结果与之前Meta分析的结果[39-40]基本一致。沈艺南等[41]通过分析指出,LLR治疗CRLM的安全性及效果与开腹手术一致,并在术中出血量、术后并发症及住院时间等方面具有优势。该分析只纳入10项RCS,样本量相对较小,可能会影响结果的可靠性。本研究共纳入23篇高质量文献,对比了两种手术方式治疗CRLM的近期、远期疗效及安全性。其中包括1项RCT[29],共280例患者,其研究结果同样表明LLR可减少术后并发症、缩短术后住院时间,但在术中出血量及输血率方面,两种手术方式无明显差异。这可能与肝切除术的复杂性有关,因为每次手术结果与患者自身的情况密切相关,如肿瘤位置、切除范围、凝血功能及营养状况等,并且试验中对患者的分组及治疗过程难以实施完全随机和双盲[42]。因此,该研究结果仍需要多中心、大样本的RCT进一步验证。
本研究还存在一定局限性。第一,只检索了公开发表的中、英文文献,可能导致一些以非中英文发表的文献未被纳入。第二,从分析结果中可以发现手术时间、术中出血量、术后住院时间及R0切除率异质性较高,故使用了随机效应模型,这也可能削弱结果的证据。经过逐一排除文献法进行敏感度分析后并没有发现高异质性的原因,这可能与不同的研究人群、手术团队的技术经验以及腹腔镜手术的学习曲线等因素有关。
综上所述,LLR治疗CRLM是安全、可行的。相对于OLR,LLR可明显改善术中出血量、输血率、术后并发症及术后住院时间,并且不影响肿瘤的根治性效果及远期预后。

