奉新猕猴桃黑斑病病原菌鉴定及室内药剂筛选
周 英,李庚花,胡叶开,强 遥,张凯东,赵尚高,李帮明,蒋军喜*
(1.江西农业大学 农学院,江西 南昌 330045;2.江西省浮梁县瑶里农技站,江西 浮梁 333411;3.江西省奉新县农业局,江西 奉新 330700)
【研究意义】‘金艳’是1984年中国科学院武汉植物园以毛花猕猴桃为母本,以中华猕猴桃作父本杂交育成的黄肉猕猴桃品种[1-2],该品种丰产性好、外形美观、果肉金黄、细嫩香甜、Vc含量高、耐贮藏,是深受猕猴桃种植者和消费者青睐的高端优良品种之一[3-6]。近年来,为顺应市场需求,江西省奉新县大力发展‘金艳’猕猴桃种植,但随着种植面积的不断扩大,在该品种上出现一种新的果实病害(本文命名为猕猴桃黑斑病),并呈逐年加重之势。明确该病害的病原并筛选出有效药剂,对及时控制该病害的发生具有重要意义。【前人研究进展】该病害目前在奉新只为害猕猴桃果实,尚未发现其为害叶片和枝条,幼果期开始发病,膨大期盛发,成熟期发病较轻。罹病果实不但带有病疤和发生腐烂,而且极易脱落。该病害在症状特点上明显不同于奉新已发生的猕猴桃灰霉病、果腐病等病害[7-8],而与韩国报道的猕猴桃黑腐病和我国陕西省报道的猕猴桃褐斑病有较大的类似之处[9-10]。2011年,Kwon等[7]对韩国猕猴桃黑腐病的病原进行了形态学和分子生物学鉴定,明确其病原菌为链格孢(Alternaria alternata);2013年,赵金梅等[8]对陕西省周至县猕猴桃褐斑病菌也进行了形态学和分子生物学鉴定,其病原菌也被确定为链格孢(A.alternata),同时,还筛选到氟硅唑、异菌脲、多抗霉素和苯醚甲环唑4种有效药剂。【本研究切入点】本文从奉新县具有代表性果园采集大量样品,通过组织分离获得多个菌株,随后对获得的菌株进行培养性状和形态学观察,并通过基因扩增和序列测定对菌株作进一步的分子鉴定,在此基础上进行药剂筛选试验。【拟解决的关键问题】黑斑病目前在江西省奉新县猕猴桃品种‘金艳’上普遍发生,在有些果园中造成了大量的烂果和落果现象,已对奉新县金艳猕猴桃生产构成了严重的威胁。鉴于该病害是猕猴桃生产中的一种新的突发病害,且具有迅速扩散蔓延之势,本研究拟解决的关键问题是明确其病原菌种类和筛选出有效药剂,为尽快控制该病害的发生提供理论依据和有效手段。
1 材料与方法
1.1 材料与试剂
供试病果:2017年5—7月分批从江西奉新县新泽农场、余会昌农场、天成农场和松毛山基地采集猕猴桃病果,品种为‘金艳’,共采集病果40个,病果采回后立即在室内进行病菌分离。
供试药剂:共22种杀菌剂,分别为75%戊唑·嘧菌酯水分散粒剂,美国世科姆(中国)公司生产;75%肟菌·戊唑醇水分散粒剂,70%丙森锌可湿性粉剂,均由拜耳(中国)有限公司生产;50%咪鲜胺锰盐可湿性粉剂,50%异菌脲悬浮剂,均由富美实(中国)植物保护剂有限公司生产;25%吡唑醚菌酯乳油,50%啶酰菌胺水分散粒剂,70%代森联水分散粒剂,均由巴斯夫(中国)有限公司生产;2%春雷霉素水剂,日本北兴化学工业株式会社生产;40.4%精甲·百菌清悬浮剂,10%苯醚甲环唑水分散粒剂,50%嘧菌环胺水分散粒剂,25%丙环唑乳油,均由先正达(中国)有限公司生产;400 g/L氟硅䂳乳油,广东茂名绿银农化有限公司;24%腈苯唑悬浮剂,美国陶氏益农(中国)有限公司生产;68.75%噁酮·锰锌水分散粒剂,美国杜邦(中国)有限公司生产;10%申嗪霉素悬浮剂,上海农乐生物制品有限公司生产;25%己唑醇悬浮剂,山东奥胜生物科技有限公司生产;12%中生菌素可湿性粉剂,福建凯立生物制品有限公司生产;10%多抗霉素可湿性粉剂,日本科研制药株式会社生产;80%已蒜素乳油,开封大地农化生物科技有限公司生产;75%百菌清可湿性粉剂,利民化工股份有限公司生产。
1.2 病原菌的分离培养
采用组织分离法[11]进行病菌分离,在超净工作台上,用体积分数75%的酒精对猕猴桃病果进行表面擦拭并在酒精灯上来回火焰消毒,用无菌刀片削去病斑果皮,将病健交界处的果肉组织移入含有乳酸的PDA平板上,置于25℃恒温培养箱中培养,待组织块周围长出菌落后挑取菌落边缘的菌丝体转接PDA试管斜面培养基获得纯培养,在纯培养试管中加入甘油于4℃冰箱中保存备用。
1.3 病原菌形态鉴定方法
将病原菌接到PDA和PCA培养基上,逐日观察记载菌落的形态和颜色变化,测量菌落直径,计算菌落生长速率。待菌落产孢后镜检分生孢子形态,随机取100个孢子测量其大小。从PCA培养基上的菌落边缘取小块带菌丝培养基,将菌丝涂抹于中间凿有边长约为15 mm的方孔的无菌滤纸片上,并将滤纸片置于无菌载玻片上,于25℃、12 h光照/12 h黑暗交替的培养箱中保湿培养5~7 d,在光学显微镜下观察方孔内缘的分生孢子链。根据实验结果,查阅相关文献[12-15],对病原菌种类归属进行形态鉴定。
1.4 致病性测定
参照李庚花等[14]描述的方法,对分离到的病菌进行回接,具体步骤如下:选取无病斑、无虫伤的健康‘金艳’猕猴桃果实,用体积分数70%的酒精对要接种部位进行表面消毒,待酒精挥发后用无菌刀片削一个直径为5 mm大小的伤口面,用直径为5 mm的无菌打孔器在菌落边缘打取菌饼,将菌饼的菌丝面紧贴伤口进行接种,设无菌的PDA培养基块做对照,在接种处用湿棉球进行保湿,每个处理3个重复,置25℃恒温培养箱中培养,逐日观察接种果发病情况,待发病后对病斑再次进行病菌分离。
1.5 病原菌的分子鉴定
采用Ezup柱式真菌基因组DNA抽提试剂盒提取菌株的基因组DNA,用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)/ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[16-17]扩增 rDNA-ITS 序列,用引物EF-1F(5′-CATCGAGAAGTTCGAGAAGG-3′)/EF-1R(5′-TACTTGAAGGAACCCTTACC-3′)[18]扩增 EF-1α基因。扩增反应体系:2×TaqPCR MasterMix 12.5 μL、正反向引物各1 μL、ddH2O 8.5 μL、DNA模板2 μL至总体系25 μL。rDNA-ITS基因PCR反应程序:94℃预变性3 min;94℃变性30 s,60℃退火30 s,72℃延伸1 min,共35个循环,最后一次循环后,72℃补平10 min。EF-1α基因PCR反应程序:95℃预变性 3 min;94℃变性 1 min,60℃退火25 s,72℃ 延伸1 min,循环5次;94℃变性1 min,58℃退火25 s,72℃延伸1 min,循环5次;94℃变性1 min,56℃退火25 s,72℃延伸1 min,循环25次;最后一次循环后,72℃补平10 min。扩增产物经10 g/L琼脂糖凝胶电泳检测后,委托生工生物工程(上海)有限公司进行测序,将测得的序列在GenBank中进行BLAST搜索,与数据库中已知序列进行同源性比对,按比对结果结合病菌的形态学特征来对病原菌进行鉴定。
1.6 药剂室内毒力测定
采用菌丝生长速率法[19-20]测定22种杀菌剂对猕猴桃黑斑病病菌的抑菌作用,方法如下:在超净工作台上,将药剂按有效成分用无菌水稀释成1.0×104,2.5×103,6.3×102,1.6×102,3.9×101,1.0×101,2.4×100,6.1×10-1,1.5×10-1μg/mL共9个质量浓度梯度的药液,取1 mL药液加入盛有9 mL(约50℃)PDA试管中,混匀后倒入培养皿中制备含药梯度平板,设空白PDA平板为对照。用直径为5 mL的无菌打孔器在培养7 d的菌落边缘打取菌饼,用无菌接种针挑取一个菌饼接至含药PDA平板中央,每个处理3个重复,接种后置于25℃恒温培养箱中培养,7 d后用十字交叉法[21]测量菌落直径并计算抑菌率,用DPS分析软件进行数据分析,求出毒力回归方程、EC50值和相关系数,并根据EC50值的大小来评价不同杀菌剂的抑菌效果。
抑菌率=(对照组净菌落直径-处理组净菌落直径)/对照组净菌落直径×100%
2 结果与分析
2.1 病害症状
2017年,江西省奉新县多个果园的‘金艳’猕猴桃发生一种新的果实病害。该病主要发生于5—7月猕猴桃果实生长发育前期,果面出现褐色圆形或不规则形凹陷病斑,随着病斑的扩大,病斑颜色逐渐加深变黑,病斑凹陷程度更加显著,病斑上有大量的黑色霉层(图1a),后期,病斑凹陷处开裂并木栓化、空心、内部布满菌丝(如图1b,1c),病果随之脱落。

图1 ‘金艳’猕猴桃黑斑病症状Fig.1 Symptoms of black spot disease on‘Jinyan’kiwifruit
2.2 病菌培养及形态特征
对4个果园采集的40个病果进行病菌分离纯化,共获得35个真菌分离物,这些分离物在PDA平板上的培养性状基本一致。选取其中代表性分离物HB-1,对其进行培养性状和形态特征观察,25℃培养条件下,该菌在PDA平板上菌落圆形,初为白色,后转为灰黑色,基内菌丝和气生菌丝均较发达、绒毛状,培养5 d后菌落变成墨绿色,边缘一圈为白色(图2a,图2b);菌落平均生长速率为10 mm/d;显微镜下,分生孢子卵形,倒棍棒形,倒梨形或椭圆形,褐色或淡褐色,表面光滑,具2~5个横隔膜和1~3个纵、斜隔膜,分隔处不隘缩或微隘缩,大小为(15~50)μm×(7.5~12.5)μm,孢身偶有柱状或锥状的假喙(图2c)。在PCA+滤纸上,25℃光暗交替培养5 d,在细长的分生孢子梗上部形成特征性的具短分生孢子链(图2d),其分生孢子假喙可多次产孢,作合轴式延伸(图2e),分生孢子侧面与基部易萌生次生分生孢子梗而产孢并形成支链(图2f),分生孢子链较短,支链一般长1~5个孢子,最长也未达到10个孢子。查阅文献《中国真菌志-链格孢属》[10],发现本菌株的培养性状和形态特征与其中对链格孢(Alternaria alternata)的培养性状和形态特征描述相符,因此,在形态上我们将分离物HB-1鉴定为链格孢(A.alternata)。
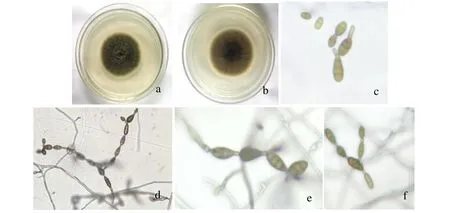
图2 病原菌的形态学特征Fig.2 Morphological characteristics of the pathogenic fungus
2.3 致病性测定

图3 ‘金艳’猕猴桃接种HB-1菌株的发病症状Fig.3 Symptoms of‘Jinyan’kiwifruit inoculated with the fungal strain HB-1
将分离得到的菌株进行室内和田间致病性测定,结果表明,室内接种HB-1菌株后,3 d开始发病,刺伤处出现深褐色小病斑,逐天观察,病斑不断扩大并逐渐变黑,果实内部为深褐色(图3a,图3b),对照接种未见发病(图3c,图3d);田间接种HB-1菌株后,3 d开始发病,病斑褐色,凹陷,后期病斑逐渐扩大(图3e),10 d后出现落果现象,对照接种不表现发病症状(图3f)。对接种病斑进行病菌再分离,获得了与原接种菌培养性状和形态特征一致的菌株。
2.4 分子生物学鉴定
以供试分离物HB-1的基因组DNA为模板,分别用引物ITS1/ITS4和EF-1F/EF-1R扩增rDNA-ITS和EF-1α基因序列(图4),扩增产物测序后去除两端引物,其序列长度各为531 bp和240 bp,其在GenBank中的登录号分别为MH715974和MH708309。将此序列与GenBank中已有序列进行同源性比较,结果与链格孢(Alternaria alternata)和细级链格孢(Alternaria tenuissima)对应序列的同源性均为100%。细极链格孢与链格孢的分生孢子链明显不同,前者孢子链长度一般超过10个孢子,孢子链很少有分支,后者孢子链长度不超过10个孢子,且常常有支链。根据此同源性比较结果,结合上述形态学特征,进一步将分离物HB-1鉴定为链格孢(A.alternata)。
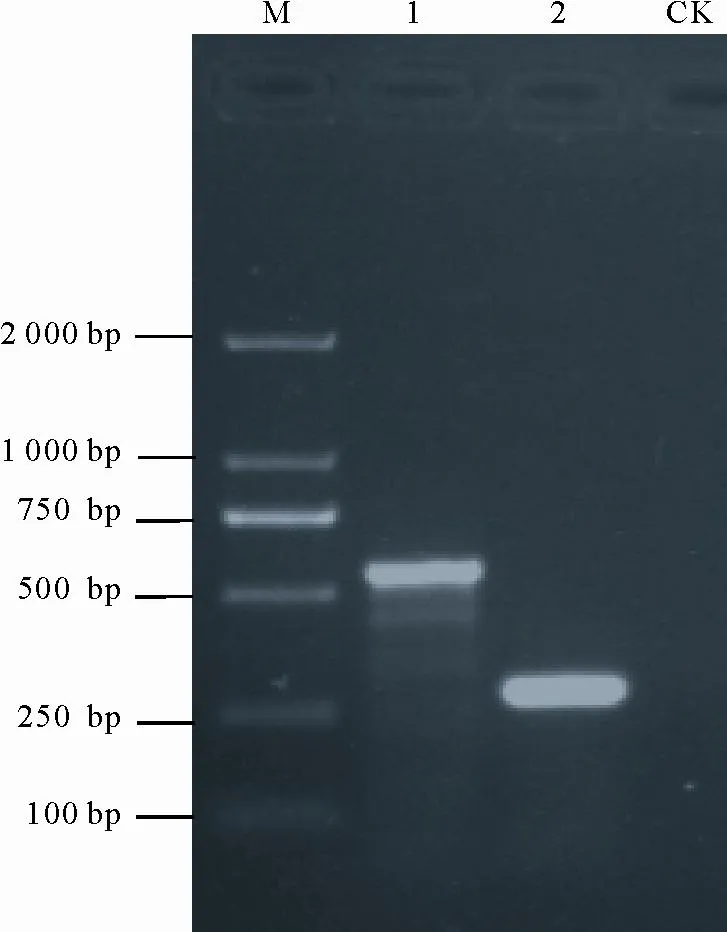
图4 供试菌株HB-1的PCR扩增产物电泳图Fig.4 Electrophoresis of PCR amplified products of the strain HB-1

表1 22种杀菌剂对猕猴桃黑斑病菌的毒力回归方程Tab.1 Toxicity regression equation of 22 fungicides against Alternaria alternata
2.5 不同药剂对猕猴桃黑斑病菌的抑制作用
室内毒力测定结果表明,22种杀菌剂对猕猴桃黑斑病菌菌丝生长表现出不同程度的抑制作用(表1),其中10%申嗪霉素、50%咪鲜胺锰盐、25%已唑醇、75%肟菌·戊唑醇、25%丙环唑、10%苯醚甲环唑、75%戊唑·嘧菌酯和400 g/L氟硅䂳8种杀菌剂的抑制作用大,即毒力强,EC50值分别为0.182 1,0.198 2,0.242 1,0.286 5,0.455 9,0.500 2,0.598 7,0.763 3 μg/mL,均小于1 μg/mL;其次为12%中生菌素、50%嘧菌环胺、25%吡唑醚菌酯、50%异菌脲、68.75%噁酮·锰锌、10%多抗霉素、70%丙森锌、70%代森联和24%腈苯唑,这9种杀菌剂对猕猴桃黑斑病菌的抑制作用较大,即毒力较强,EC50值1~10 μg/mL,相比较而言,本组前6种杀菌剂的抑菌作用又明显大于后3种;50%啶酰菌胺、80%乙蒜素、2%春雷霉素、40.4%精甲·百菌清和75%百菌清5种杀菌剂的抑菌作用则较小或不明显,EC50值均大于25 μg/mL。
3 结论与讨论
本文对近年来在江西省奉新县猕猴桃产区出现的一种新病害猕猴桃黑斑病进行了病原鉴定,鉴定结果与他人对韩国猕猴桃黑腐病和陕西省猕猴桃褐斑病的病原鉴定结果[6-7]相同,均为链格孢(A.alternata)。因此,这3种病害应属于同一种病害。然而,这3种病害虽然症状较为一致,但发病部位和发生时期不尽相同。奉新猕猴桃黑斑病在果实的生长发育前期为害,发病部位主要在果身;韩国猕猴桃果腐病也在果实生长发育前期为害,但为害部位主要在果脐部[8];陕西猕猴桃褐斑病除在果实的生长发育期为害外,还可在贮藏期继续为害,发病部位主要在果身,此外,还可为害叶片[9]。造成三者差异的原因究竟是病菌致病性不同还是其他因素引致有待进一步研究。
链格孢属(Alternaria)真菌是一类常见的植物病原菌[22-23],其有效药剂较多,但具体到该属中的某种真菌或同一种真菌不同来源的分离物,其有效药剂并不完全相同[24-25]。为了筛选出对奉新猕猴桃黑斑病具有高效的药剂,本研究有针对性地选用了22种杀菌剂进行室内毒力测定,结果表明10%申嗪霉素、50%咪鲜胺锰盐、25%已唑醇、75%肟菌·戊唑醇、25%丙环唑、10%苯醚甲环唑、75%戊唑·嘧菌酯和400 g/L氟硅䂳8种杀菌剂对猕猴桃黑斑病菌具有强烈的抑制作用。在这8种药剂中,氟硅唑和苯醚甲环唑曾被赵金梅等[8]筛选为对陕西周至猕猴桃上链格孢菌(A.alternata)的高效药剂,但咪酰胺锰盐被认为效果不显著,其余5种研究人员则未进行药效测定。对这8种高效药剂,最值得推荐的为申嗪霉素,该药不但对猕猴桃黑斑病菌毒力最强,而且属生物农药。当然,上述结果仅代表杀菌剂对猕猴桃黑斑病菌的室内抑菌作用,要获得其对该病害的实际防效,还有待于后续的田间药效试验。
本研究对江西奉新县金艳猕猴桃黑斑病进行了病菌分离,对分离病菌进行了形态学和基于rDNAITS和EF-1α序列分析的分子生物学鉴定,结果表明引起江西省奉新县‘金艳’猕猴桃黑斑病的病原菌链格孢(Alternaria alternata),属半知菌类链格孢属真菌。22种杀菌剂对猕猴桃黑斑病菌室内毒力强弱不同,8种毒力强,9种毒力较强,5种毒力较弱或不明显。

