氨氮急性胁迫对大菱鲆幼鱼的毒性效应*
孟 振 张鸿丽 刘新富 姜 勇 贾玉东 刘 滨 曲江波 徐荣静
氨氮急性胁迫对大菱鲆幼鱼的毒性效应*
孟 振1张鸿丽2刘新富1①姜 勇3贾玉东1刘 滨1曲江波4徐荣静4
(1. 中国水产科学研究院黄海水产研究所 农业农村部极地渔业开发重点实验室 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;2. 暨南大学赤潮与海洋生物学研究中心 广州 510632;3. 青岛国家海洋科学研究中心 青岛 266071;4. 烟台开发区天源水产有限公司 烟台 264006)
本研究采用96 h半静态毒性实验方法,研究了氨氮对大菱鲆()幼鱼的急性毒性效应和血浆生理指标的影响。结果显示,在水温为(19.0±0.5)℃、pH为7.85、盐度为29.5和溶解氧为(7.8±0.2) mg/L的环境条件下,平均体重为(163.90±15.31) g的大菱鲆幼鱼,总氨(TAN)和非离子氨(NH3-N)96 h的半致死浓度(LC50)分别为39.73和0.64 mg/L。氨氮浓度、暴露时间及二者交互作用对血浆肾上腺素(EPI)、皮质醇(Cortisol)、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)、碱性磷酸酶(AKP)和血糖(GLU)含量/活性都存在显著影响;血浆EPI、SOD、GSH、AKP和GLU随氨氮浓度升高响应时间提前,EPI、皮质醇、AKP和GLU随暴露时间延长总体呈现先升后降的趋势;致死高浓度胁迫(TAN浓度70.96和84.11 mg/L)下,血浆SOD和GSH在胁迫期(12 h)内快速升高,GLU快速升高(4 h)后急剧降低(12 h),暗示氨氮急性致死的原因与氧化应激损伤、生理代谢紊乱和呼吸功能受损有关。本结果可为大菱鲆大规格幼鱼的养殖管理和行为数值模拟提供基础资料。
大菱鲆;氨氮急性胁迫;血浆生理指标
氨氮(Ammonia nitrogen, AN)是指水体中以非离子氨(NH3-N)和铵离子(NH4+-N)形式存在的氮,二者可相互转换,受水质pH、温度和盐度等参数影响呈现动态平衡(Johansson, 1980),统称为总氨氮(TAN),对鱼类具有很强的毒性(Randall, 2012; Ruyet, 1995)。其中,NH3-N由于亲脂性和缺乏电荷,可以较容易地通过鳃上皮细胞扩散,并通过泌氯细胞主动转运,造成血液和组织中氨的积累,引发鱼体中毒反应,毒性强于NH4+-N(Roumieh, 2013; Weihrauch, 2009)。
大菱鲆()是西班牙、中国和智利等国家的重要海水养殖鱼类,中国的年产量达 5万多t,约占世界养殖总产量的80%左右(FAO, 2017)。我国大菱鲆养殖的主要方式是利用适温的地下海水进行陆基工厂化流水养殖和循环水集约化养殖,养殖水体中的氨氮主要来源于饲料等有机物投入品分解、鱼类自身生理代谢和环境污染等,而在集约化养殖系统中,一旦水交换受到限制或者生物滤池净化能力不足,系统生物负载过高,氨氮易出现持续或瞬间升高,成为鱼类生长和生存的限制因素。尽管此前已有对大菱鲆苗种的氨氮半致死剂量、安全浓度(Ruyet, 1995; 曲克明等, 2007)和慢性胁迫(Foss, 2007; Ruyet, 1997)的研究报道,但未见对养成过程中大规格幼鱼氨氮急性胁迫的生理响应研究。此外,氨氮急性胁迫容易引起养殖鱼类行为模式的改变,揭示其行为响应的生理学基础,并用于建立行为数值模拟的在线预警系统,可以避免因循环水系统中氨氮的突然升高导致大菱鲆养殖损失的发生(Shinoda, 2017; Simon, 2017)。
本研究通过96 h半静态急性胁迫实验,确定大菱鲆大规格幼鱼氨氮的半致死浓度(LC50)和安全浓度(SC),分析氨氮急性胁迫下血液生理生化指标的变化规律,筛选相应的生物标志物,揭示机体行为响应的生理基础,旨在为实现大菱鲆行为数值模拟及其在集约化养殖中的应用提供基础资料。
1 材料与方法
1.1 实验材料
实验在山东烟台开发区天源水产有限公司进行,幼鱼为公司培育的全雌苗种,平均全长为(21.06±0.54) cm、体重为(163.90±15.31) g。选择体质健壮、活力强、规格整齐的幼鱼,实验前在实验水槽暂养48 h,暂养期间不投饵。
实验水槽体积为300 L,实验用水为紫外线消毒的砂滤海水,水温为(19.0±0.5)℃,pH为7.85,盐度为29.5,溶解氧为(7.8±0.2) mg/L,TAN<0.1 mg/L。
1.2 半致死剂量实验
通过预实验获得24 h 100%死亡质量浓度(LC100, 24 h)和96 h 零死亡质量浓度(LC0, 96 h),设为上、下限,按等对数间距设置氨氮浓度梯度。本实验中,氨氮质量浓度由低到高依次设置为30.28(A组)、35.90(B组)、42.56(C组)、50.47(D组)、59.82(E组)、70.96(F组)和84.11 mg/L(G组),共7个浓度处理组。同时,设置对照组(不添加NH4Cl)。氨氮采用分析纯NH4Cl(国药集团),以过滤海水配制10 g/L的NH4Cl母液,即配即用。
每个实验组设3个平行样,每个平行样放入同规格大菱鲆幼鱼10尾。实验开始时,水槽注入300 L新鲜海水,按设计浓度加入相应体积NH4Cl母液,充气,静水培育,每24 h全部换水1次,换水期间,将实验鱼快速转移至新配置的同浓度养殖水槽中。采用纳氏试剂法测定养殖水槽0、24 h的实际氨氮浓度(表1)。实验期间不投饵,每4 h测量1次水温、溶解氧和pH,每24 h记录各平行样死亡个体数量,并及时剔除死亡个体,鱼体死亡以碰触15 s内无反应为准。
表1 养殖水槽实时总氨氮(TAN)浓度
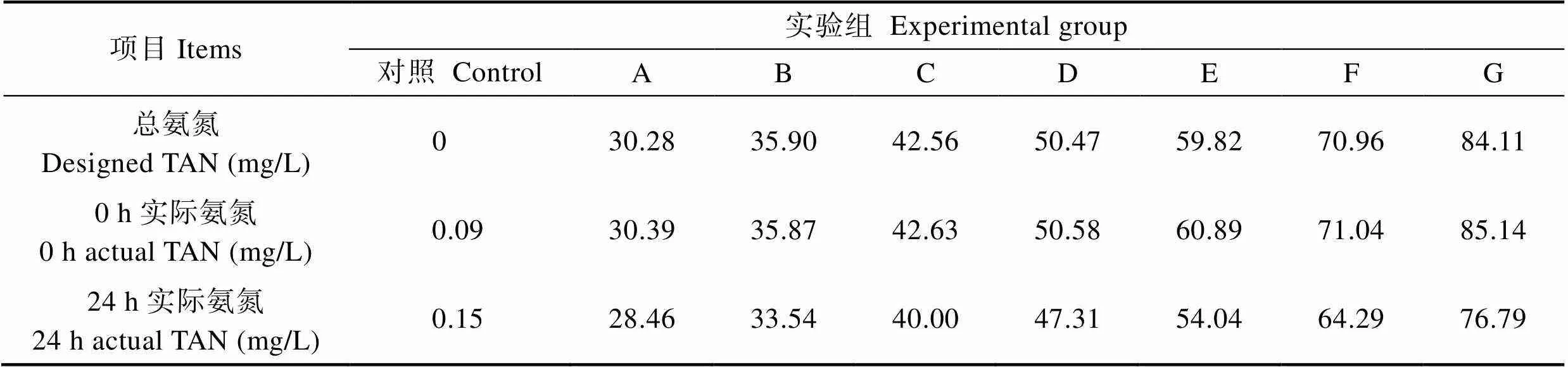
Tab.1 Analyzed TAN and NH3 levels in experimental groups
1.3 氨氮急性胁迫实验
采用上述氨氮浓度梯度及实验操作,评估氨氮急性胁迫对大菱鲆大规格幼鱼血液生理、生化指标的影响,每个实验组设3个平行样,每个平行样放入上述同规格大菱鲆幼鱼30尾。
1.3.1 血液样品采集 在胁迫实验的0、4、8、12、24、48、72和96 h随机取样采血,每次每组平行样各随机取样2尾,共6尾鱼,其中,F、G组在24 h后,D、E组在72 h后因高死亡率,存活数量无法满足要求而不再取样。采血后,将鱼体放入暂养池,不再放回原实验水槽,以避免对同一条鱼重复取样。
为减少采血操作对结果的影响,取样时,将鱼迅速捞起并立即投入浓度为200 mg/L的MS-222海水中进行快速深度麻醉(10~15 s碰触无反应),尾静脉釆血。采血注射器及离心管均用20 μl的1%肝素钠溶液浸润、烘干、冷却后使用。采集血样在4℃保温箱中静置,以4℃、4000 r/min离心10 min制备血浆,血浆于–80℃冰箱中保存备用。
1.3.2 血液样品分析 血浆皮质醇(Cortisol)和肾上腺素(EPI)的测定采用上海酶联生物研究所的ELISA试剂盒;碱性磷酸酶(AKP)、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)和葡萄糖(GLU)的测定试剂盒购自南京建成生物工程研究所,操作方法参照试剂盒说明书。
1.4 数据分析
大菱鲆24、48、72和96 h的TAN和NH3-N的LC50和95%可信区间使用SPSS 17.0软件以概率单位加权回归(Probit)法求出。SC的计算公式如下(Sprague, 1971):

NH3-N浓度由TAN浓度采用《海水水质标准》(GB 3097-1997)公式换算。
血浆生理生化指标数据以平均值±标准差(Mean±SD)表示,采用SPSS 17.0软件双因素方差分析(Two-way ANOVA)进行检验,并采用Tukey’s多重比较分析同一浓度不同时间和同一时间不同浓度处理组间的差异,<0.05为显著性差异。
2 结果
2.1 行为反应
大菱鲆大规格幼鱼对氨氮急性胁迫产生明显的行为反应,高浓度组鱼体行为响应时间提前,反应程度激烈。以G组(TAN为84.11 mg/L)为例,实验开始1 h内,鱼体相对安静伏底,2 h后,陆续出现部分个体沿池底快速游动,表现出亢奋、烦躁不安的症状,受惊后会急速逃避、快速游动、冲击池壁或冲出水面,短暂、快速运动后即安静伏底,逐渐丧失平衡能力,鱼体侧翻,反应变慢甚至无反应。死亡鱼体特征表现为身体侧翻、口张大、鳃盖张开。所有处理组鱼体体色均呈变淡的趋势,高浓度组体色变淡的速度更快,大菱鲆体表特有的色素斑点也因此更加明显。
2.2 半致死浓度和安全浓度
24 h静水培育条件下,TAN浓度随时间延长呈现一定程度的衰减,损失率介于6.01%(A组)~9.66% (E组)(表1)。本实验中,24 h换水1次能保证氨氮有效浓度维持在90%以上,因此,以设计浓度计算LC50时可相对准确反映大菱鲆对氨氮的耐受程度。氨氮急性胁迫对大菱鲆幼鱼的毒性效果见表2。从表2可以看出,随着氨氮浓度的升高,其毒性作用增加,幼鱼死亡率升高;随着暴露时间的延长,除最低浓度组外,其他浓度组累计死亡数量逐渐增加,氨氮对幼鱼的毒性作用随时间延长逐渐增加。
SPSS 17.0软件概率单位加权回归(Probit)法分析结果表明,TAN和NH3-N对大菱鲆24、48、72和96 h的LC50分别为55.71、45.53、41.23、39.73 mg/L和0.89、0.73、0.66、0.64 mg/L,氨氮和NH3-N安全浓度分别为3.97和0.06 mg/L(表3)。
2.3 血液生理和生化指标分析
2.3.1 对神经内分泌激素的影响 氨氮浓度和处理时间均对大菱鲆血浆EPI含量变化有显著影响,且二者存在显著的交互作用(表4)。同一氨氮浓度下,血浆EPI含量随处理时间的延长呈现先上升后下降的趋势,处理4 h内,各组EPI含量无明显变化,此后,EPI含量达到最高值的时间随氨氮浓度的升高相应提前,高浓度处理组(D、E、F和G组)氨氮胁迫8 h后,EPI含量即达到最高值,低浓度处理组(A、B和C组)氨氮胁迫24或12 h后,EPI含量达到最高值。
血浆皮质醇含量受氨氮浓度、处理时间和二者交互作用的显著影响(表5)。各处理组皮质醇含量随处理时间延长总体呈现先升后降的趋势,高浓度组(F和G组)血浆皮质醇含量在12 h内缓慢升高,12 h显著高于处理前(<0.05),除A组外的其余浓度组的皮质醇含量在24 h达最高值,此后,仍维持较高水平,A组血浆皮质醇含量在12、72和96 h显著高于处理前(<0.05),其他时间与处理前无明显差异。
表2 氨氮急性胁迫对大菱鲆幼鱼的致死结果

Tab.2 Lethal results of acute ammonia toxicity on juvenile turbot
表3 氨氮、非离子氨对大菱鲆幼鱼的半致死浓度和安全质量浓度
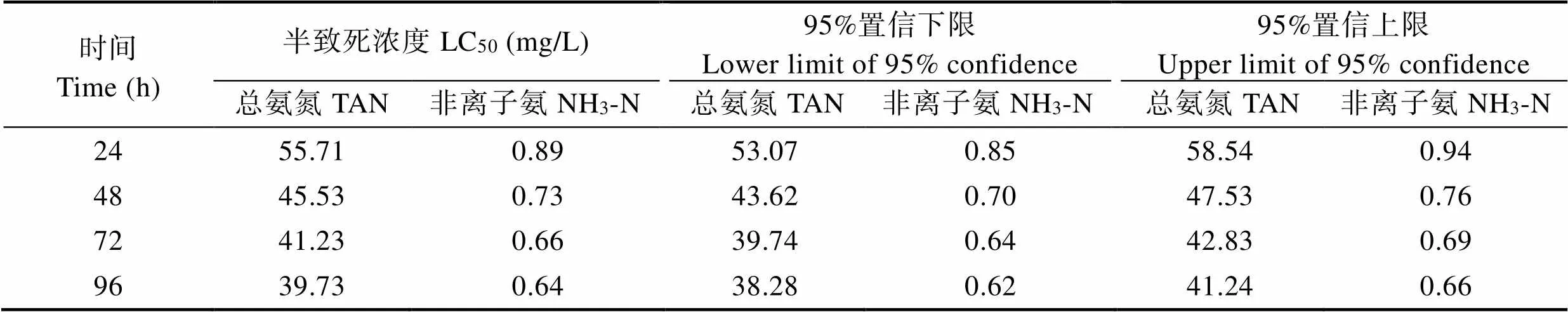
Tab.3 The LC50 and SC values of ammonia and non-ion ammonia on juvenile turbot
表4 氨氮急性胁迫对大菱鲆血浆肾上腺素含量的影响
注:—为未检测;不同小写字母表示同一浓度组不同时间存在显著差异(<0.05);不同大写字母表示同一时间不同浓度组存在显著差异(<0.05),下同
Note: — no determination. Different lowercase letters indicate significant differences in the same concentration group at different times (<0.05); Different uppercase letters indicate significant differences in different concentration groups at the same time (<0.05), the same as below
2.3.2 对氧化应激参数的影响 氨氮急性胁迫引起大菱鲆氧化应激,启动抗氧化反应。各处理组血浆SOD活性受氨氮浓度、处理时间和二者交互作用的显著影响(表6)。SOD活性随氨氮浓度升高响应时间提前,高浓度氨氮胁迫组(F和G组)在胁迫4 h,血浆SOD活性即显著升高(<0.05),至12 h时达最高值,中间浓度D和E组SOD活性在胁迫8~24 h后也显著升高(<0.05),随后呈下降趋势,低浓度处理组 (A组~C组)SOD活性则呈下降趋势,在胁迫后期(72、96 h)显著低于对照组(<0.05)。
各处理组的血浆GSH含量也受氨氮浓度、处理时间和二者交互作用的显著影响(表7)。GSH浓度随氨氮浓度变化趋势明显,高浓度胁迫组(F和G组)血浆GSH含量在胁迫8 h即显著高于对照组和其他处理组(<0.05),12 h达最高值,其他组GSH含量随氨氮浓度的升高起始上升时间也相应提前,且GSH含量在胁迫处理96 h仍显著高于对照组(<0.05)。
2.3.3 对免疫机能的影响 血浆AKP活性受氨氮浓度、处理时间及交互作用的显著影响(表8),各处理组血浆AKP活性随氨氮浓度的增加起始上升时间相应提前,随暴露时间延长总体呈现先上升后下降的趋势,其中,F和G组AKP含量胁迫4~8 h时显著升高(<0.05),低浓度组(A、B、C)则延迟至12~24 h才显著升高(<0.05),至72 h达最高值。
2.3.4 对血液生化指标的影响 血浆GLU含量受氨氮浓度、处理时间及交互作用的显著影响。各处理组GLU含量随氨氮胁迫浓度的升高达到最高值的时间相应提前,而随处理时间呈先上升后下降的变化趋势,高浓度组(F和G组)GLU含量在胁迫4 h即达最大值,而12 h下降至极低的水平,显著低于处理前(<0.05);D和E组GLU含量在8~12 h显著升高(< 0.05),至48 h时迅速下降至极低水平(<0.05);低浓度组(A、B和C组)血糖8~48 h逐渐升高,72 h后呈下降趋势,至96 h含量仍显著高于对照组(<0.05),但3个处理组间无显著差异(>0.05)。
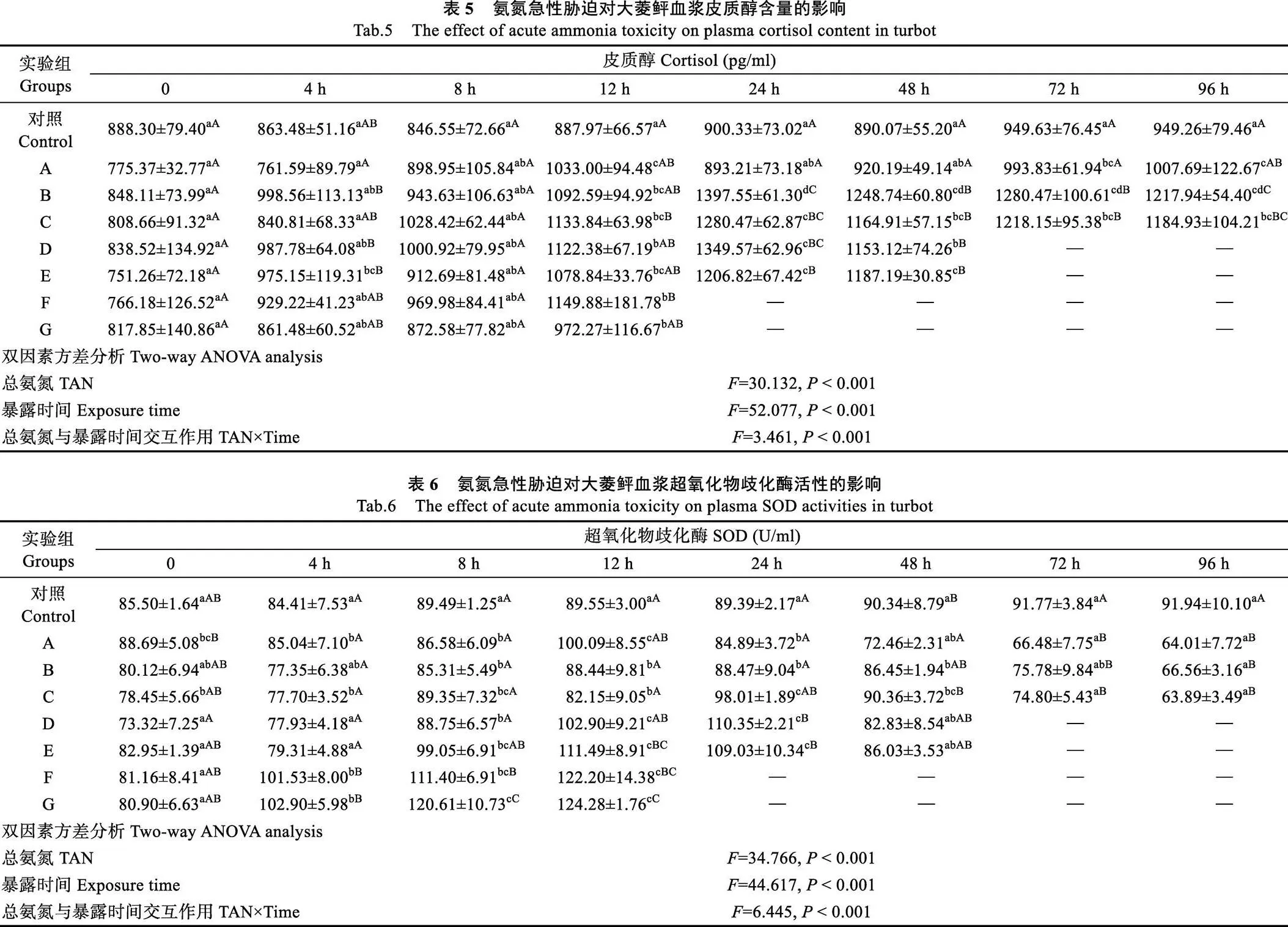

表7 氨氮急性胁迫对大菱鲆血浆谷胱甘肽含量的影响
表8 氨氮急性胁迫对大菱鲆血浆碱性磷酸酶含量的影响
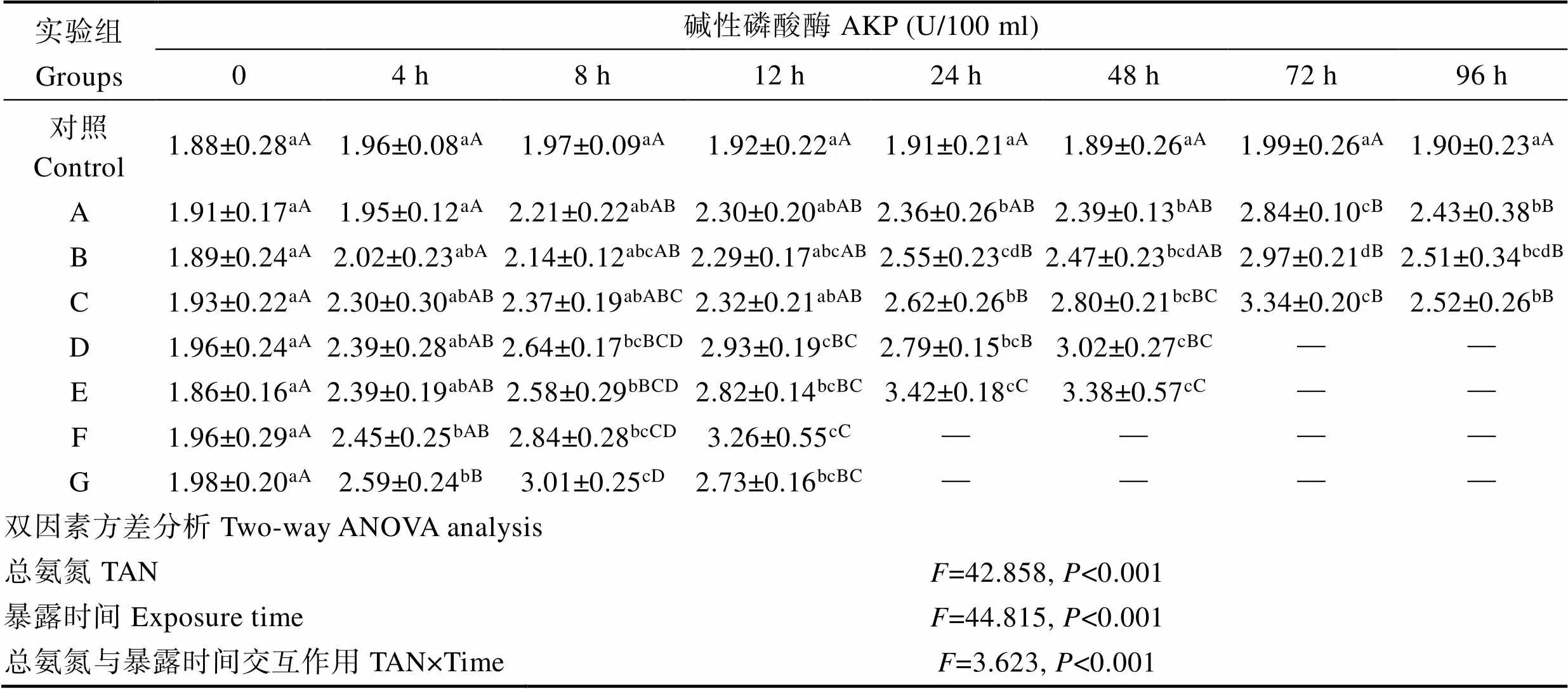
Tab.8 The effect of acute ammonia toxicity on plasma AKP content in turbot
3 讨论
氨氮对鱼类的毒性效应有急性和慢性之分,慢性毒性效应常表现为摄食降低、生长减慢、免疫力降低等(Peng, 2017),而急性效应则表现为鳃过度通气、机体亢奋、游泳不稳定、失去平衡、抽搐或死亡等特征(Ip, 2001; Silva, 2018)。本研究中,氨氮急性胁迫的大菱鲆行为反应除表现出上述症状外,体色也发生明显变化,主要表现在背面体色变浅和体表特有色素斑点变深,而体色的变化在黄颡鱼()氨氮胁迫的行为响应中也有报道(李波等, 2009)。因此,在大菱鲆氨氮胁迫行为反应数值模拟分析中,可以将体色和色素斑点作为重要的量化指标。
表9 氨氮急性胁迫对菱鲆血糖含量的影响

Tab.9 The effect of acute ammonia toxicity on plasma GLU content in turbot
LC50和SC反映了鱼类对氨氮的耐受力,可为养殖管理提供指导(Liao, 2011)。本研究中,大菱鲆幼鱼规格为(163.90±15.31) g,全长为(21.06±0.54) cm,96 h非离子氨LC50为0.64 mg/L(TAN为39.73 mg/L),低于其稚鱼期(体长2.0~2.4 cm)的半致死剂量(1.14 mg/L) (曲克明等, 2007),Ruyet等(1995)对不同规格大菱鲆的急性氨氮胁迫实验也表明,幼鱼规格从(6.3±1.2) g增长至(162.8±44.0) g,非离子氨LC50,96 h从3.41 mg/L下降至1.45 mg/L,此外,规格为104 g的幼鱼长期慢性胁迫的SC为0.1 mg/L(Ruyet, 1997)。上述结果表明,大菱鲆对氨氮的耐受性随规格增加而逐渐降低,多种鱼类呈现相似规律(Randall, 2002)。
已有研究表明,氨氮急性和慢性胁迫可引起大菱鲆血浆促肾上腺皮质激素释放激素(CRH)、促肾上腺皮质激素(ACTH)和皮质醇的显著升高(Ruyet, 1998、2003; 贾睿, 2016),表明下丘脑–垂体–肾间组织轴(HPI轴)可通过一系列激素的级联释放参与氨氮胁迫的调节,以增强机体抵抗力。本研究中,大菱鲆血浆EPI在氨氮胁迫初期(8~24 h)即显著升高,此后呈下降趋势,血浆皮质醇的响应时间则较EPI稍延迟,除A组外的低浓度组在24 h达最高值,此后,略有降低但维持高水平。由此推测,氨氮急性胁迫下,特别是高浓度胁迫可以造成血浆非离子氨浓度的快速升高,引起血红蛋白氧亲和力的急剧降低(Pankhurst, 2011),交感–嗜铬组织系统首先被激活,血浆EPI浓度快速升高。HPI轴系统则可能在大菱鲆氨氮胁迫中起主要调节作用,表现在血浆皮质醇始终维持较高的表达水平,而EPI在胁迫后期恢复至对照组水平,这可能与皮质醇对EPI的反馈抑制有关(王美垚, 2009),大菱鲆神经内分泌系统对氨氮胁迫的生理响应及其调节机理仍有待于从分子水平和激素水平进一步探索。
作为关键的氧化应激触发因素,氨氮诱导水生动物产生大量活性氧簇(Reactive oxygen species, ROS),从而导致氧化应激启动抗氧化反应(Sun, 2011; Monteiro, 2006; Paulino, 2012)。本研究中,血浆SOD、GSH含量与氨氮浓度和暴露时间均表现出明显的响应关系,高致死浓度(F和G组)胁迫4 h,二者即显著升高,接近死亡高峰时间(12 h)达最高值;而低浓度组(A~C组)SOD整体呈现下降趋势,胁迫后期显著低于对照组,GSH响应时间延迟至24 h,此后呈先升后降的趋势,96 h仍显著高于对照组。本结果与牙鲆()(叶继丹等, 2007)、圆斑星鲽()(王贞杰等, 2017)、巴南牙鲆()(Maltez, 2017)、草鱼()(周鑫, 2012)和黄颡鱼(Zhang, 2018)等多个物种的氨氮胁迫对鱼体氧化应激的报道相似。
氨氮长期胁迫会造成鱼类免疫功能和抗病力降低(黎庆等, 2015),而急性氨氮胁迫对鱼类免疫功能影响的研究相对较少。AKP是鱼类重要的非特异性免疫标志酶,作为一种细胞内酶,在肝脏、肾脏和血红细胞中含量较高,血浆酶水平的变化反映了胁迫造成的组织、细胞损伤程度和机体免疫能力(Silva, 2018)。本研究中,血浆AKP酶含量在急性胁迫下随氨氮浓度的升高响应时间提前,随处理时间延长总体呈先升后降的趋势,和Peyghan等(2002)对鲤鱼()的研究结果相一致。氨氮对鱼类最重要的组织病理学作用是鳃、肝脏、肾脏组织和细胞的水肿、充血和出血,高浓度氨氮在短时间内即可造成细胞损伤,胞内AKP酶释放进入血浆,使得血浆AKP酶在短时间快速升高(彭军辉等, 2018)。低浓度组血浆AKP酶前期缓慢升高与氨氮胁迫引起的机体免疫应激相关,后期呈下降趋势则代表机体免疫力的降低。
鱼体应激反应是一种耗能过程,葡萄糖氧化分解是鱼类能量供给的重要途径,应激反应会导致血糖水平的变化(韩娜娜等, 2010)。氨氮慢性胁迫会导致鱼类血糖浓度的波动,血糖会随胁迫时间呈现先升后降的趋势,高浓度组下降尤其明显,这一规律已在鲤鱼(王琨, 2007)、南方鲶()(赵海涛, 2006)和阿氏冠鲇()(Silva, 2018)等多种鱼类中得到验证。本研究中,GLU含量随氨氮胁迫浓度升高响应时间提前,而随时间呈现先升后降的变化趋势,高浓度组在胁迫初期(4~8 h)GLU即显著升高,接近胁迫前的2倍,至死亡前(12、24 h)血糖浓度快速下降。低浓度组胁迫初期(48 h内)血糖逐渐升高,后期呈下降趋势,96 h仍显著高于对照组(<0.05),相关结果与其他鱼类氨氮慢性胁迫的血糖变化规律相似。高浓度组胁迫初期血糖快速升高可能是由于急性胁迫效应引起对额外能量的需求,导致糖异生作用加强,血糖含量急速升高(Silva, 2018),随着胁迫时间延长和损伤加剧,机体应对胁迫消耗过多的血糖,血糖急剧下降,血糖代谢紊乱也影响了呼吸代谢的能量供应,致使本研究中大菱鲆死亡个体均呈现缺氧死亡症状。
综上所述,在本实验条件下,大菱鲆大规格幼鱼[(163.90±15.31) g]TAN和NH3-N 96 h的LC50分别为39.73和0.64 mg/L。氨氮浓度、暴露时间及二者交互作用对血浆EPI、皮质醇、SOD、GSH、AKP和GLU含量/活性都存在显著影响;其中,血浆EPI、SOD、GSH、AKP和GLU随氨氮浓度升高响应时间提前,EPI、皮质醇、AKP和GLU随暴露时间延长总体呈先上升后下降的趋势;高浓度胁迫组(FG组)血浆SOD和GSH在胁迫期内快速升高、GLU快速升高后急剧降低,暗示氨氮急性致死的原因与氧化应激损伤、生理代谢紊乱和呼吸功能受损有关。
FAO. Global aquaculture production 1950-2016 (online query). 2017
Foss A, Imsland AK, Roth B,. Interactive effects of oxygen saturation and ammonia on growth and blood physiology in juvenile turbot. Aquaculture, 2007, 271(1): 244–251
Han NN, Shi CY. The application of blood indexes in ichthyological research. Journal of Anhui Agricultural Science, 2010, 38(33): 18877–18880 [韩娜娜, 史成银. 血液指标在鱼类学研究中的应用. 安徽农业科学, 2010, 38(33): 18877–18880]
Ip YK, Chew SF, Randall DJ. Ammonia toxicity, tolerance, and excretion. Fish Physiology, 2001, 20: 109–148
Jia R. Study of stress response mechanism of turbot () to stocking density, nitrite and ammonia exposure. Doctoral Dissertation of Nanjing Agricultural University, 2016 [贾睿. 大菱鲆对养殖密度、亚硝酸盐和氨氮胁迫的应激响应机制研究. 南京农业大学博士研究生学位论文, 2016]
Johansson O, Wedborg M. The ammonia-ammonium equilibrium in seawater at temperatures between 5 and 25℃. Journal of Solution Chemistry, 1980, 9(1): 37–44
Li B, Fan QX, Zhang L,. Acute toxic effects of ammonia and nitrite on yellow catfish () at different dissolved oxygen levels. Freshwater Fisheries, 2009, 39(3): 31–35 [李波, 樊启学, 张磊, 等. 不同溶氧水平下氨氮和亚硝酸盐对黄颡鱼的急性毒性研究. 淡水渔业, 2009, 39(3): 31–35]
Li Q, Gong SY, Li M. Chronic ammonia toxicity induces glutamine accumulation, oxidative damage and immunosuppression of juvenile yellow catfish. Journal of Fisheries of China, 2015, 39(5): 728–734 [黎庆, 龚诗雁, 黎明. 慢性氨氮暴露诱发黄颡鱼幼鱼谷氨酰胺积累、氧化损伤及免疫抑制的研究. 水产学报, 2015, 39(5): 728–734]
Liao YY, Wang HH, Lin ZG. Effect of ammonia and nitrite on vigour, survival rate, moulting rate of the blue swimming crabzoea. Aquaculture International, 2011, 19(2): 339–350
Maltez LC, Stringhetta GR, Enamorado AD,. Ammonia exposure and subsequent recovery trigger oxidative stress responses in juveniles of Brazilian flounder. Fish Physiology and Biochemistry, 2017, 43(6): 1747–1759
Monteiro DA, de Almeida JA, Rantin FT,. Oxidative stress biomarkers in the freshwater characid fish,, exposed to organophosphorus insecticide Folisuper 600 (Methyl parathion). Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2006, 143(2): 141–149
Pankhurst NW. The endocrinology of stress in fish: An environmental perspective. General and Comparative Endocrinology, 2011, 170(2): 265–275
Paulino MG, Souza NES, Fernandes MN. Subchronic exposure to atrazine induces biochemical and histopathological changes in the gills of a Neotropical freshwater fish,. Ecotoxicology and Environmental Safety, 2012, 80: 6–13
Peng JH, Chen LY, Cheng CH,. Acute toxicity of ammonia nitrogen toand its influence on immune factors in serum. Progress in Fishery Sciences, 2018, 39(5): 114–121 [彭军辉, 陈丽英, 程长洪, 等. 氨氮对拟穴青蟹的急性毒性及对其血清免疫相关酶活力的影响. 渔业科学进展, 2018, 39(5): 114–121]
Peng R, Wang P, Le K,. Acute and chronic effects of ammonia on juvenile cuttlefish,. Journal of the World Aquaculture Society, 2017, 48(4): 602–610
Peyghan R, Takamy GA. Histopathological, serum enzyme, cholesterol and urea changes in experimental acute toxicity of ammonia in common carpand use of natural zeolite for prevention. Aquaculture International, 2002, 10(4): 317–325
Qu KM, Xu Y, Ma SS,. Acute toxic effects of nitrite and non ion ammonia on turbot () at different DO levels. Marine Fisheries Research, 2007, 28(4): 83–88 [曲克明, 徐勇, 马绍赛, 等. 不同溶解氧条件下亚硝酸盐和非离子氨对大菱鲆的急性毒性效应. 海洋水产研究, 2007, 28(4): 83–88]
Randall DJ, Tsui TKN. Ammonia toxicity in fish. Marine Pollution Bulletin, 2002, 45(1–12): 17–23
Roumieh R, Barakat A, Abdelmeguid NE,. Acute and chronic effects of aqueous ammonia on marbled spinefoot rabbitfish,(Forsskal 1775). Aquaculture Research, 2013, 44(11): 1777–1790
Ruyet JPL, Boeuf G, Infante JZ,. Short-term physiological changes in turbot and seabream juveniles exposed to exogenous ammonia. Comparative Biochemistry and Physiology A: Molecular and Integrative Physiology, 1998, 119(2): 511–518
Ruyet JPL, Chartois H, Quemener L. Comparative acute ammonia toxicity in marine fish and plasma ammonia response. Aquaculture, 1995, 136(1–2): 181–194
Ruyet JPL, Galland R, Le Roux A,. Chronic ammonia toxicity in juvenile turbot (). Aquaculture, 1997, 154(2): 155–171
Ruyet JPL, Lamers A, Le Roux A,. Long-term ammonia exposure of turbot: Effects on plasma parameters. Journal of Fish Biology, 2003, 62(4): 879–894
Shinoda R, Wu HY, Murata M,. Development of an optical communication type biosensor for real-time monitoring of fish stress. Sensors and Actuators B: Chemical, 2017, 247: 765–773
Silva MJS, Costa FFB, Leme FP,. Biological responses of neotropical freshwater fishexposed to ammonia and nitrite. Science of the Total Environment, 2018, 616–617(1): 1566–1575
Simon Y, Levavi-Sivan B, Cahaner A,. A behavioural sensor for fish stress. Aquaculture Engineering, 2017, 77: 107–111
Sprague JB. Measurement of pollutant toxicity to fish-III: Sublethal effects and “safe” concentrations. Water Research, 1971, 5(6): 245–266
Sun HJ, Yang W, Chen YF,. Effect of purified microcystin on oxidative stress of silver carplarvae under different ammonia concentrations. Biochemical Systematics and Ecology, 2011, 39(4–6): 536–543
Wang K. Effects of ammonia on some tissue and haematological parameters of juvenile carp (Linnaeus). Master´s Thesis of Northeast Agricultural University, 2007 [王琨. 氨氮对鲤(Linnaeus)幼鱼部分组织及血液指标的影响. 东北农业大学硕士研究生学位论文, 2007]
Wang MY. The effect of acute cold stress and recovery on the serum biochemical, immune indices and HSP70 gene expression in the tissues of gift strain nile tilapia (). Master´s Thesis of Nanjing Agricultural University, 2009 [王美垚. 急性低温胁迫及恢复对吉富罗非鱼血清生化、免疫以及应急蛋白HSP70基因表达的影响. 南京农业大学硕士研究生学位论文, 2009]
Wang ZJ, Chen SQ, Cao DZ,. Effects of acute ammonia nitrogen stress on histopathology of gill and liver and enzyme activities of juvenile. Progress in Fishery Sciences, 2017, 38(2): 59–69 [王贞杰, 陈四清, 曹栋正, 等. 急性氨氮胁迫对圆斑星鲽()幼鱼鳃和肝组织结构及相关酶活性的影响. 渔业科学进展, 2017, 38(2): 59–69]
Weihrauch D, Wilkie MP, Walsh PJ. Ammonia and urea transporters in gills of fish and aquatic crustaceans. The Journal of Experimental Biology, 2009, 212(11): 1716–1730
Ye JD, Wang K, Chang JB. Effects of ammonia exposure on superoxide dismutase actives and malondialdehyde contents in liver of juvenile. Chinese Journal of Fisheries, 2007, 20(1): 9–13 [叶继丹, 王琨, 常建波. 氨氮对牙鲆幼鱼肝中超氧化物歧化酶活性及脂质过氧化物含量的影响. 水产学杂志, 2007, 20(1): 9–13]
Zhang MZ, Li M, Wang RX,. Effects of acute ammonia toxicity on oxidative stress, immune response and apoptosis of juvenile yellow catfishand the mitigation of exogenous taurine. Fish and Shellfish Immunology, 2018, 79: 313–320
Zhao HT. Effcts of ammonia on haematological and immune parameters of juvenile southern catfish (Chen). Master´s Thesis of Southwest University, 2006 [赵海涛. 氨氮对南方鲶(Chen)幼鱼血液生理、生化及非特异性免疫指标的影响. 西南大学硕士研究生学位论文, 2006]
Zhou X. Physiological response to stress of nitrite, ammonia and temperature in grass carp,]. Master´s Thesis of Ocean University of China, 2012 [周鑫. 草鱼()对亚硝酸氮、氨氮和温度胁迫的生理响应. 中国海洋大学硕士研究生学位论文, 2012]
Toxic Effects of Acute Ammonia Stress on Young Turbot
MENG Zhen1, ZHANG Hongli2, LIU Xinfu1①, JIANG Yong3, JIA Yudong1,LIU Bin1, QU Jiangbo4, XU Rongjing4
(1.Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Key Laboratory of Sustainable Development of Polar Fisheries, Ministry of Agriculture and Rural Affairs; Pilot National Laboratory for Marine Science and Technology (Qingdao), Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao 266071; 2. Research Center for Harmful Algal and Marine Biology of Jinan University, Guangzhou 510632; 3. National Oceanographic Center, Qingdao 266071; 4. Tianyuan Aquaculture Co., Ltd of Yantai Economic Development Zone, Yantai 264006)
Ammonia can easily form in intensive culture systems due to the ammonification of uneaten food and animal excretions, and usually results in detrimental health effects to teleost. The aim of this study was to provide a reference value for the safe regulation and control of ammonia in the aquaculture of turbot,, and obtain the corresponding biomarkers of blood physiological indexes under acute ammonia stress. The acute toxicity effects of ammonia on young turbot [average body weight (163.90±15.31) g] were studied with a 96 h half-static toxicity test. The effects of different ammonia concentrations and exposure times on plasma physiological indexes were determined. The results showed that the semi-lethal concentration (LC50) of total ammonia (TAN) and non-ionic ammonia (NH3-N) for 96 h were 39.73 mg/L and 0.64 mg/L, respectively, when the sea water temperature was (19.0±0.5)℃, pH value 7.85, salinity 29.5, and dissolved oxygen (7.8±0.2) mg/L. The plasma epinephrine (EPI), cortisol (cortisol), superoxide dismutase (SOD), reduced glutathione (GSH), alkaline phosphatase (AKP), and blood glucose (GLU) contents or activities were significantly affected by both the ammonia concentration and exposure time. Furthermore, the interaction between ammonia concentration and exposure time also significantly impacted these indexes. The response time of plasma EPI, SOD, GSH, AKP, and GLU advanced with the increasing of ammonia concentration, while EPI, cortisol, AKP, and GLU showed a trend of increasing first and then decreasing with prolonged exposure. These plasma physiological indexes can be used as biomarkers for acute ammonia toxicity. The plasma physiological responses of the high concentration toxic group were characterized by their plasma SOD and GSH rapidly increasing over the exposure period (within 12 h), and GLU rapidly increased at 4 h and decreased sharply before death. The results suggested that the death of juveniles under acute ammonia toxicity may be due to oxidative stress, physiological metabolic disorders, and impaired respiratory function.
; Acute ammonia toxicity; Plasma physiological indexes
S949
A
2095-9869(2020)02-0051-10
刘新富,研究员,E-mail: liuxf@ysfri.ac.cn
2019-01-15,
2019-03-18
* 中国水产科学研究院中央级公益性科研院所基本科研业务费专项(2016HY-ZD1402)和山东省重大科技创新工程项目(2018YFJH0703; 2018SDKJ0303)共同资助[This work was supported by the Central Public-Interest Scientific Institution Basal Research Fund, CAFS (2016HY-ZD1402),and Major Science and Technology Innovation Projects of Shandong Province (2018YFJH0703; 2018SDKJ0303)]. 孟 振,E-mail: mengzhen@ysfri.ac.cn
10.19663/j.issn2095-9869.20190115003
http://www.yykxjz.cn/
孟振, 张鸿丽, 刘新富, 姜勇, 贾玉东, 刘滨, 曲江波, 徐荣静. 氨氮急性胁迫对大菱鲆幼鱼的毒性效应. 渔业科学进展, 2020, 41(2): 51–60
Meng Z, Zhang HL, Liu XF, Jiang Y, Jia YD, Liu B, Qu JB, Xu RJ. Toxic effects of acute ammonia stress on young turbot. Progress in Fishery Sciences, 2020, 41(2): 51–60
LIU Xinfu, Email: liuxf@ysfri.ac.cn
(编辑 陈 辉)

