猪源IKKγ在原核和真核表达系统中的表达及其多克隆抗体制备
赵祥秀 黄茂发 高跃美 唐榕泽 胡仁俊 梁晶晶 李晓宁 罗廷荣

摘要:【目的】制备猪源IKKγ多克隆抗体,为进一步研究IKKγ蛋白生物学特性及揭示IKKγ蛋白与猪瘟病毒(CSFV)间相互作用机制打下基础。【方法】利用RT-PCR从猪肾细胞(PK-15)中克隆原核表达的IKKγ基因功能片段(561 bp),与原核表达载体pET-32a(+)构建原核重组质粒pET-IKKγ,转化大肠杆菌BL21(DE3)感受态细胞后进行IPTG诱导表达,表达的融合蛋白经纯化和浓缩后,免疫小鼠制备猪源IKKγ多克隆抗体。同时克隆IKKγ基因全长序列(1356 bp),与真核表达载体pCMV-HA构建真核重组质粒pCMV-HA-IKKγ,分别转染293T细胞和PK-15細胞,检测融合蛋白表达情况。【结果】以原核重组质粒pET-IKKγ转化BL21感受态细胞,经IPTG诱导能表达出约40 kD的融合蛋白,且融合蛋白主要以可溶性蛋白形式进行表达,可通过Ni-NTA亲和层析柱进行纯化,已获得较高纯度的融合蛋白IKKγ。构建的真核重组质粒pCMV-HA-IKKγ能在293T细胞中成功表达出IKKγ蛋白;制备获得的猪源IKKγ多克隆抗体能与293T细胞表达融合蛋白IKKγ发生特异性反应,其抗体效价为1∶16000,与PK-15细胞表达IKKγ蛋白也具有良好的反应性,其中CSFV感染后36 h是IKKγ蛋白表达高峰期。此外,制备获得的猪源IKKγ多克隆抗体能在PK-15细胞中成功检测到IKKγ蛋白,说明猪源IKKγ多克隆抗体与真核细胞瞬时表达的IKKγ蛋白特异性良好。【结论】制备获得的猪源IKKγ多克隆抗体具有效价高、特异性强等特点,可用于检测CSFV感染PK-15细胞中IKKγ蛋白表达水平,为下一步研究IKKγ蛋白生物学特性及揭示NF-κB信号通路转录调节功能机制提供技术支持。
关键词: IKKγ;猪瘟病毒(CSFV);原核表达;真核表达;多克隆抗体
中图分类号: S852.43 文献标志码: A 文章编号:2095-1191(2020)12-3099-10
Abstract:【Objective】The preparation of polyclonal antibody against IKKγ from pigs would lay a foundation for further study on the biological characteristics of IKKγ protein and reveal the interaction mechanism between IKKγ protein and classical swine fever virus(CSFV). 【Method】The functional fragment of IKKγ gene(561 bp) was cloned from porcine kidney cells(PK-15) by RT-PCR. The recombinant plasmid pET-IKKγ was constructed with the prokaryotic expression vector pET-32a(+). The recombinant plasmid pET-IKKγ was transformed into Escherichia coli BL21(DE3) competent cells and expressed by IPTG induction. The expressed fusion protein was purified and concentrated, and then the polyclonal antibody of pig IKKγ was prepared by immunizing mice. At the same time, the full-length sequence of IKKγ gene(1356 bp) was cloned and the eukaryotic expression vector pCMV-HA was used to construct the eukaryotic recombinant plasmid pCMV-HA-IKKγ, which was transfected into 293T cells and PK-15 cells respectively to detect the expre-ssion of the fusion protein. 【Result】The prokaryotic recombinant plasmid pET-IKKγ was transformed into BL21 competent cells, and about 40 kD fusion protein was expressed after IPTG induction. The fusion protein was mainly expressed in the form of soluble protein, which could be purified by Ni-NTA affinity chromatography. High-purity fusion protein IKKγ was obtained. The recombinant plasmid pCMV-HA-IKKγ could successfully express IKKγ protein in 293T cells; the polyclonal antibody against porcine IKKγ could specifically react with the fusion protein IKKγ expressed in 293T cells, and the titer of the antibody was 1∶16000, which also had good reactivity with the IKKγ protein expressed in PK-15 cells. The peak of IKKγ protein expression was 36 h after CSFV infection. In addition, IKKγ protein was successfully detected in PK-15 cells by the polyclonal antibody against porcine IKKγ, which indicated that the polyclonal antibody against porcine IKKγ had good specificity with the IKKγ protein expressed in eukaryotic cells. 【Conclusion】The polyclonal antibody against IKKγ from pig has the characteristics of high titer and high specificity. It can be used to detect the expression level of IKKγ protein in PK-15 cells infected with CSFV, and provide technical support for further study on the biological cha-racteristics of IKKγ protein, the interaction between CSFV proteins and revealing the transcriptional regulation mechanism of NF-κB signaling pathway.
Key words: IKKγ; classical swine fever virus(CSFV); prokaryotic expression; eukaryotic expression; polyclonal antibody
Foundation item: National Natural Science Foundation of China(31660722); National Key Research and Development Program of China (2018YFD0500104); Guangxi Natural Science Foundation (2017GXNSFAA198137)
0 引言
【研究意义】IκB(Inhibitor of NF-κB)家族包括IκBα、IκBβ和IκBγ等3个成员,IκB蛋白包含一系列的锚蛋白重复序列,可与NF-κB结合;且在正常状态下,NF-κB与IκB结合的复合体存在于细胞质中,处于未激活状态(Isra?l,2000)。IκB激酶家族(Inhibitor of NF-κB kinases,IKKs)作为核因子Kappa B信号途径的关键成员,能解除IκB对NF-κB的抑制作用,激活参与应激反应、免疫细胞的增殖分化与凋亡及肿瘤形成等相关基因转录表达的调控(Péant et al.,2011;艾尼瓦尔·艾木都拉,2020)。IKK激酶复合体主要由2个高度同源的激酶亚基(IKKα/IKK1和IKKβ/IKK2)及1个调节亚基NEMO(NF-κB essential modulator)/IKKγ构成(Longa et al.,1989)。其中,IKKα和IKKβ在序列上有52%的相似性,且在催化基序内相似性可达65%;而IKKγ与IKKa和IKKβ无相似性(Ben-Neriah and Karin,2011)。IKKγ可形成稳定的二聚体,并与IKKs复合物的其他亚基相结合。IKKγ二聚体的形成及其与IKKs催化亚基的结合对NF-κB活化起关键作用(Li et al.,2011;Zaghloul et al.,2012),是研究病毒蛋白功能及病毒与宿主相互作用机理的理想辅助工具。因此,克隆猪源IKKγ基因并制备猪源IKKγ抗体,对揭示IKKγ蛋白生物学特性及NF-κB信号通路激活原理具有重要意义。【前人研究进展】NF-κB是一类重要的转录因子,能调控细胞因子、化学激活素、生长因子、细胞黏附分子及其他免疫相关蛋白的表达(康喜龙,2018)。作为调节亚基,IKKγ在NF-κB途径中被视为一种支架蛋白,能与多种分子相互作用。在脊椎动物中,NF-κB是调控各种刺激引起细胞凋亡反应的关键因素,是控制抗凋亡基因和促凋亡基因表达的主要转录因子之一(Kankaya et al.,2015)。IKKγ在IKK复合体中扮演着桥联IKKa和IKKβ与其上游激酶的作用(Li et al.,2003),当细胞因子(Cytokine)或病原体相关分子模式(Pathogen associated molecular patterns,PAMPs)刺激细胞表面的信号受体,如Toll样受体4(Toll 1ike receptor 4,TLR4)或肿瘤坏死因子受体1(Tumor necrosis factor receptor 1,TNFR1),即发生级联反应,进而激活IKK复合体。至今,虽然IKK激酶活化前的级联反应机制尚未明确,但与其他激酶类似,IKK激酶活化也需要磷酸化2个丝氨酸残基(IKKβ- Ser177和181;IKKα-Ser176和180)(Mercurio et al.,1997;Delhase,1999)。在IKK复合体作用下,IκB的第32位和第36位丝氨酸迅速被磷酸化,通过泛素化途径降解,NF-κB二聚体被释放出来,并转移至核内促进靶基因转录(Tergaonkar et al.,2005;Baker et al.,2011)。IKK激酶属于大型的多蛋白复合物,可调节转录因子NF-κB活化,且涉及多种生物学过程,包括先天免疫、炎症及生长发育等(Priyathilaka et al.,2020)。已有研究表明,marc-145细胞感染蓝耳病病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)后,IKKγ基因及其蛋白水平均上调,进一步说明NF-κB信号通路被激活,IKKγ基因参与抗PRRSV免疫(段马魁等,2018)。IKKγ与IKKα和IKKβ结合,以维持IKK激酶复合体的空间构型,且IKKγ在IKK激酶复合体的活化过程中发挥信息传递作用(Yamaoka et al.,1998),因此IKKγ是研究NF-κB机制的重要靶标(Song et al.,2005)。【本研究切入點】目前,针对人类及鼠等生物的IKKγ已得到深入研究,有关于猪IKKγ的研究则相对较少。研究猪体内IKKγ蛋白在病毒感染过程中的相互作用,需要应用猪源IKKγ抗体,但目前全世界的生物制品市场中尚缺乏该抗体。【拟解决的关键问题】克隆NF-κB信号通路转录途径中的IKKγ基因,经大肠杆菌BL21原核表达获得融合蛋白并免疫昆明小鼠以获得效价高且特异性强的多克隆抗体,为进一步研究IKKγ蛋白生物学特性及揭示IKKγ蛋白与猪瘟病毒(Classical swine fever virus,CSFV)间相互作用机制打下基础。
1 材料与方法
1. 1 试验材料
猪瘟病毒石门株(Shimen strain)、大肠杆菌(DH5α和BL21)、原核表达载体pET-32a(+)、真核表达载体pCMV-HA及氨苄青霉素均由亚热带农业生物资源保护利用国家重点实验室保存提供。4周龄昆明小白鼠购自广西医科大学实验动物中心。pMD18-T载体、M-MLV反转录酶系统、DNA Extraction Kit、LA培养基、LB培养基、细胞培养基DMEM、胎牛血清、蛋白纯化试剂、佛氏佐剂及质粒抽提试剂盒购自TaKaRa公司;Prime STAR高保真聚合酶、马抗小鼠绿色荧光二抗、脂质体2000转染试剂盒、限制性内切酶、T4 DNA连接酶、Taq DNA聚合酶及Ni-NTA亲和树脂购自天根生化科技(北京)有限公司;胶回收试剂盒Gel Extraction Kit、抗HA标签鼠源单克隆抗体及抗His标签鼠源单克隆抗体购自康为世纪生物科技有限公司;免疫荧光染色试剂盒—抗小鼠Alexa Fluor 488和BCIP/NBT碱性磷酸酯酶显示试剂盒购自上海碧云天生物技术有限公司。
1. 2 引物设计与合成
1. 2. 1 原核表达引物设计 参照GenBank已公布的IKKγ基因序列(XM_005674035),采用Oligo 7.0设计引物,原核表达载体的上、下游引物分别插入EcoR I和Not I酶切位点,引物委托广州华大生物技术有限公司合成。其中,上游引物IKKγ-561-E:5'-GAATTCGAGCAGGGTGCTCCTGAG-3'(下划线为EcoR I酶切位点);下游引物IKKγ-561-N:5'-GCGG CCGCCAGCTGGGCCAGCTTCCG-3'(下划线为Not I酶切位点),扩增目的片段大小561 bp。
1. 2. 2 真核表达引物设计 参照1.2.1引物设计步骤设计真核表达引物,分别插入EcoR I和Not I酶切位点,引物委托广州华大生物技术有限公司合成。其中,上游引物IKKγ-1356-E:5'-GAATTCGGGCCAC CATGCCGCCGCCGGAGAGAC-3'(下划线为EcoR I酶切位点);下游引物IKKγ-1356-N:5'-GCGGCCG CCTACTCGATACACTCCATG-3'(下划线为Not I酶切位点),扩增目的片段大小1356 bp。
1. 3 克隆载体构建
1. 3. 1 原核表达载体构建 IKKγ基因RT-PCR扩增:取猪肾细胞(PK-15)总RNA进行反转录,以反转录获得的cDNA为模板,参照Prime STAR高保真聚合酶使用说明进行PCR扩增。反应体系50.0 μL:cDNA模板3.0 μL,Prime STAR 25.0 μL,IKKγ-561-E和IKKγ-561-N各1.0 μL,ddH2O补至50.0 μL。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 15 s,进行34个循环;72 ℃延伸10 min。PCR扩增产物采用1%琼脂糖凝胶电泳进行检测,然后按Gel Extraction Kit说明进行胶回收,将胶回收产物连接至pMD18-T载体上,转化DH5α感受态细胞,挑取多个单克隆液体培养,经菌液PCR鉴定,挑选阳性菌液送至广州华大生物技术有限公司测序验证,验证成功的阳性质粒与原核表达载体用EcoR I和Not I进行双酶切,在T4连接酶作用下与原核表达载体pET-32a(+)连接过夜(16 ℃),再转化DH5α感受态细胞进行扩大培养,抽提原核重组质粒用EcoR I和Not I进行酶切鉴定,阳性原核重组质粒送至广州华大生物技术有限公司测序验证。
1. 3. 2 真核表达载体构建 以1.3.1反转录获得的cDNA为模板,采用真核引物IKKγ-1356-E和IKKγ-1356-N进行PCR扩增,扩增片段经胶回收后克隆至pMD18-T载体上,并转化DH5α感受态细胞,菌液PCR鉴定,挑选阳性菌液送至广州华大生物技术有限公司测序验证,再克隆至真核表达载体pCMV-HA上,经EcoR I和Not I酶切鉴定后,将阳性重组质粒送至广州华大生物技术有限公司测序验证。
1. 4 融合蛋白表达
以原核重组质粒pET-IKKγ转化BL21(DE3)感受态细胞,挑取单克隆菌落接种于7 mL的LB培养基中过夜培养;然后按1∶100比例将上述菌液接种于30 mL的LB培养基中,并加入0.1 mmol/L IPTG进行诱导表达。分别取诱导前及诱导后6 h的菌液(2 mL)放入离心管中,12000 r/min离心5 min,弃上清液,利用PBS进行重悬,采用细胞破碎仪充分破碎,12000 r/min离心10 min。取上清液、沉淀及破碎的全菌液各100 μL置于不同的1.5 mL离心管中,加入1/5体积5×SDS的蛋白上样缓冲液,煮沸10 min变性处理后进行SDS-PAGE电泳,以空载质粒pET-32a(+)在BL21(DE3)感受态细胞中的诱导表达菌液为对照。
1. 5 融合蛋白纯化
由于融合蛋白IKKγ以可溶性蛋白形式表达为主,且目的蛋白含有抗His组氨酸标签,故采用Ni-NTA亲和层析柱纯化融合蛋白IKKγ。以含20和70 mmol/L咪唑的洗涤液及含250 mmol/L咪唑的洗脱液洗脱后,采用Ni-NTA亲和层析柱进行纯化。将纯化收集的上清液、穿透液和洗脫液等样品分别进行SDS-PAGE电泳,通过考马斯亮蓝染色分析;同时采用Western blotting检测分析纯化透析后的融合蛋白。Western blotting检测所用的一抗为抗His标签鼠源单克隆抗体,二抗为碱性磷酸酶标记的马抗小鼠IgG。
1. 6 免疫小鼠制备多克隆抗体
4周龄昆明小白鼠先饲养3~4 d以适应新环境,减少外部应激影响。将纯化融合蛋白IKKγ与佛氏佐剂乳化成油包水乳剂,通过小鼠背部皮下多点注射进行免疫,免疫程序按照1、7、21和42 d分4次进行免疫。首次免疫时,融合蛋白IKKγ与佛氏佐剂等体积混合乳化,其余免疫则与佛氏不完全佐剂等体积混合乳化,每只昆明小白鼠注射约500 μg的融合蛋白IKKγ。四免后第7 d进行昆明小白鼠眼球采血,分离血清即为制备的IKKγ多克隆抗体,按100 μL/管分装后-80 ℃保存备用。
1. 7 猪源IKKγ多克隆抗体特异性鉴定
按照脂质体2000转染试剂盒说明,以真核重组质粒pCMV-HA-IKKγ转染293T细胞,转染36 h后收集细胞总蛋白进行Western blotting检测。以1 MOI的CSFV感染80%单层培养的PK-15细胞,刺激其产生IKKγ蛋白,感染2 h后换成含3%血清的DMEM,分别在0、12、24、36和48 h后收集细胞总蛋白进行Western blotting检测;同时以真核表达载体pCMV-HA转染PK-15细胞,48 h后进行间接免疫荧光(IFA)检测,验证抗体特异性。
2 结果与分析
2. 1 IKKγ原核表达基因片段选择
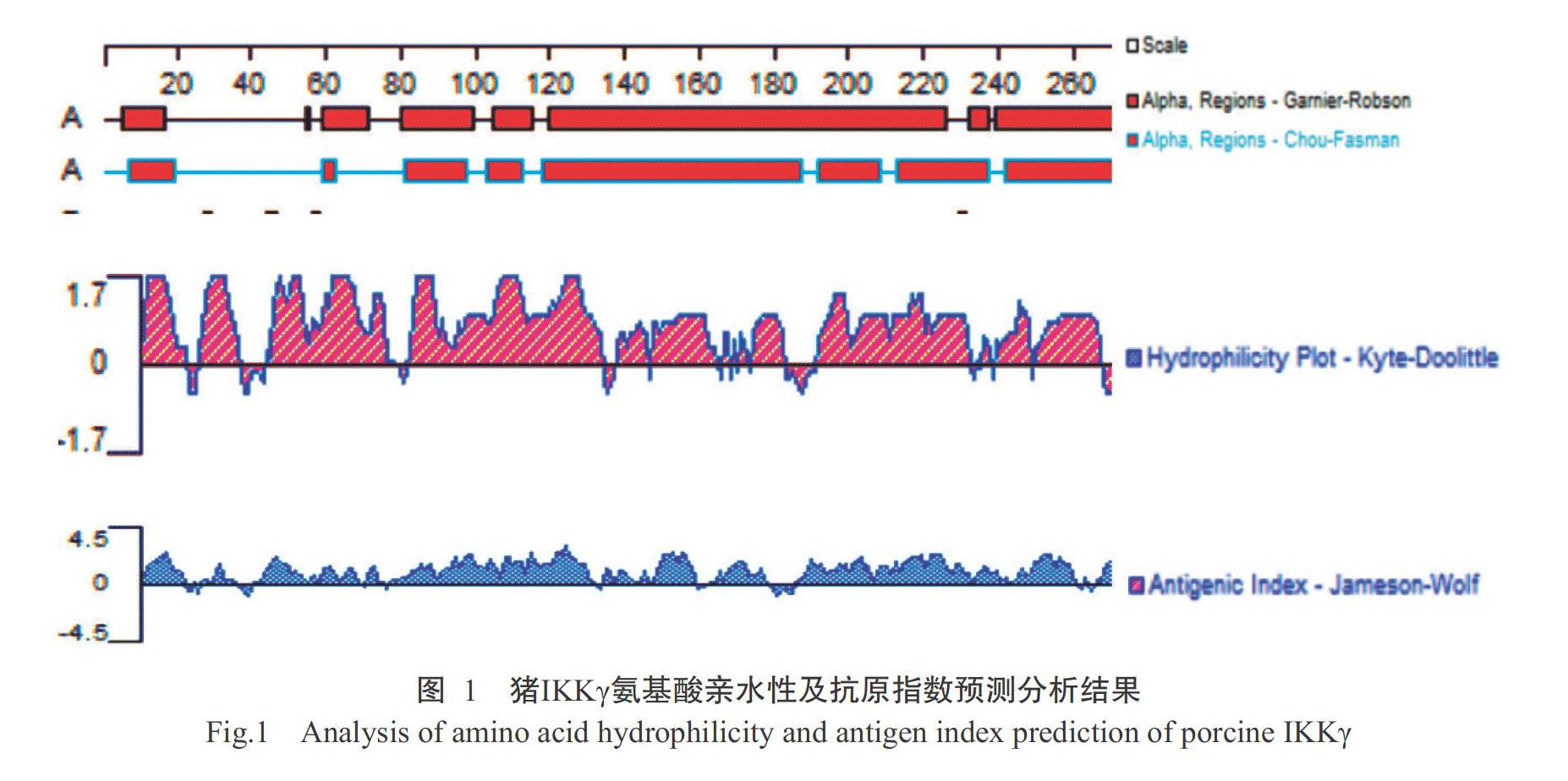
根据GenBank已公布的猪IKKγ基因序列,对猪IKKγ氨基酸亲水性及其抗原指数进行预测分析,结果(图1)显示,其核苷酸序列长度1356 bp,编码452个氨基酸残基。选取亲水性良好且具有线性表位氨基酸第76~263位点中的187个氨基酸残基作为目的蛋白,用于制备多克隆抗体。
2. 2 猪IKKγ基因片段扩增结果
采用原核表达引物IKKγ-561-E和IKKγ-561-N,通过RT-PCR扩增获得猪IKKγ基因片段561 bp(图2-A);而采用真核表达引物IKKγ-1356-E和IKKγ-1356-N,通过RT-PCR扩增获得猪IKKγ基因全长序列1356 bp(图2-B)。
2. 3 猪源IKKγ原核/真核表达载体构建情况
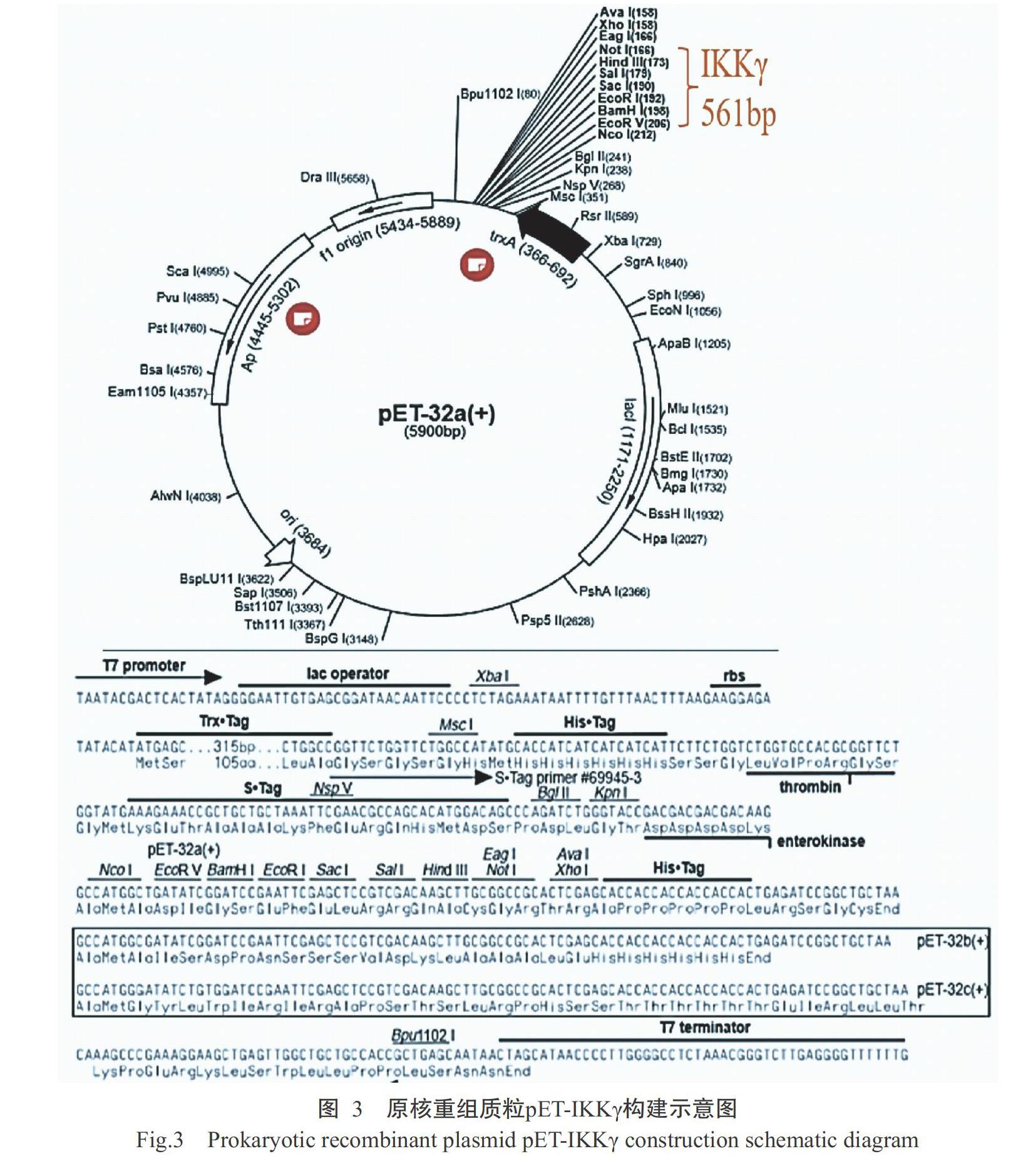
原核表达载体pET-32a(+)属于原核高效表达系统,由于携带His标签,Ni2+与6×His螯合后能将His标签特异性抗体结合至Ni-NTA纯化介质上,而未结合的蛋白被洗涤下来,从而获得高纯度的融合蛋白IKKγ。将IKKγ基因片段(561 bp)插入原核表达载体pET-32a(+)中的EcoR I和Not I多克隆位点,即成功构建获得原核重组质粒pET-IKKγ,具体构建流程如图3所示。
真核表达载体pCMV-HA属于真核高效表达系统,插入外源基因片段构建重组真核表达载体,转染哺乳动物细胞后即可诱导表达HA标记的融合蛋白,便于利用HA标签抗体对融合蛋白进行检测分析。将IKKγ基因全长序列(1356 bp)插入真核表达载体pCMV-HA的EcoR I和Not I多克隆位点,即成功构建获得真核重组质粒pCMV-HA-IKKγ,具体构建流程如图4所示。
2. 4 猪源IKKγ原核/真核表达载体鉴定结果
原核重组质粒pET-IKKγ和真核重组质粒pCMV-HA-IKKγ的双酶切鉴定结果如图5所示。其中,原核重组质粒pET-IKKγ经EcoR I、Not I双酶切后获得561 bp的IKKγ基因条带和5900 bp的原核表达载体pET-32a(+)条带;而真核重组质粒pCMV-HA-IKKγ经EcoR I、Not I双酶切后获得1356 bp的IKKγ基因条带和3800 bp的真表达载体pCMV-HA条带。
2. 5 猪源IKKγ基因原核诱导表达形式鉴定结果
将原核重组质粒pET-IKKγ转化BL21感受态细胞后,分别以含0.1 mmol/L IPTG和不含IPTG的LB培养基进行诱导表达,诱导6 h后各取1 mL菌液进行超声波破碎裂解,收集总菌液、上清液和沉淀进行SDS-PAGE电泳检测及考马斯亮蓝染色。结果(图6)显示,重组菌体经IPTG诱导能表达出约40 kD的融合蛋白,且融合蛋白主要以可溶性蛋白形式进行表达。
2. 6 融合蛋白纯化与鉴定结果
将Ni-NTA亲和层析纯化收集的上清液、穿透液、2次洗涤液及5次蛋白洗脱液分别进行SDS-PAGE电泳检测,结果表明,融合蛋白与Ni-NTA亲和层析柱结合良好;含70 mmol/L咪唑的洗涤液可洗涤掉部分杂蛋白,达到洗涤目的;含250 mmol/L咪唑的洗脱液可洗脱全部目的蛋白(图7-A)。Western blotting鉴定结果显示,在40 kD处有1条清晰的目的条带(图7-B),说明成功获得较高纯度的融合蛋白IKKγ。
2. 7 猪源IKKγ基因真核表达效果
以1∶1000稀释的抗HA标签鼠源单克隆抗体为一抗,采用Western blotting检测真核重组质粒pCMV-HA-IKKγ转染293T细胞中融合蛋白IKKγ的表达情况,结果(图8)显示,构建的真核重组质粒pCMV-HA-IKKγ能在293T细胞中成功表达出IKKγ蛋白。
2. 8 猪源IKKγ多克隆抗体效价检测结果
收集真核重组质粒pCMV-HA-IKKγ转染293T细胞后表达的融合蛋白样品,分别用1∶2000、1∶4000、1∶8000和1∶16000稀释的猪源IKKγ多克隆抗体与其进行Western blotting检测分析,结果(图9)表明,猪源IKKγ多克隆抗体可与293T细胞表达融合蛋白IKKγ发生特异性反应,其抗体效价为1∶16000。
2. 9 猪源IKKγ多克隆抗体特异性检测结果
采用Western blotting检测猪源IKKγ多克隆抗体与纯化后的融合蛋白IKKγ是否发生反应,结果(图10-A)显示猪源IKKγ多克隆抗体的特异性良好。收集CSFV诱导PK-15细胞产生的IKKγ蛋白进行Wes-tern blotting,结果表明,猪源IKKγ多克隆抗体与PK-15细胞表达的IKKγ蛋白反应性良好,其中CSFV感染后36 h是IKKγ蛋白表达高峰期(图10-B)。可见,制备获得的猪源IKKγ多克隆抗体反应性良好。
2. 10 猪源IKKγ多克隆抗体与PK-15细胞表达IKKγ蛋白的反应性
真核重组质粒pCMV-HA-IKKγ瞬时转染PK-15细胞48 h后,以1∶300稀释的猪源IKKγ多克隆抗体为一抗,采用间接免疫荧光试验(IFA)检测真核重组质粒pCMV-HA-IKKγ在PK-15细胞中的表达情况,结果显示,制备的猪源IKKγ多克隆抗体能在PK-15细胞中成功检测到IKKγ蛋白(图11),说明制备获得的猪源IKKγ多克隆抗体与真核细胞瞬时表达的IKKγ蛋白反应性良好。
3 讨论
猪源IKKγ是一个由452个氨基酸残基组成的具有调节作用的亚基蛋白,虽然其本身不具催化作用,但IKK激酶复合体活性依赖于IKKγ亚单位的完整性。IKKγ与IKK激酶复合体的2个催化亚基(IKKα和IKKβ)在结构上并无同源性(Ishrat et al.,2012)。真核细胞核转录因子Rel/NF-κB家族广泛存在于从昆虫到人类的细胞中,主要参与细胞的分化、发育、凋亡、黏附及炎症反应。NF-κB通过与抑制分子IκB相互作用,在细胞质中保持非活性状态,尤其在炎症细胞因子、细菌脂多糖、病毒感染或應激等多种刺激下,IκB在2个关键丝氨酸残基上发生磷酸化,且这种修饰可通过蛋白酶体降解机制进行识别及破坏(Karin and Ben-Neriah,2000)。因此,游离的NF-κB进入细胞核后,激活参与免疫和炎症反应、细胞黏附、生长控制或防止凋亡等基因转录水平(Goto et al.,2018)。IKK激酶复合体是NF-κB的上游激酶,其激活方式为刺激依赖性,不同的上游信号激活特异IKK激酶复合体,且可能存在不同的受体及受体附近复合物等信号分子参与。如IL-1R和RIG-1均通过TRAF6将信号传给IKK激酶复合体,但在其附近存在各自不同的受体接头复合物,包括MyD88和MAVS(Hayden and Ghosh,2008)。
目前,制备多克隆抗体过程中高效表达目的蛋白最常用的原核表达系统是pET-32a(+),具有简单、经济、高效等特点(杨忠东和何成,2011),能在短期内获得大量的目的蛋白特异性抗体(耿抒贤等,2020)。本研究的预试验选用原核表达载体pGEX-4T-1,与原核表达载体pET-32a(+)相比,二者的多克隆酶切位点、自带标签及载体大小均不相同。原核表达载体pGEX-4T-1自带GST标签,与IKKγ重组构建的原核重组质粒pGEX-4T-1-IKKγ转化BL21(DE3)感受态细胞后,融合蛋白的表达量较低,甚至出现不表达情况,且诱导表达的最适条件难以掌控,蛋白表达量未能达到免疫量要求。选用原核表达载体pET-32a(+)制备猪源IKKγ多克隆抗体的优势在于:(1)可制备获得良好的免疫原蛋白,作为免疫原免疫小鼠;(2)免疫原的线性表位直接影响多克隆抗体的反应性、特异性、亲/疏水性(尹珊,2013)。本研究通过多次摸索不同温度梯度及IPTG诱导浓度,最终确定在30 ℃及IPTG终浓度为0.1 mmol/L的条件下诱导表达的可溶性蛋白浓度较高。虽然融合蛋白在低温与低IPTG浓度条件下表达速度较慢,但更有利于其空间结构的正确折叠,更好地保留IKKγ蛋白的免疫原性。
抗体制备是研究目的基因转录和表达特性、蛋白间相互作用、蛋白亚细胞定位及蛋白生物学功能的基础工作(Wootla et al.,2014)。本研究制备获得的猪源IKKγ多克隆抗体具有较高亲和性,包含多个线性表位,可与多个抗原决定簇结合,可用于检测293T细胞或PK-15细胞的外源性和内源性IKKγ蛋白水平,即猪源IKKγ多克隆抗体具有良好的反应性和较强的特异性。Western blotting检测结果表明,IKKγ蛋白在CSFV感染PK-15细胞中的表达水平较在正常PK-15细胞中的表达水平明显上升,IKKγ蛋白可能在与CSFV蛋白互作过程中发挥重要作用。可见,利用制备获得的猪源IKKγ多克隆抗体有助于进一步拓展IKKγ蛋白生物学特性及NF-κB信号通路调节机制研究。
4 结论
制备获得的猪源IKKγ多克隆抗体具有效价高、特异性强等特点,可用于检测CSFV感染PK-15细胞中IKKγ蛋白表达水平,为下一步研究IKKγ蛋白生物学特性及揭示NF-κB信号通路转录调节功能机制提供技术支持。
参考文献:
艾尼瓦尔·艾木都拉,杨颖,张瑞丽,胡尔西旦·那斯尔. 2020. 肾癌中PPARα通过IKK改变NF-κB信号通路活性的实验研究[J]. 现代肿瘤医学,28(10):1615-1619. [Aniwar·Aimdullah,Yang Y,Zhang R L,Huerxidan·Nasir. 2020. PPARα modulate NF-κB passway by IKK activation in renal cell carcinoma[J]. Modern Oncology,28(10):1615-1619.]
段马魁,姜芳,陶佳丽,张亮,范阔海,姜俊兵. 2018. PRRSV感染对Marc-145细胞IKKγ基因表达水平的影响[J]. 畜牧与兽医,50(5):93-96. [Duan M K,Jiang F,Tao J L,Zhang L,Fan K H,Jiang J B. 2018. Effect of PRRSV infection on expression of the IKKγ gene of Marc-145 cells[J]. Animal Husbandry and Veterinary Medicine,50(5):93-96.]
耿抒贤,刘果,张娜,刘旻翾,燕苗苗,金丽,曾巧英,刘光亮. 2020. NF-κB受体激活因子配体的表达及其多克隆抗体的制备[J]. 中国兽医科学,50(4):473-478. [Geng S X,Liu G,Zhang N,Liu M X,Yan M M,Jin L,Zeng Q Y,Liu G L. 2020. Expression of porcine receptor activator for nuclear factor-κB ligand in Escherichia coli and pre-paration of its polyclonal antibody[J]. Chinese Veterinary Science,50(4):473-478.]
康喜龙. 2018. MicroRNA-5112靶向IKKγ调控NF-κB炎性通路的功能研究[D]. 扬州:扬州大学. [Kang X L. 2018. MicroRNA-5112 targets IKKγ to regulate NF-κB-media-ted inflammatory response[D]. Yangzhou:Yangzhou University.]
杨忠东,何成. 2011. NF-κB受体激活因子配体在大肠杆菌中的表达、纯化及其活性[J]. 中国生物制品学杂志,24(12):1385-1390. [Yang Z D,He C. 2011. Expression of receptor activator of NF-κB ligand in E. coli and purification and activity of expressed product[J]. Chinese Journal of Biologicals,24(12):1385-1390.]
尹珊. 2013. 豬瘟病毒Erns、NS4A、NS4B、NS5A蛋白的原核表达及多克隆抗体的制备[D]. 南宁:广西大学. [Yin S. 2013. Prokaryotic expression of Erns,NS4A,NS4B and NS5A proteins of CSFV and preparation of the polyclonal antibodies[D]. Nanning:Guangxi University.]
Baker R G,Hayden M S,Ghosh S. 2011. NF-kappa B,inflammation,and metabolic disease[J]. Cell Metabolism,13(1):11-22.
Ben-Neriah Y,Karin M. 2011. Inflammation meets cancer,with NF-κB as the matchmaker[J]. Nature Immunology,12(8):715-723.
Delhase M,Hayakawa M,Chen Y,Karin M. 1999. Positive and negative regulation of IkappaB kinase activity through IKKbeta subunit phosphorylation[J]. Science,284(5412):309-313.
Goto A,Okado K,Martins N,Cai H,Barbier V,Lamiable O,Troxler L,Santiago E,Kuhn L,Paik D,Silverman N,Holleufer A,Hartmann R,Liu J Y,Peng T,Hoffmann J A,Meignin C,Daeffler L,Imler J L. 2018. The kinase IKKβ regulates a STING and NF-κB dependent antiviral response pathway in drosophila[J]. Immunity,49(2):225-234.
Hayden M S,Ghosh S. 2008. Shared principles in NF-kappa B signaling[J]. Cell,132(3):344-362.
Ishrat T,Sayeed I,Atif F,Hua F,Stein D G. 2012. Progeste-rone is neuroprotective against ischemic brain injury through its effects on the phosphoinositide 3-kinase/protein kinase B signaling pathway[J]. Neuroscience,210:442-450.
Isra?l A. 2000. The IKK complex:An integrator of all signals that activate NF-kappaB?[J]. Trends in Cell Biology,10(4):129-133.
Kankaya D,Kiremitci S,Tulunay O,Baltaci S. 2015. Gelsolin,NF-κB,and p53 expression in clear cell renal cell carcinoma:Impact on outcome[J]. Pathology,Research and Practice,211(7):505-512.
Karin M,Ben-Neriah Y. 2000. Phosphorylation meets ubiquitination:The control of NF-κB activity[J]. Annual Review of Immunology,18:621-663.
Li J,Che Y Q,Diao Y,Hou S,Wang Y Y. 2011. Occlusion of middle cerebral artery induces apoptosis of cerebellar cortex neural cells via caspase-3 in rats[J]. Turkish Neurosurgery,21(4):567-574.
Li Z W,Omori S A,Labuda T,Karin M,Rickert R C. 2003. IKK is required for peripheral B cell survival and proli-feration[J]. Journal of Immunology,170(9):4630-4637.
Longa E Z,Weinstein P R,Carlson S,Cummins R. 1989. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,20(1):84-91.
Mercurio F,Zhu H,Murray B W,Shevchenko A,Bennett B L,Li J,Young D B,Barbosa M,Mann M,Manning A,Rao A. 1997. IKK-1 and IKK-2:Cytokine-activated Ikappa B kinases essential for NF-kappa B activation[J]. Science,278(5339):860-866.
Péant B,Forest V,Trudeau V,Latour M,Mes-Masson A M,Saad F. 2011. IκB-Kinase-ε(IKKε/IKKi/IκBKε) expre-ssion and localization in prostate cancer tissues[J]. The Prostate,71(10):1131-1138.
Priyathilaka T T,Bathige S D N K,Lee S,Yang H,Jeong T,Lee S,Lee J. 2020. Structural and functional analysis of three Iκb kinases(IKK) in disk abalone(Haliotis discus discus):Investigating their role in the innate immune responses[J]. Fish and Shellfish Immunology,103:111-125.
Song Y S,Lee Y S,Chan P H. 2005. Oxidative stress transiently decreases the IKK complex(IKKalpha,beta,and gamma),an upstream component of NF-κB signaling,after transient focal cerebral ischemia in mice[J]. Journal of Cerebral Blood Flow and Metablism,25(10):1301-1311.
Tergaonkar V,Correa R G,Ikawa M,Verma I M. 2005. Distinct roles of IκB proteins in regulating constitutive NF-κB activity[J]. Nature Cell Biology,7(9):921-923.
Wootla B,Denic A,Rodriguez M. 2014. Polyclonal and monoclonal antibodies in clinic[J]. Methods in Molecular Bio-logy,1060:79-110.
Yamaoka S,Courtois G,Bessia C,Whiteside S T,Weil R,Agou F,Kirk H E,Kay R J,A Isra?l. 1998. Complementation cloning of NEMO,a component of the IkappaB kinase complex essential for NF-κB activation[J]. Cell,93(7):1231-1240.
Zaghloul N,Nasim M,Patel H,Codipilly C,Marambaud P,Dewey S,Schiffer W K,Ahmed M. 2012. Overexpression of extracellular superoxide dismutase has a protective role against hyperoxia-induced brain injury in neonatal mice[J]. The FEBS Journal,279(5):871-881.
(責任编辑 兰宗宝)

