黑果腺肋花楸花色苷微胶囊化的研究
唐璐,李延辉,薛晓丽
(1.吉林农业科技学院食品工程学院,吉林吉林132101;2.吉林农业大学食品科学与工程学院,吉林长春130118;3.吉林农业科技学院实验中心,吉林吉林132101)
黑果花楸是黑果腺肋花楸 [Aronia melanocarpa(Michx.)Elliott]的俗称,系蔷薇科多年生落叶灌木[1]。果实及其提取物对心脏病和高血压等心脑血管疾病具有特殊疗效,被广泛应用于欧美国家的医药和功能性食品工业[2-6]。成熟的果实色深,富含花色苷、多酚、类黄酮等营养成分,其中花色苷含量达到酚类化合物25%左右[7-8],高于黄酮和酚酸的含量[9]。微胶囊是一种能包埋和保护某些物质的具有聚合物壁壳的半透性或密封的微型“容器”或“包装物[10-12]。微胶囊技术可以增加芯材稳定性,控制芯材释放[13]。目前,国内外食品工业中微胶囊应用广泛,对香精香料进行微胶囊化是为了保护原材料,在食品中已出现粉末油脂,例如方便汤料、冷食品、糕点等已取得较多成果[14-16]。
本研究采用喷雾干燥法制备黑果腺肋花楸花色苷微胶囊,以花色苷包埋率为指标,壁材选择、壁芯质量比、入口温度、进料量为影响因素进行单因素试验研究,并在单因素基础上进行正交试验,得出最佳工艺条件。以期为其花色苷微胶囊表征和稳定性的研究提供理论依据。
1 材料与方法
1.1 主要仪器与设备
LC-20AD 高效液相色谱仪:日本岛津仪器有限公司;R-210 旋转蒸发仪、B-290 瑞士步琪喷雾干燥器:瑞士步琪仪器有限公司;HH-S4 恒温水浴锅:山东博科科学仪器有限;AL204 电子天平:梅特勒-托利多仪器有限公司;SHJ-1AB 磁力搅拌水浴锅:常州金坛良友仪器有限公司;5430R 离心机:深圳市科力易翔仪器设备有限;XL-30 扫描电子显微镜:荷兰Philips-FEI仪器有限公司。
1.2 材料与试剂
黑果花楸鲜果:辽宁富康源黑果花楸科技开发有限公司。矢车菊素-3-半乳糖苷、矢车菊素-3-葡萄糖苷、矢车菊素-3-阿拉伯糖苷对照品:上海回程生物科技有限公司;甲醇(色谱纯)、乙腈(色谱纯):长沙科宁兴业生物科技有限公司;磷酸、乙醇、柠檬酸三钠、柠檬酸均为分析纯:天津市光复科技发展有限公司;麦芽糊精、壳聚糖、β-环糊精:北京奥博星生物技术有限责任公司;海藻酸钠、阿拉伯树胶粉:天津市永大化学试剂有限公司。
1.3 试验方法
1.3.1 工艺流程及花色苷制备
工艺流程:壁材水溶液→加入芯材(按一定比例)→磁力搅拌→喷雾干燥→微胶囊成品→计算包埋率。
黑果腺肋花楸花色苷制备:黑果腺肋花楸花色苷由乙醇浸提,并经XAD-7 大孔树脂纯化后得到。
1.3.2 喷雾干燥单因素试验
以花色苷包埋率为指标,壁材选择、芯壁质量比、入口温度、进料量为影响因素进行单因素试验。
1.3.2.1 壁材选择对黑果腺肋花楸花色苷微胶囊化的影响
以芯壁质量比2 ∶8、入口温度120 ℃、进料量15 mL/min,壁材分别是阿拉伯胶、麦芽糊精、阿拉伯胶/麦芽糊精(2 ∶3,质量比)、阿拉伯胶/β-环糊精(2 ∶3,质量比)、阿拉伯胶/壳聚糖(2 ∶3,质量比)条件下进行喷雾干燥,计算包埋率。
1.3.2.2 芯壁质量比对黑果腺肋花楸花色苷微胶囊化的影响
以阿拉伯胶/麦芽糊精(2 ∶3,质量比)为壁材、入口温度 120 ℃、进料量 15 mL/min,芯壁质量比 1 ∶9、2 ∶8、3 ∶7、4 ∶6、5 ∶5 条件下进行喷雾干燥,计算包埋率。
1.3.2.3 入口温度对黑果腺肋花楸花色苷微胶囊化的影响
以阿拉伯胶/麦芽糊精(2 ∶3,质量比)为壁材、芯壁质量比2 ∶8、进料量15 mL/min,入口温度分别为100、110、120、130、140 ℃条件下进行喷雾干燥,计算包埋率。
1.3.2.4 进料量对黑果腺肋花楸花色苷微胶囊化的影响
以阿拉伯胶/麦芽糊精(2 ∶3,质量比)为壁材、芯壁质量比2 ∶8、入口温度120 ℃、进料量分别为9、12、15、18、21 mL/min 条件下进行喷雾干燥,计算包埋率。
1.3.3 正交试验优化花色苷微胶囊
以芯壁质量比、入口温度、进料量为影响因素,花色苷微胶囊包埋率为指标,选择L9(33)正交试验对工艺参数进行优化设计,因素水平表见表1。

表1 因素水平表Table 1 Factors and levels table
1.3.4 标准曲线
矢车菊素-3-半乳糖苷、矢车菊素-3-葡萄糖苷、矢车菊素-3-阿拉伯糖苷分别配制成2.475、4.950、9.900、14.850、19.800 μg/mL,过 0.22 μm 滤膜,注入高效液相色谱 (high performance liquid chromatography,HPLC)仪,以浓度为x 轴,峰面积为y 轴绘制标准曲线。所得半乳糖苷线性方程为y=40 827.83x-12 152,R2=0.999 1;葡萄糖苷线性方程y=97 979.62x-185 967.2,R2=0.9990;阿拉伯糖苷线性方程y=44 659.91x+970 54.07,R2=0.998 1。
1.3.5 花色苷微胶囊包埋率公式

微胶囊产品表面花色苷含量测定:称取1.00 g 微胶囊花色苷,用体积分数95%的乙醇溶解,使微胶囊表面的花色苷完全溶解在溶液中,收集滤液定容至10 mL,用高效液相色谱测花色苷含量[17-18]。
微胶囊产品中总花色苷含量的测定:称取1.00 g微胶囊,pH 值为3.0 的柠檬酸-柠檬酸钠缓冲溶液溶解,收集滤液定容至10 mL,用高效液相色谱测花色苷含量[17-18]。
1.3.6 黑果腺肋花楸花色苷微胶囊的的表征
用电镜扫面观察黑果腺肋花楸花色苷微胶囊表面结构。
1.3.7 微胶囊化前后花色苷稳定性研究
对光照考察:取适量微胶囊化前后的黑果腺肋花楸花色苷溶液,在室温25 ℃条件下,每隔1 h 测其花色苷含量,计算保存率[19]。对不同温度的考察:取适量微胶囊化前后的黑果腺肋花楸花色苷溶液,在25、40、50、60、70、80、90 ℃条件下,2 h 后称取一定量各样品溶液测定其在花色苷含量,计算保存率。保存率的计算公式如下:

2 结果与分析
2.1 单因素试验结果
2.1.1 壁材选择对黑果腺肋花楸花色苷微胶囊化的影响
壁材选择对花色苷微胶囊化的影响结果见图1。

图1 壁材对花色苷微胶囊化的影响Fig.1 Effect of wall material on anthocyanin microencapsulation
由图 1 可知,以阿拉伯胶/麦芽糊精(2 ∶3,质量比)为壁材包埋率最高,阿拉伯胶是一种亲水性胶体[20-21],安全性较高、水溶性好和黏度较低,当阿拉伯胶与麦芽糊精进行复配时,能改善乳化性,提高膜的通透性[20-21],提高包埋率。
2.1.2 芯壁质量比对黑果腺肋花楸花色苷微胶囊化的影响
芯壁质量比对花色苷微胶囊化的影响结果见图2。
由图2 可知,芯壁质量比2 ∶8 包埋率最高,芯壁质量比越大超过了壁材的包埋限度,会使包埋率降低,芯壁质量比越小,相应花色苷含量也会变小,壁材过多会使黏度增加,导致粘壁,不会全部喷雾干燥,因此芯壁质量比2 ∶8 最适宜。
2.1.3 入口温度对黑果腺肋花楸花色苷微胶囊化的影响
入口温度对花色苷微胶囊化的影响结果见图3。

图2 芯壁质量比对花色苷微胶囊化的影响Fig.2 Effect of core wall mass ratio on anthocyanin microencapsulation

图3 入口温度对花色苷微胶囊化的影响Fig.3 Effect of inlet temperature on anthocyanin microencapsulation
由图3 可知,入口温度120 ℃时包埋效果最好,温度越高,芯材会分解;温度过低,微胶囊成膜速率会降低,不能全部成微胶囊。因此入口温度120 ℃是包埋率最高。
2.1.4 进料量对黑果腺肋花楸花色苷微胶囊化的影响
进料量对花色苷微胶囊化的影响结果见图4。

图4 进料量对花色苷微胶囊化的影响Fig.4 Effect of feed amount on anthocyanin microencapsulation
由图4 可知,进料量15 mL/min 时包埋率最高,进料流量较小时,物料受热时间长,导致在干燥过程中损失较严重,从而影响微胶囊包埋的效率。当进料流量增大到一定程度时,在雾化器转速不变的情况下,液滴与热空气的能量交换达到平衡[22-23],此时花色苷微胶囊的包埋率最高。因此,选择进料流量15 mL/min进行试验。
2.2 正交试验结果与分析
2.2.1 优化试验结果极差分析
花色苷微胶囊包埋正交试验结果见表2。
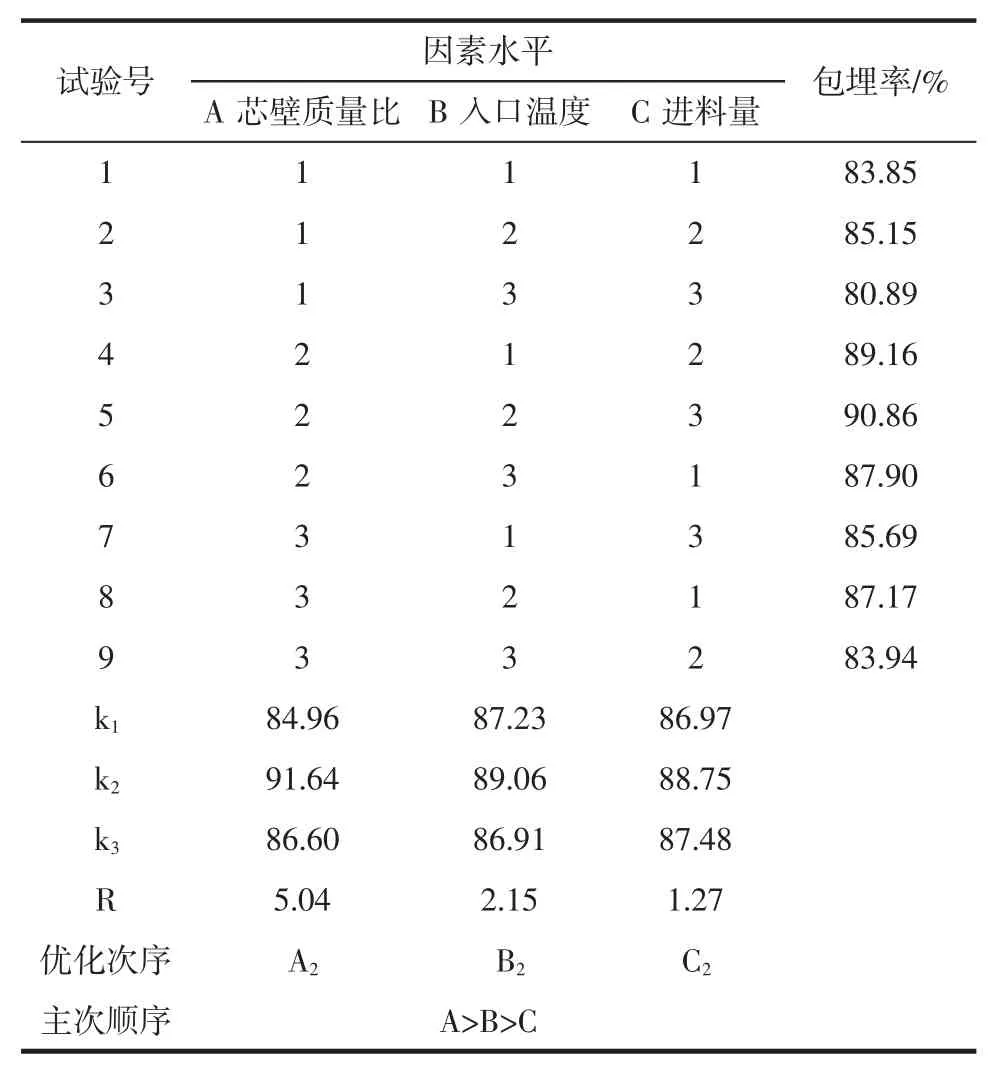
表2 正交试验优化结果及极差分析Table 2 Orthogonal test optimization results and range analysis
由表2 可知,RA>RB>RC,影响的主次顺序为芯壁质量比、入口温度、进料量,芯壁质量比对花色苷微胶囊包埋影响最显著。根据K 值分析结果,最优组合为A2B2C2,即芯壁质量比 2 ∶8、入口温度 120 ℃、进料量15 mL/min。
2.2.2 优化试验结果方差分析
正交试验优化结果及方差分析结果见表3。
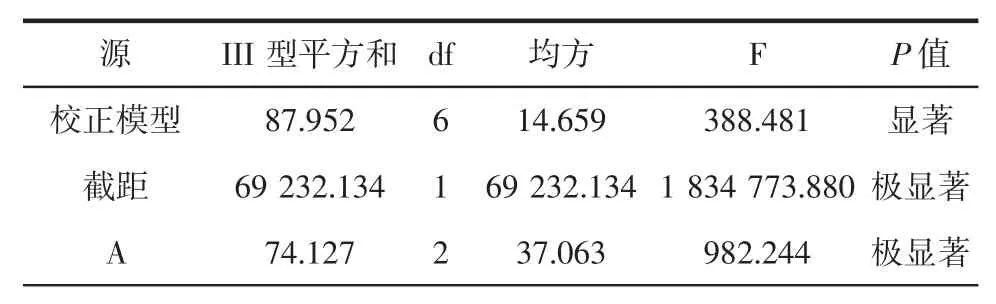
表3 正交试验优化结果及方差分析Table 3 Orthogonal test optimization results and analysis of variance
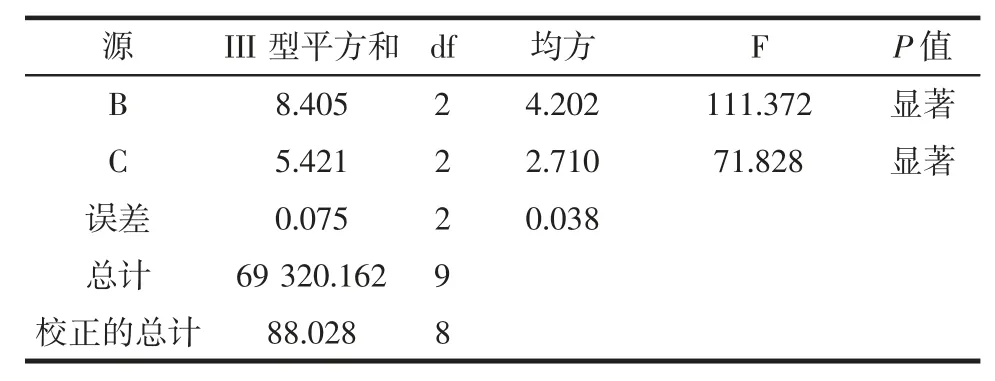
续表3 正交试验优化结果及方差分析Continue table 3 Orthogonal test optimization results and analysis of variance
表3 是花色苷微胶囊包埋正交试验的方差分析,由Ⅲ型平方和比较可以看出,对花色苷微胶囊包埋的影响主次顺序为A>B>C,即芯壁质量比>入口温度>进料量,该结果与表2 极差分析一致。验证试验:最优试验方案为A2B2C2,不在9 组试验中,故对其进行验证试验,A2B2C2与A2B2C3的条件下进行3 次独立重复试验,得到A2B2C2组合包埋率为91.28 %,A2B2C3组合包埋率为90.56%,高于A2B2C3,故选择A2B2C2为最佳试验条件。
2.3 黑果腺肋花楸花色苷微胶囊的的表征
黑果腺肋花楸花色苷微胶囊用XL-30 电镜在电压10 kV 下扫描,结果如图5 所示。

图5 花色苷微胶囊电镜图Fig.5 Electron micrograph of anthocyanin microcapsules
由图5 可以看出,黑果腺肋花楸花色苷微胶囊部分呈表面光滑的球形,大多数呈褶皱或者凹陷的形状,这是由于喷雾干燥过程中造成的,并没有出现裂痕,说明微胶囊效果较好。
2.4 微胶囊化前后花色苷稳定性研究
2.4.1 光照对花色苷微胶囊稳定性的影响
光照对花色苷微胶囊稳定性的影响结果见图6。
由图6 可看出,随着时间延长保存率逐渐下降,而花色苷微胶囊化后保存率变化趋势线相对较平缓,这是由于囊壁起到保护,阻绝作用,免受其光照。
2.4.2 温度对花色苷微胶囊稳定性的影响
温度对花色苷微胶囊稳定性的影响结果见图7。
由图7 可看出,随着温度增高,花色苷保存率逐渐降低,这是由于花色苷高温易分解。但微胶囊化后花色苷稳定性明显较缓慢的下降,这是因为是微胶囊化后经壁材包裹,微胶囊化可以控制芯材的释放,免受其外界因素影响,延长产品保存时间。

图6 光照对花色苷微胶囊稳定性的影响Fig.6 Effect of light on the stability of anthocyanin microcapsules

图7 温度对花色苷微胶囊稳定性的影响Fig.7 Effect of temperature on the stability of anthocyanin microcapsules
3 结论
采用单因素试验得到最佳工艺为:以阿拉伯胶/麦芽糊精(2 ∶3,质量比)为壁材、芯壁质量比 2 ∶8、入口温度120 ℃、进料量15 mL/min,结合正交试验确定最佳工艺条件为芯壁质量比2 ∶8、入口温度120 ℃、进料量15 mL/min,在此条件下花色苷微胶囊包埋率为91.28%。用XL-30 显微镜扫描得到表面无裂痕,连续性较好的花色苷微胶囊。经过微胶囊化的花色苷比微胶囊前的花色苷对其光和热的稳定性增强,有利于储藏并且增加其花色苷利用率,为以后食品开发提供便利。

