酒精性肝硬化患者血CTLA-4和PNPLA3基因多态性及其临床意义分析*
张 冰,解学军
酒精性肝硬化是酒精性肝病发展的结果,早期可能无明显的症状。随着疾病进展,则可出现消瘦,食欲减退,乏力,牙龈出血等症状。如疾病进一步恶化,还可出现面部晦暗、肝掌和肝性脑病等,严重危及患者生命健康。本病病因与患者长期大量饮酒有关。此外,性别、营养状态和遗传因素也是本病的影响因素[1]。最新研究显示,大量基因位点多态性与酒精性肝硬化的发生有关,如细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)和Patatin样磷脂酶3(patatin-like phospholipase domain containing 3,PNPLA3)基因多态性等,其中CTLA-4是免疫球蛋白超基因的一种,主要存在于T细胞表面。CTLA-4即是白细胞分化抗原,也是T细胞跨膜受体,具有传递阻止信号和负性调节T细胞增殖等功能[2]。PNPLA3则是Patatin样磷脂酶家族成员之一,具有磷脂酶和酰基转移酶活性,同时也是脂质代谢的重要参与因子[3]。既往研究显示,PNPLA3 rs738409 GG型基因携带人群是酒精性肝硬化的高危人群,并且发现该基因不但与脂肪肝形成有关,还与肝脏炎症和肝纤维化等病理学改变密切相关[4]。本研究分析了110例酒精性肝硬化患者外周血CTLA-4和PNPLA3基因多态性的变化,现报道如下。
1 资料与方法
1.1 一般资料 2017年1月~2019年1月在我院治疗的酒精性肝硬化患者110例,男性98例,女性12例;平均年龄为(50.2±9.1)岁。平均每日饮用乙醇量为(65.3±11.3)g,诊断符合酒精性肝病防治指南的标准。纳入标准:(1)本地常住汉族人群(居住时间超过1年)。排除标准:(1)合并有糖尿病、恶性肿瘤、自身免疫性疾病、甲状腺疾病等其他疾病;(2)病毒性肝炎、药物性肝损伤、自身免疫性肝病等其他肝病;(3)合并有HIV感染。同时,选择无肝肾功能异常、糖尿病、高血压病的不饮酒健康人100例作为对照,男性90例,女性10例;平均年龄为(49.9±9.1)岁。两组受试者性别和年龄比较差异无统计学意义(P>0.05)。
1.2 实验方法 采用聚合酶链反应-限制性片段长度多态性检测血CTLA-4基因rs4675369位点和PNPLA3基因rs738409位点多态性(上海生工生物有限公司),即抽取两组受检人员静脉血各5 ml,采用高盐法提取外周血基因组DNA,使用美国Thermo公司生产的Nanodrop 2000超微量分光光度计测定DNA浓度和纯度,行琼脂糖凝胶电泳检测DNA完整性。优先扩增目的基因片段,对应上下游引物(上海生工提供)1.0 μl,10 mM 1.0 dNTP(北京百奥莱博科技有限公司)2 μl,Taq Buffer(美国 Genscript公司)5.0 μl,Taq 酶(上海钰博生物)0.5 μl,加去离子水至50 μl。PCR 反应如下:95℃预变性5 min,94℃变性30 s,57℃退火60 s,72℃延伸60 s,共35个循环。对反应产物进行琼脂糖凝胶(北京瑞达恒辉科技发展有限公司)电泳,并于紫外灯下鉴定。使用美国ABI公司提供的3PROSM 3730测序仪对PCR纯化产物进行测序,确定样本基因表型。
1.3 统计学处理 应用SPSS 19.0软件处理和分析,对符合正态分布的计量资料以(±s)表示,两组间比较采用t检验,CTLA-4基因rs4675369位点基因型和等位基因比较采用卡方检验,采用 Hardy-Weinberg平衡法检验样本代表性,P<0.05表示差异有统计学意义。
2 结果
2.1 两组CTLA-4和PNPLA3基因多态性情况 人CTLA-4基因rs4675369位点基因型有三种,分别为AA、AG和GG型;PNPLA3基因rs738409位点基因型也有三种,分别为CC,GC和GG型。经Hardy-Weinberg检验,酒精性肝硬化患者和健康人CTLA-4和PNPLA3基因分布符合Hardy-Weinberg平衡定律。
2.2 肝硬化与健康人CTLA-4基因rs4675369位点多态性分布比较 肝硬化和健康人CTLA-4基因rs4675369位点基因型和等位基因比较,差异无统计学意义(P>0.05,表1)。
2.3 肝硬化与健康人PNPLA3基因rs738409位点多态性分布比较 肝硬化患者PNPLA3基因rs738409位点GG基因型和等位基因G比例显著高于健康人(P<0.05,表2)。
2.4 不同CTLA-4基因型肝硬化患者肝功能指标比较 vCTLA-4基因rs4675369位点AA型、AG型和GG型酒精性肝硬化患者血清 ALT、AST、GGT和ALP水平比较,差异无统计学意义(P>0.05,表3)。
2.5 不同PNPLA3基因型肝硬化患者肝功能指标比较 PNPLA3基因rs738409位点CC型、CG型和GG型酒精性肝硬化患者血清ALT、AST、GGT和ALP水平比较,差异无统计学意义(P>0.05,表4)。
3 讨论
酒精性肝硬化源于不良的生活习惯。因此,积极评估酒精性肝硬化危险人群,并给予健康指导是本病的防治要点。近些年的研究显示,基因多态性与酒精性肝硬化的发生密切相关,一些研究[5,6]已证实酒精代谢酶、炎症细胞因子、抗氧化酶等基因或基因组多态性是酒精性肝硬化发生、发展的影响因素,但大部分基因与酒精性肝硬化发病间的联系还有待进一步研究。

表1 两组CTLA-4基因rs4675369位点基因型分布(%)比较
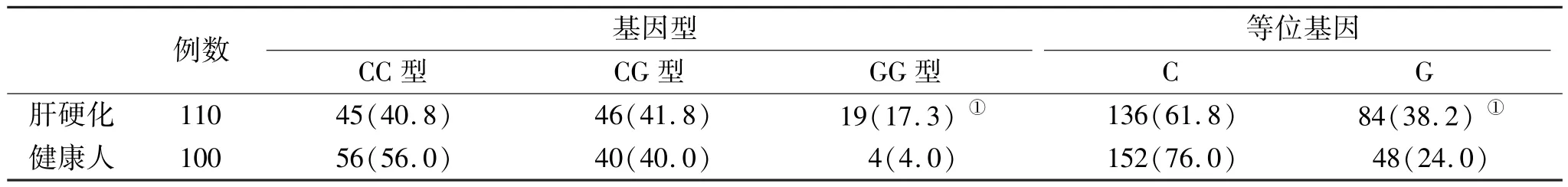
表2 两组PNPLA3基因rs738409位点基因型(%)比较
表3 不同CTLA-4基因型肝硬化患者肝功能指标(±s)比较

表3 不同CTLA-4基因型肝硬化患者肝功能指标(±s)比较
基因型 例数 ALT(U/L) AST(U/L) GGT(U/L) ALP(U/L)AA 型 29 186.0±39.8 130.3±53.3 270.8±87.3 98.8±43.3 AG 型 54 179.4±50.5 127.8±55.2 265.6±90.5 90.2±40.3 GG 型 27 181.8±48.2 133.7±50.4 269.8±89.7 95.2±40.1
表4 不同PNPLA3基因型肝硬化患者肝功能指标(±s)比较

表4 不同PNPLA3基因型肝硬化患者肝功能指标(±s)比较
基因型 例数 ALT(U/L) AST(U/L) GGT(U/L) ALP(U/L)CC 型 45 182.1±40.8 131.3±51.2 274.8±82.3 97.2±41.4 CG 型 46 180.4±49.1 128.9±55.0 267.1±88.4 91.2±42.2 GG 型 19 180.6±45.2 131.6±52.2 271.2±85.4 94.3±41.1
CTLA-4也被称为CD152,是T细胞活化的负性调节分子之一,其基因定位于人2q31-2q33,大小约为4 kb,含有4个外显子和3个内含子[7]。CTLA-4胞内端存在由36个氨基酸组成的免疫酪氨酸抑制基序(immune tyrosine inhibitory motif,ITIM)与同源蛋白CD28的免疫酪氨酸激活基序(immune tyrosine activating motif,ITAM)相对。CTLA-4具有高度内吞性,多以同源二聚体形式存在,可在T细胞活化后协同CD28等抑制分子共同负性调节T细胞表达。生化研究显示,CTLA-4可为T细胞受体募集磷酸酶,并减弱其信号,阻滞T细胞活化。CTLA-4还可从抗原呈递细胞膜内捕获、去除B7-1和B7-2,并阻滞其对CD28的激活能力,最终下调T细胞活性。最新研究显示[8],CTLA-4基因多态性对T淋巴细胞具有不同的抑制程度,GG基因型可显著减低CTLA-4 mRNA水平,而 AA型可促使 CTLA-4高表达。CTLA-4基因多态性还与IgE合成能力密切相关。AA基因型人群IgE抗体合成能力显著高于AG或GG型,提示AA基因型或可介导Th2为主的免疫反应。有研究发现[9],在伴自身免疫性疾病的患者,其GG基因型表达水平显著升高,并且患者CTLA-4 mRNA水平较健康人群更高。还有研究发现[10],CTLA-4外显子1区域及其启动子区域位点多态性与原发性胆汁肝硬化的发生密切相关。但在本研究中,酒精性肝硬化和健康人CTLA-4基因rs4675369位点基因型和等位基因比率比较差异无统计学意义,表明CTLA-4基因多态性与酒精性肝硬化发生的联系还需要研究[11]。本研究血CTLA-4基因rs4675369位点AA型、AG型和GG型的酒精性肝硬化患者血清ALT、AST、GGT和ALP水平比较差异无统计学意义,表明CTLA-4基因多态性与酒精性肝硬化的临床关系也不明。
PNPLA3基因位于人22号染色体22q13.31处,编码具有一个非特异性酰基水解酶活性的非分泌型蛋白[12]。PNPLA3存在一段高度保守的Gly-X-Ser-X-Gly水解序列,其活性中心也位于这一序列内[13]。PNPLA3疏水残基侧链底物结合凹边缘存在一个由丝氨酸和天冬氨酸组成的二元体,该二元体是PNPLA3催化效用的重要结构[14]。既往研究显示[15],PNPLA3基因的非同义序列变异rs738409C>G是人类肝脏脂肪变性的重要因素,而脂肪变性是酒精性肝硬化患者肝损伤的早期阶段,其机制可能与rs738409的非同义序列变异道甘油三酯活性水解活性被抑制,导致大量甘油三酯堆积于肝细胞内有关,这一机制也是非酒精性脂肪性肝病的重要发病机制[16,17]。此外,PNPLA3的G变异还将导致肝细胞脂肪分解功能变化,并因此引发肝组织脂肪堆积[18]。有意思的是,脂肪酸长度及其类型不同,PNPLA3的反应也不同,饱和、单或多不饱和脂肪酸可促使PNPLA3表达水平上升,而长链脂肪酸则对PNPLA3表达无明显的促进作用。有研究发现[19],PNPLA3还可对脂肪细胞表面的特殊位点进行调节,如PNPLA3变体可抑制甘油三酯在细胞间的转运能力,并增强其脂质过氧化的几率,增强肝脏氧化应激水平,并以此介导肝细胞炎症和损伤。PNPLA3基因多态性还可对肝实质细胞外的肝脏细胞数量和活性发生作用,并因此引发肝纤维化,但其机制尚无确切的结论。因此,PNPLA3基因多态性引发的肝组织脂肪存储、脂肪变性可作为酒精性肝硬化的高危因素。在本研究中,酒精性肝硬化和健康人PNPLA3基因rs738409位点基因型和等位基因比率差异有统计学意义,并且肝硬化患者GG基因型和等位基因G比率分别为16.0%和37.5%,佐证了前述的结论,即提示PNPLA3基因多态性与酒精性肝硬化的发生密切相关。国外研究显示[20],PNPLA3基因多态性与酒精性肝硬化患者肝组织炎症水平存在一定的相关性。但本研究发现酒精性肝硬化患者PNPLA3基因rs738409位点CC型、CG型和GG型患者血清ALT、AST、GGT和ALP比较差异无统计学意义,表明PNPLA3基因多态性与酒精性肝硬化患者的病情无显著关系,可能与本组研究样本数量较少有关。此外,本研究所取样本为血清,并未进行肝脏穿刺活检取样,或将掩盖了一些信息。
本研究通过基因分析,发现PNPLA3基因多态性可导致肝组织脂肪存储或脂肪变性等病理学改变,最终参与酒精性肝硬化的发生和发展,而CTLA-4基因多态性则与酒精性肝硬化发病无明显的关系。由于本研究例数较少,还存在一些不足,有待我们今后进行多中心、大样本的研究证实。PNPLA3基因多态性与酒精性肝硬化发病的确切关系,尚需进一步研究。

