白藜芦醇对代谢综合征大鼠肠道主要菌群的影响
缪萍, 李竞, 周飞, 李强
(1.宁波市鄞州人民医院,浙江宁波 315040;2.宁波大学医学院,浙江宁波 315211)
代谢综合征(MS)是以中心性肥胖、高血压、脂代谢异常、糖尿病或糖耐量受损等聚集出现为主要特点[1],以胰岛素抵抗(IR)为共同病理生理基础的代谢紊乱症候群[2],已成为全球公共健康主要问题。肠道菌群被称为人类的“第二基因组”,参与机体营养吸收与代谢、免疫调节等生理过程。若肠道微生态结构失衡,将导致肥胖、糖尿病、脂肪肝等代谢性疾病的发生和发展[3]。本课题组前期研究发现,白藜芦醇能有效控制MS大鼠体质量和血压,减少腹腔脂肪蓄积,纠正糖脂代谢紊乱和改善IR。因此,本研究拟通过观察白藜芦醇对MS 大鼠肠道菌群的调节作用,探讨肠道菌群、炎症因子及脂肪代谢相关基因三者之间的相关性,为进一步的机制研究和治疗策略提供依据,现将研究结果报道如下。
1 材料与方法
1.1实验动物及饲料SPF 级雄性SD 大鼠32 只,体质量(200 ± 20)g,由浙江省医学科学院实验动物中心提供,许可证号:SCXK(浙)2014-0001。饲养于宁波大学实验动物中心,自由进食饮水。高脂高盐高糖饲料(按质量分数配方:基础饲料56%、猪油15%、蔗糖15%、蛋黄10%、食盐2%、胆固醇2%),购自北京科澳协力饲料有限公司。
1. 2药物、细菌、试剂与仪器白藜芦醇(批号:FY10700805)购自江苏南通飞宇生物科技有限公司,用蒸馏水配制成浓度为20 mg/mL 的混悬液;盐酸二甲双胍片(批准文号:国药准字H20023370),由中美上海施贵宝制药有限分司生产,使用前用蒸馏水配成浓度为30 mg/mL 的溶液。以上药液均置于4 ℃冰箱保存。实验细菌有2 种需氧菌属(大肠杆菌、链球菌),2 种厌氧菌属(双歧杆菌、乳酸杆菌),由本院微生物实验室提供。肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)和白细胞介素6(IL-6)酶联免疫吸附分析(ELISA)试剂盒均购自上海西唐生物科技有限公司;RNA 抽提试剂盒购自上海捷瑞生物工程有限公司;逆转录试剂盒、荧光定量PCR 试剂盒均购自南京诺唯赞生物科技有限公司;引物由上海桑尼生物科技有限公司合成。SMA 4000 微量紫外分光光度计(美国Merinton 公司);SCIENTZ-48 高通量组织研磨器(宁波新芝生物科技股份有限公司);Spectra Max Plus 384 酶标仪(美国Molecular Devices 公司);Wellwash 4 MK2 洗板机(美国Thermo 公司);CFX connect 荧光定量PCR 仪(美国Bio-RAD 公司产品);Avanti J-E 多用途高效离心机(美国Beckman公司)。
1.3动物分组、造模与给药32只大鼠适应性饲养7 d 后,按随机数字表分为正常组8 只、造模组24只。采用高脂高盐高糖饮食喂养16周建立MS大鼠模型[4]。若大鼠出现腹型肥胖、高血压、血糖血脂异常、高胰岛素血症等特征,则判断造模成功。12周后,将复制成功的MS模型大鼠随机分为模型组、白藜芦醇组和二甲双胍组,每组各8 只。参照文献[5]制定白藜芦醇灌胃剂量为100 mg/kg;二甲双胍根据成人临床日用量,按体表面积折算动物有效剂量,得出灌胃剂量为150 mg/kg;正常组和模型组灌胃等体积蒸馏水,给药体积为5 mL/kg。每日1次,连续4周。在造模及干预期间正常组给予基础饲料。
1. 4标本留取末次给药后,禁食不禁水12 h,在无菌条件下收集大鼠直肠内容物。腹腔注射25%乌拉坦4 mL/kg 麻醉,腹主动脉取血,以3 000 r/min离心20 min,分离血清,储存于-70 ℃冰箱中。剪取肝脏左叶相同部位组织,-70 ℃冻存待检。
1.5检测指标和方法
1. 5. 1 肠道菌群检测[6]取各组大鼠粪便0.1 g,置于装有玻璃珠的无菌试管中。按1∶9加入灭菌生理盐水涡旋振荡至粪便均匀化,采用10 倍稀释法用生理盐水将粪便悬液依次稀释至10-8浓度。取菌液50 μL接种于各种培养基上,需氧菌在普通温箱37 ℃培养24 h,厌氧菌在厌氧箱中培养48 h。以菌落形态、革兰氏染色和生化反应鉴定细菌,计数培养基上生长的菌落数,结果以每1 g粪便中菌落数的对数值(lg CFU/g)表示。
1.5.2 血清TNF-α、IL-1β、IL-6 含量测定 按照ELISA 试剂盒说明书进行操作,应用酶标仪于450 nm 波长处测吸光值,绘制标准曲线,计算TNF-α、IL-1β、IL-6的含量。
1.5.3 逆转录聚合酶链反应(RT-PCR)法检测肝脏禁食诱导脂肪因子(Fiaf)、脂蛋白脂酶(LPL)、乙酰辅酶A羧化酶α(ACCα)、脂肪酸合成酶(Fas)
mRNA 表达水平 Trizol 法提取总RNA。逆转录合成cDNA,反应条件:50 ℃15 min,85 ℃2 min。Fiaf 引物为5’-CGCCTGAACGGCTCTGTG-3’(F),5’-CGGTCCCCTGTGATGCTG-3’(R),119 bp;LPL 引物为5’-CTGGCGTGGCAGGAAGTC-3’(F),5’-AATCCGCATCATCAGGAGAAA-3’(R),120 bp;ACCα 引物为5’-ATGCCGGGCCATTGGTA-3’(F),5’-TGGGTAACTCCGTTGTTGTGC-3’(R),183 bp;Fas 引物为5’-ACAGTGGCGTGGAATGGG-3’(F),5’-AATCTGGATGGCGGTGAGG-3’(R),181 bp;β-actin引物为5’-CCCATCTATGAGGGTTACGC-3’(F),5’- TCAGAGGGAGTGAGGATGCC-3’(R),150 bp。扩增反应 程 序:95 ℃30 s,95 ℃10 s,60 ℃30 s,40 个循环。结束后进入熔解曲线采集程序,从70 ℃开始每5 s 将温度提高0.5 ℃并采集荧光信号,直至温度达到95 ℃。以β-actin 为内参,采用Livak(2-△△Ct)法进行基因相对表达量分析。
1.6统计方法采用SPSS 17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,先行正态性检验和方差齐性检验,符合正态分布采用单因素方差分析进行组间比较,不符合正态分布采用非参数检验。以P<0.05为差异有统计学意义。
2 结果
2.1白藜芦醇对MS大鼠肠道菌群的影响表1结果显示:模型组大鼠肠道内大肠杆菌与链球菌的数量明显增加,双歧杆菌和乳酸杆菌的数量明显减少,与正常组比较,差异有统计学意义(均P<0.01)。与模型组比较,白藜芦醇组和二甲双胍组大肠杆菌、链球菌数量明显减少,双歧杆菌、乳酸杆菌数量明显增加(P<0.05或P<0.01)。
表1 各组大鼠肠道菌群数量的变化Table 1 Comparison of the number changes in gut microbiota in rats of various groups (±s,lg CFU/g)
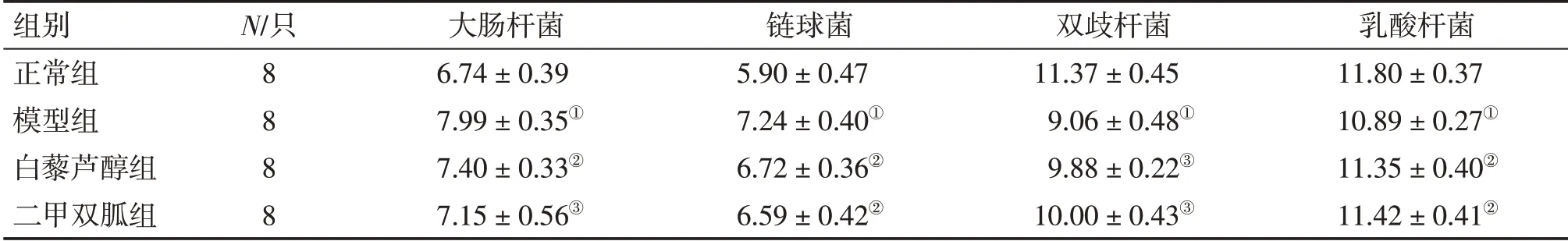
表1 各组大鼠肠道菌群数量的变化Table 1 Comparison of the number changes in gut microbiota in rats of various groups (±s,lg CFU/g)
①P <0.01,与正常组比较;②P <0.05,③P <0.01,与模型组比较
组别正常组模型组白藜芦醇组二甲双胍组N/只8 8 8 8大肠杆菌6.74±0.39 7.99±0.35①7.40±0.33②7.15±0.56③链球菌5.90±0.47 7.24±0.40①6.72±0.36②6.59±0.42②双歧杆菌11.37±0.45 9.06±0.48①9.88±0.22③10.00±0.43③乳酸杆菌11.80±0.37 10.89±0.27①11.35±0.40②11.42±0.41②
表2 各组大鼠血清TNF-α、IL-1β、IL-6含量比较Table 2 Comparison of the serum levels of TNF-α,IL-1β and IL-6 in rats of various groups [±s,ρ/(pg·mL-1)]
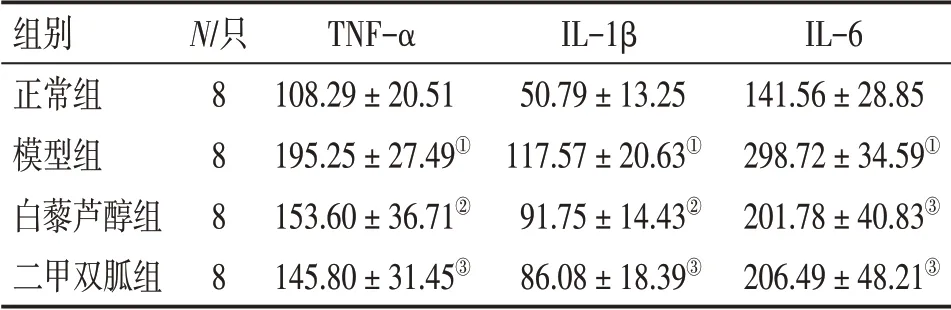
表2 各组大鼠血清TNF-α、IL-1β、IL-6含量比较Table 2 Comparison of the serum levels of TNF-α,IL-1β and IL-6 in rats of various groups [±s,ρ/(pg·mL-1)]
①P <0.01,与正常组比较;②P <0.05,③P <0.01,与模型组比较
组别正常组模型组白藜芦醇组二甲双胍组N/只8 8 8 8 TNF-α 108.29±20.51 195.25±27.49①153.60±36.71②145.80±31.45③IL-1β 50.79±13.25 117.57±20.63①91.75±14.43②86.08±18.39③IL-6 141.56±28.85 298.72±34.59①201.78±40.83③206.49±48.21③
2. 2白藜芦醇对MS大鼠血清TNF-α、IL-1β、IL-6含量的影响表2 结果显示:与正常组比较,模型组大鼠血清TNF-α、IL-1β 和IL-6 含量显著升高(P<0.01);白藜芦醇组和二甲双胍组TNF-α、IL-1β和IL-6含量均较模型组明显降低(P<0.05或P<0.01)。
2.3白藜芦醇对MS大鼠肝脏Fiaf、LPL、ACCα、Fas mRNA表达量的影响图1 结果显示:与正常组比较,模型组大鼠肝组织Fiaf mRNA表达量明显降低(P<0.01),LPL、ACCα 和Fas mRNA 表达量显著增加(P<0.01);与模型组比较,白藜芦醇组和二甲双胍组均能显著上调Fiaf mRNA 表达量(P<0.05),有效下调LPL、ACCα 和Fas mRNA 表达量(P<0.05或P<0.01)。
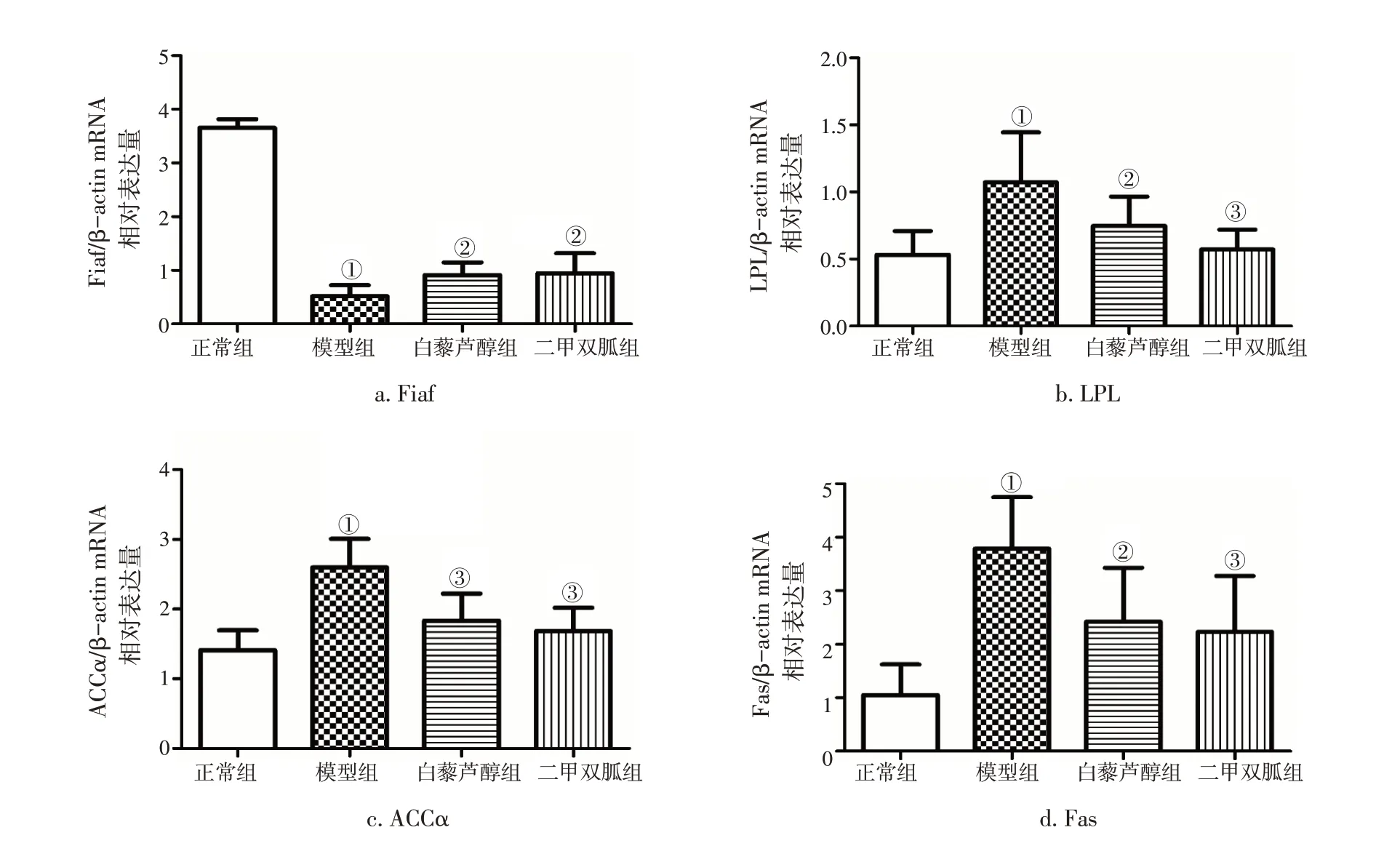
图1 各组大鼠肝组织Fiaf、LPL、ACCα、Fas mRNA表达量比较(±s)Figure 1 Comparison of the mRNA expression levels of Fiaf,LPL,ACCα and Fas in liver tissue of rats invarious groups(±s)
3 讨论
人类肠道内定植着数十万亿、上千种细菌,与宿主存在着密切的共生关系。主要分为厚壁菌门、放线菌门、拟杆菌门和变形菌门等四类厌氧菌。其中,厚壁菌门还包括乳酸杆菌、支原菌、芽孢杆菌和梭菌等200多种类型。厚壁菌门和拟杆菌门在整个菌群系统中占有绝对优势(约占90%以上)[7],这两种菌群在肠道中所占的比例将影响宿主摄取能量物质的能力。Ley 等[8]发现瘦素缺失的肥胖小鼠与正常普通小鼠的肠道细菌不同,主要表现为厚壁菌门含量增加,而拟杆菌门的含量降低。Bäckhed 等[9]发现,肠道菌群可调节宿主能量贮备,无菌小鼠摄入热量高于正常普通小鼠的29%,而全身脂肪含量低于其40%。若将正常小鼠的肠道菌群移植到无菌小鼠体内,在不改变饲料摄取和能量消耗的情况下,无菌小鼠的身体脂肪总量仍增加了60%,肝脏甘油三酯升高2.3倍。成扬等[10]研究表明,酒精性脂肪肝大鼠肠道菌群结构改变的同时,伴有转氨酶和脂多糖(LPS)升高,肝细胞受损。而健脾活血方对其有良好的保护作用,其机制可能与调节肠道微生态失衡有关。本研究结果提示,MS 大鼠存在明显的肠道菌群失调,大肠杆菌、链球菌等条件致病菌含量增加,双歧杆菌和乳酸杆菌等益生菌含量减少。白藜芦醇可以调节MS大鼠肠道微生态环境,提高益生菌比例,并降低条件致病菌比例,使紊乱的肠道菌群结构趋于正常。
有研究发现,低水平炎症反应是肥胖及相关代谢性疾病的一个重要机制[11]。长期摄入高脂饮食导致肠道微生态结构改变,使LPS吸收增加,通过与免疫细胞表面的复合受体CD14/Toll 样受体4(TLR4)结合,激活免疫系统,触发促炎细胞因子的释放,引起炎症级联反应,从而诱发肥胖。Cani等[12]证明,与正常对照组比较,高脂饮食喂养4周后的小鼠能量摄入过多,伴随肠道菌群发生改变(拟杆菌减少),血液中LPS 增加2 ~3 倍,这种症状也被称为“代谢内毒素血症”。肠道菌群可能通过调节炎症通路影响宿主的代谢。本研究结果显示:白藜芦醇可以显著降低MS 大鼠血清TNF-α、IL-1β和IL-6的含量,减轻炎症因子对肠黏膜的损伤,改善肠道屏障功能。
肠道菌群可通过调节参与脂质代谢的因子影响饮食中脂质的吸收、储存和利用。肠道菌群发酵多糖产生的碳水化合物进入肝脏和脂肪细胞,通过激活2种转录因子,即碳水化合物应答元件结合蛋白(ChREBP)和胆固醇调节元件结合蛋白-1(SREBP-1),进一步激活肝脏2种脂肪酸合成关键酶ACCα 和Fas 的活性,促进肝脏和脂肪组织甘油三酯的合成和堆积[13-14]。肠黏膜上皮细胞产生的Fiaf是血管生成素样蛋白的家族成员,是过氧化物酶体增殖物激活受体(PPARs)的新靶点,是一种新的下丘脑调节器[15]。肠道的乳酸菌能够诱导Fiaf基因的表达,高脂喂养的小鼠补充乳酸菌后Fiaf活性升高,通过抑制LPL 的活性,减少脂肪酸的摄入和甘油三酯在脂肪组织中的蓄积[16]。本研究结果表明,白藜芦醇能明显提高MS 大鼠肝脏Fiaf 活性,降低LPL、ACCα、Fas等脂肪细胞关键转录因子的表达。
由此推测,白藜芦醇可能通过改善肠道微环境,促进肠道益生菌生长,进而缓解炎症反应,纠正脂代谢紊乱,延缓MS的发展进程。

