超高效液相色谱法同时测定盆炎净中3种活性成分
袁志鹰 肖青青 李 哲 谢梦洲*,3,黄 培 童巧珍 黄惠勇,3
(1.湖南中医药大学湖南长沙 410208;2.湖南省中药饮片标准化及功能工程技术研究中心湖南长沙 410208;3.湖南省药食同源功能性食品工程技术研究中心湖南长沙 410208)
盆炎净是根据中医学经典《普济方》研制开发的中成药,该药由忍冬藤、蒲公英、鸡血藤、益母草、狗脊、车前草、赤芍、川芎等八味中药制成[1,2]。盆炎净有胶囊、片剂和咀嚼剂等剂型,具有清热利尿、活血通络,调经止带等功效,是临床最常用妇科疾病中成药之一[3-5]。中药成分的复杂多样性决定了中药质量控制模式必须采用多成分定量和多指标质量控制[6-8],多指标控制能更好的反应出中成药的质量。
超高效液相色谱-二极管阵列检测法(UPLC-DAD)可以实现多种成分的快速分离测定,可为中药质量控制提供一种简单、高效的解决方法[9,10]。盆炎净胶囊中赤芍的主要指标成分为芍药苷,大车前苷为车前草主要指标成分[11,12],而原儿茶酸是鸡血藤、狗脊、川芎、车前草、赤芍和忍冬藤等多种药材中的重要活性成分[1,13-16]。采用UPLC-DAD快速对盆炎净胶囊、片剂、颗粒剂和咀嚼剂中的原儿茶酸,芍药苷和大车前苷的测定,可以更好地控制盆炎净的质量,且相关研究尚未见报道。
本实验建立UPLC-DAD法快速测定盆炎净中成药中原儿茶酸、芍药苷和大车前苷的含量,评价不同剂型、不同批次的中成药盆炎净质量差异,为加强质量控制提供实验参考。
1 实验部分
1.1 仪器与试剂
Agilent 1290 Infinity型超高效液相色谱仪(美国,Agilent公司);KM-250 DE型中文液晶台式超声波清洗器(昆山美美超声仪器有限公司);ML204电子分析天平(瑞士,Mettler Toledo公司)。
乙腈为色谱纯(韩国LG公司),其余试剂为分析纯。水由Millipore纯水仪(美国Millipore公司)制备。
大车前苷(上海源叶生物科技有限公司,B20225),芍药苷(上海源叶生物科技有限公司,B21148),原儿茶酸(上海源叶生物科技有限公司,B21614)。
1.2 实验样品
收集各批次盆炎净胶囊、片剂、颗粒剂和咀嚼剂,具体批次详细信息如表1所示。

表1 盆炎净的剂型、批次Table 1 Information of Penyanjing samples
1.3 溶液制备
1.3.1 供试品溶液的制备取盆炎净胶囊内容物、颗粒剂、片剂和咀嚼片,用研钵研碎,分别称取约0.25 g(准确称定),放入具塞的锥形瓶中,加入25 mL 70%甲醇,称定重量。超声30 min后,取出冷却至室温,用70%甲醇补足超声过程中减失的重量,摇匀,滤过,取续滤液,即得。
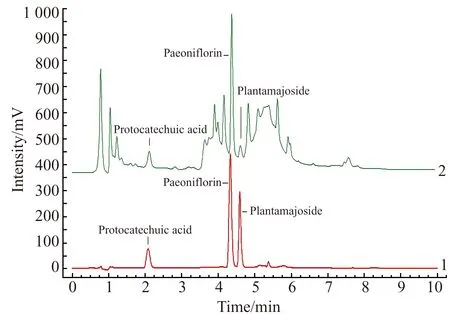
图1 盆炎净样本中原儿茶酸、芍药苷和大车前苷色谱图Fig.1 Chromatograms of standard solution and test solution1.Standard solution(230 nm);2.Test solution.(230 nm).
1.3.2 对照品溶液的制备精密称取原儿茶酸、芍药苷和大车前苷对照品适量,用70%甲醇溶解,得到原儿茶酸为31.88 μg/mL、芍药苷为57.14 μg/mL、大车前苷为48.81 μg/mL的混合对照品溶液。
1.4 色谱条件
Agilent Eclipse Plus C18色谱柱(50 mm×2.1 mm,1.8 μm);流动相:乙腈(A)和0.2%磷酸溶液(B);梯度洗脱:0~1.9 min,10%(A);1.9~2.0 min,10%~20%A;2.0~3.5 min,20%~25%A;3.5~3.9 min,25%~35%A;3.9~4.5 min,35%~50%A;4.5~5.5 min,50%~60%A;5.5~6.5 min,60%~90%A;6.5~9.0 min,90%~10%A;9.0~10.0 min,10%A。流速0.15 mL/min,检测波长230 nm,进样量2.0 μL,柱温30 ℃。优化条件下盆炎净中原儿茶酸、芍药苷和大车前苷色谱谱图见图1。
2 结果与讨论
2.1 溶剂的选择
实验根据3种主要活性成分的性质,对供试品溶液的提取溶剂进行了筛选。对提取溶剂50%乙醇、50%甲醇、70%乙醇、70%甲醇进行了提取效果的比较。结果表明,以70%甲醇为提取溶剂的提取效果最好,故选定70%甲醇作为提取溶剂。
2.2 梯度洗脱条件及检测波长的选择
实验比较了甲醇-水、甲醇-0.1%磷酸、乙腈-水、乙腈-0.1%磷酸、甲醇-0.2%磷酸、乙腈-0.2%磷酸等不同比例流动相体系进行梯度洗脱的效果。结果表明,原儿茶酸、芍药苷和大车前苷的测定在乙腈-0.2%磷酸溶液为流动相,按1.4节下梯度条件洗脱,3种活性成分峰保留时间适中,分离度和峰形最佳。将混合对照品溶液用DAD进行全波长条件扫描,经分析可知3种成分在波长230 nm均具有较大的吸收强度,峰形好,故选择230 nm作为检测波长。
2.3 样品中3种主要成分含量的比较分析
实验对不同剂型盆炎净中的原儿茶酸、芍药苷和大车前苷进行了多批次的含量测定,发现不同批次盆炎净胶囊样品中的3种主要活性成分含量存在差异(图2)。从分布水平来看,所有的样本均含有芍药苷,因此芍药苷可以作为中成药盆炎净的重点关注质控成分。

图2 盆炎净样本中原儿茶酸、芍药苷和大车前苷含量分布图(横坐标1~25为样本编号)Fig.2 Amount distribution charts of protocatechuic acid,paeoniflorin and plantamajoside in samples of Penyanjing
2.4 方法学考察
2.4.1 线性关系精密吸取对照品溶液,稀释得到系列浓度的混合对照品溶液。分别吸取上述稀释后的混合对照品溶液,进行UPLC-DAD检测。以对照品溶液的浓度c为横坐标(X),峰面积为纵坐标(Y),得到各活性成分的线性方程。结果见表2,各活性成分的线性良好。

表2 各组分的线性方程Table 2 Linear equation of different compounds
2.4.2 精密度实验按照优化色谱条件,取混合对照品溶液连续进样6次测定,原儿茶酸、芍药苷和大车前苷峰面积的相对标准偏差(RSD)分别为0.62%、0.36%、0.45%,精密度良好。
2.4.3 稳定性实验取供试品溶液,分别于0、1、2、5、7、10、13、24 h进样测定,原儿茶酸、芍药苷和大车前苷峰面积的RSD分别为0.37%、1.32%、0.74%,显示稳定性良好。
2.4.4 加标回收率平行取已知3种活性成分含量的盆炎净胶囊内容物9份,研钵研碎,精密称定每份约0.25 g,分成3组,每组3份。每组分别加入混合对照品溶液1、2、3 mL,加入70%甲醇定容至25 mL,超声30 min,进样分析,记录色谱峰面积,计算样品加样回收率。结果显示原儿茶酸、芍药苷、大车前苷和加样回收率分别为103.40%、98.81%、93.70%,RSD分别为2.68%、2.34%、2.83%,表明回收率良好。结果详见表3。
2.5 样品含量测定
分别精密称取不同批次的盆炎净样品,按1.3方法制备供试品溶液,按1.4色谱条件进行测定,被测组分原儿茶酸、芍药苷、大车前苷与共存组分实现基线分离,计算样品中原儿茶酸、芍药苷和大车前苷的含量,结果见表4。
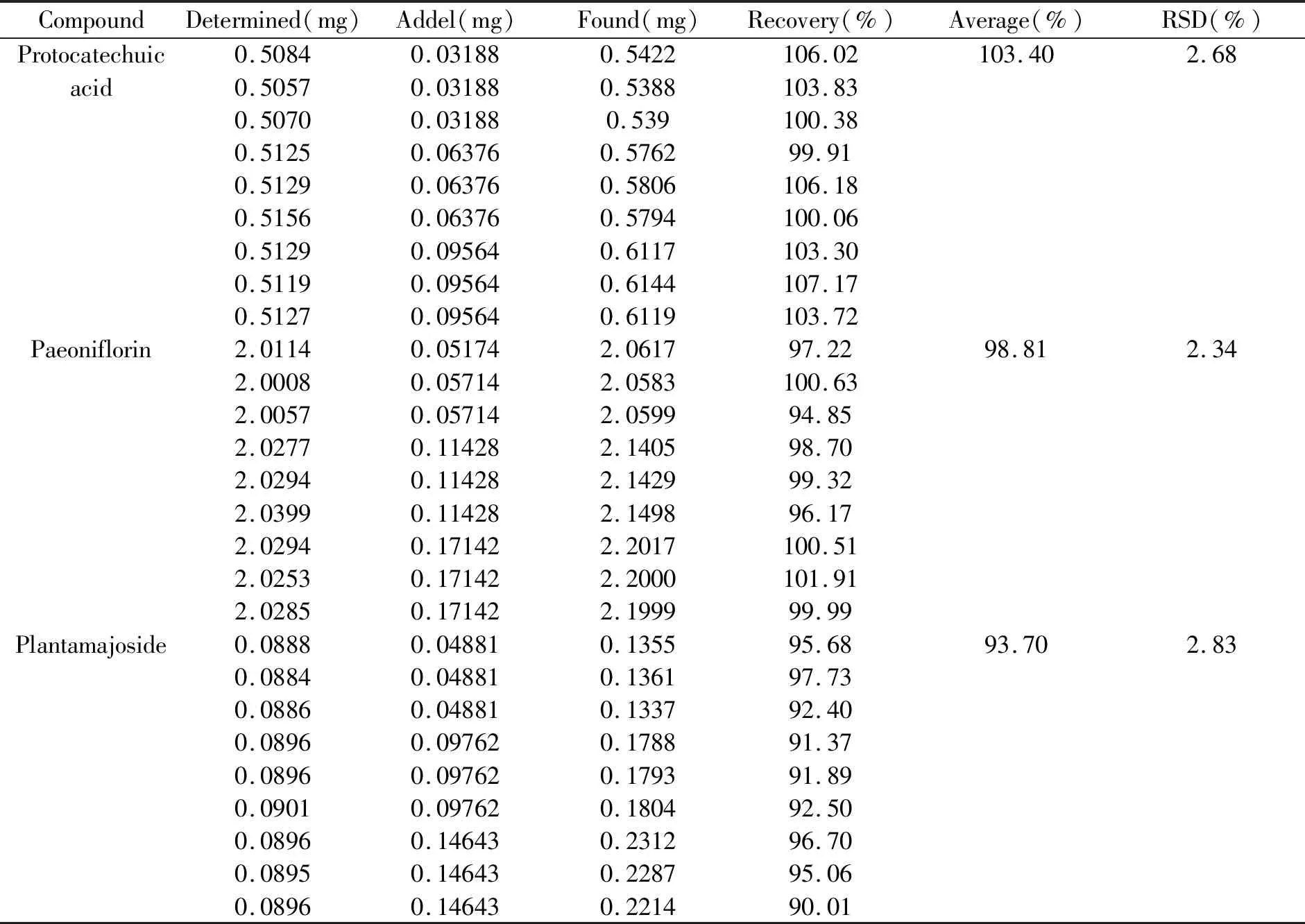
表3 盆炎净中原儿茶酸、芍药苷和大车前苷加样回收试验结果(n=3)Table 3 Rerults of recovery tests(n=3)
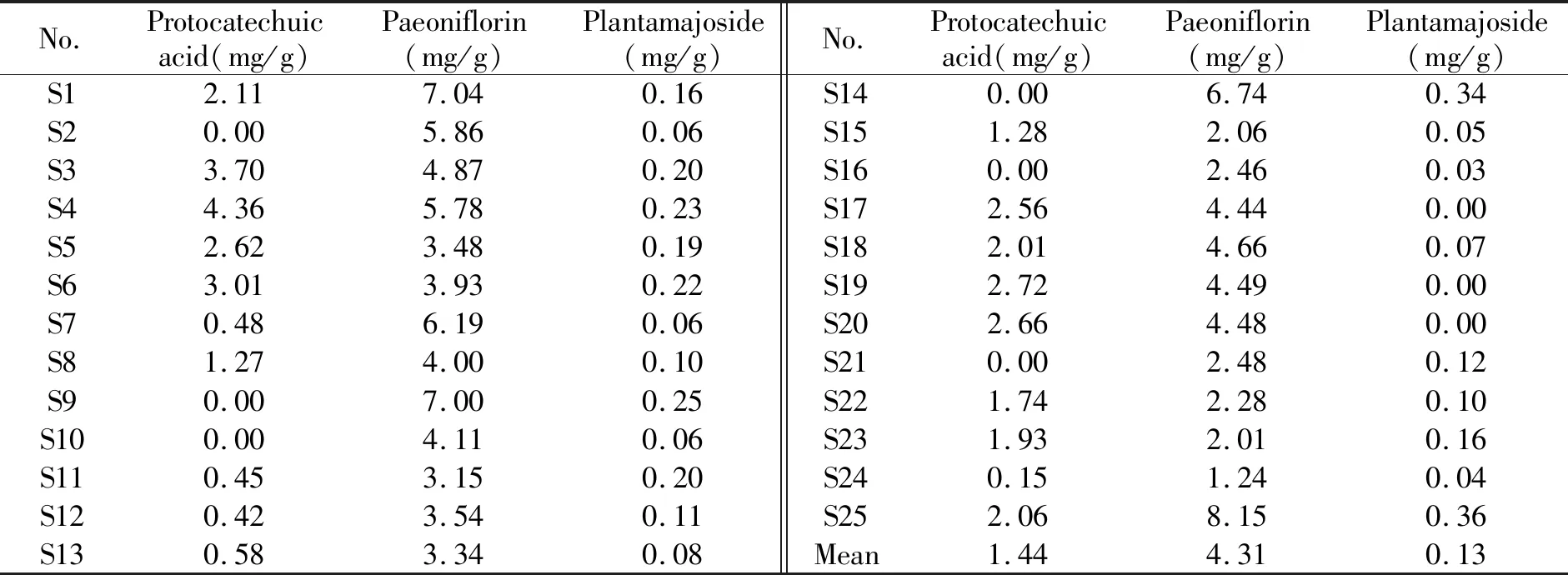
表4 盆炎净样品主要活性成分含量(n=3)Table 4 Determination of bioactive compounds in Penyanjing(n=3)
3 结论
本实验收集的25批次盆炎净样本来源于多个厂家,3种主要活性成分含量的差异可能与厂家制备工艺和药材本身因素有关,而盆炎净4种剂型目前只有企业标准。因此,提高盆炎净企业质量标准十分迫切。我们将加强对中成药盆炎净的研究,为提高其质量监督提供依据。

