直肠腔内超声与磁共振成像对直肠癌术前局部分期的准确性比较▲
蔡 彬 黄 伟 利锡贵
(1 南京中医药大学无锡附属医院肛肠科,江苏省无锡市 214000,电子邮箱:cb1988cn@126.com;广西医科大学第一附属医院2 结直肠肛门外科,3 超声科,南宁市 530021)
直肠癌是胃肠道最常见的恶性肿瘤之一,据统计2019年美国有44 180人被诊断为直肠癌[1]。精准的术前分期对指导直肠癌患者的治疗和确定手术方式至关重要[2]。局部分期的评估主要包括肿瘤浸润深度(T分期)和邻近淋巴结转移情况(N分期)。目前,直肠癌术前局部分期最常用的影像学方法是直肠腔内超声(endorectal ultrasonography,ERUS)和磁共振成像(magnetic resonance imaging,MRI)。ERUS和MRI均可准确地评估直肠壁的层面情况,同时判断是否存在直肠周围淋巴结转移。然而,目前关于ERUS和MRI哪种检查方法更加适用于直肠癌术前局部分期仍存在争议。本研究比较ERUS和MRI对直肠癌术前局部分期的准确性,现报告如下。
1 资料与方法
1.1 临床资料 选取2013年6月至2014年6月广西医科大学第一附属医院结直肠肛门外科收治的130例原发性直肠癌患者作为研究对象,其中男性85例,女性45例;年龄(56.7±12.0)岁;壮族41例,汉族82例,瑶族3例,布依族2例,仫佬族2例。纳入标准:(1)结肠镜检查活检提示直肠恶性肿瘤;(2)术前1周内接受ERUS和MRI检查;(3)术前未接受新辅助化疗等抗癌治疗;(4)所有患者均住院接受Miles或Dixon手术,并对切除标本进行术后病理分期。排除标准:(1)未在我院接受手术治疗;(2)术前接受新辅助化疗或放疗;(3)因患者原因术前一周余内未行ERUS或MRI检查;(4)所得图像有明显伪影,严重干扰判断。本研究通过广西医科大学第一附属医院医学伦理委员会批准(2013-KY-E-010)。所有研究对象均对本研究知情同意,对所有患者的信息进行匿名分析。
1.2 方法
1.2.1 ERUS检查:所有患者ERUS检查均在广西医科大学第一附属医院超声科进行,检查使用ESAOTE DU8超声诊断仪(意大利百胜医疗),采用常规探头,扫描角度为270°,成像频率为7.5~10 MHz。所有患者均行左侧位检查,于检查前1 d灌肠进行肠道准备。将装有橡胶护套,并填充偶联剂的ERUS探头小心地插入患者直肠,直至肿瘤上方的直肠腔。由于声阻抗的差异,ERUS检查图像从管腔开始至肠壁共分为5层:(1)黏膜与超声探头交界面的高回声层;(2)黏膜和黏膜肌层产生的低回声层;(3)黏膜下层对应的高回声层;(4)固有肌层对应的低回声层;(5)直肠周围脂肪/浆膜的高回声层。直肠癌的ERUS分期如下:uT1为肿瘤局限于前三层,黏膜下层完整(图1a);uT2为肿瘤侵犯固有肌层,但未到达浆膜(图1b);uT3为肿瘤侵犯直肠浆膜及周围组织(图1c);uT4为肿瘤侵袭邻近的器官和组织(图1d)。uN0为直肠周围无淋巴结转移或无明显淋巴结,或淋巴结直径小于5 mm;uN1为有1~3个淋巴结转移,淋巴结直径≥5 mm;uN2为有≥4个淋巴结转移,淋巴结直径≥5 mm。

图1 直肠癌ERUS图像
注:a为uT1期,黑色三角代表肿瘤,白色箭头示黏膜下层完整,肿瘤局限于前3层,白色三角代表精囊;b为uT2期,黑色三角代表肿瘤,白色箭头表示肿瘤侵犯了固有肌层;c为uT3期,黑色三角代表肿瘤,白色箭头表示肿瘤侵犯直肠周围组织;d为uT4期,黑色三角代表肿瘤,白色三角代表前列腺,白色箭头表示肿瘤穿透浆膜并侵入前列腺。
1.2.2 MRI检查:所有患者MRI检查均在广西医科大学第一附属医院放射科进行,采用Philips Achieva 3T相控阵体线圈MRI(荷兰飞利浦医疗),扫描范围从双侧髂前上棘连线到肛门。所有患者均于检查前1 d进行肠道准备。扫描参数:T1加权成像轴位快速自旋,重复时间为600 ms,回波时间为11 ms,视野为300 mm,层厚为3 mm,层间距为1.0 mm,像素矩阵为512×512;T2加权成像轴位:重复时间为3 800~4 200 ms,回波时间为97 ms,视野为180~240 mm,层厚为3 mm,层间距为1.0 mm,像素矩阵为256×256;扩散加权序列为0、100、1 000 s/mm2。MRI图像中肠壁分层:(1)黏膜层薄,低信号强度线;(2)黏膜下层厚,高信号强度层;(3)固有肌层为低信号层;(4)外周脂肪为高信号层;(5)直肠系膜筋膜为精细、低信号强度层包裹直肠周围脂肪和直肠。直肠癌MRI分期:mT1:肿瘤局限于黏膜及黏膜下层(图2a);mT2:肿瘤侵犯固有肌层(图2b);mT3:肿瘤延伸至直肠系膜脂肪(图2c);mT4:肿瘤侵犯邻近器官(图2 d)。mN0:无淋巴结受累,或淋巴结直径<5 mm;mN1:有1~3个区域淋巴结肿瘤阳性,淋巴结直径≥5 mm;mN2:有≥4个区域淋巴结肿瘤阳性,淋巴结直径≥5 mm。

图2 直肠癌MRI图像
注:a为mT1期,白色箭头表示肿瘤局限于黏膜和黏膜下层;b为mT2期,黑色三角代表肿瘤,白色箭头示肿瘤侵及固有肌层,但固有肌层的低信号强度线仍是连续的;c为mT3期,黑色三角代表肿瘤,白色箭头表示肿瘤侵入直肠周围脂肪组织;d为mT4期,白色箭头示肿瘤穿透直肠系膜筋膜,侵及宫颈。
1.2.3 病理检查:病理分期参照美国癌症联合委员会肿瘤分期手册第七版[3]中直肠癌原发肿瘤-区域淋巴结-远处转移(tumor-node-metastasis, TNM)分期,pT1:肿瘤侵袭黏膜下层;pT2:肿瘤侵犯固有肌层;pT3:肿瘤穿透固有肌层与浆膜下层,或者进入无腹膜覆盖的结肠周围或直肠周围组织;pT4:肿瘤侵袭其他器官或结构。pN0:无局部淋巴结转移;pN1:有1~3个区域淋巴结转移;pN2:有≥4个区域淋巴结转移。
1.3 评估指标 以术后组织病理学结果作为金标准,将ERUS和MRI分期结果分别与术后组织病理学分期结果进行比较,计算ERUS和MRI对T和N分期的准确率及其与术后病理的一致性。其中,以术后组织病理学结果作为金标准,ERUS和MRI检查结果高估了肿瘤分期为高分期,ERUS和MRI检查结果低估了肿瘤分期为低分期。
1.4 统计学分析 采用SPSS 17.0软件进行统计分析。计数资料以例数和百分比表示,比较采用χ2检验,不同检查方法与病理结果的一致性比较采用Kappa值表示。以P<0.05为差异有统计学意义。
2 结 果
2.1 ERUS和MRI对直肠癌术前T分期的准确性比较 术后病理结果显示,130例直肠癌患者中T1期3例、T2期40例、T3期58例、T4期29例。ERUS对直肠癌术前T1~T4分期的准确率分别为:33.3%(1/3)、60.0%(24/40)、86.2%(50/58)和82.8%(24/29),对T分期的总体准确率为76.2%(99/130)(Kappa值=0.627,95%CI:0.568~0.686,P<0.001)。MRI对直肠癌术前术前T1~T4分期的准确率分别为:0、 30.0%(12/40)、77.6%(45/58)和13.8%(4/29),对T分期的总体准确率为46.9%(61/130)(Kappa值=0.123,95%CI:0.063~0.183,P=0.031)。ERUS对直肠癌术前T1~T4分期的准确率以及T分期的总体准确率均高于MRI(均P<0.05)。见表1。在130例直肠癌的术前T分期中,ERUS高分期19例(14.6%),低分期12例(9.2%),而MRI高分期37例(28.5%),低分期32例(24.6%)。

表1 ERUS和MRI对直肠癌术前T分期的结果
2.2 ERUS和MRI对直肠癌术前N分期的准确性比较 术后病理结果显示,130例直肠癌中N0期81例、N1期48例、N2期1例。ERUS对直肠癌术前N分期的总体准确率为73.1%(95/130)(Kappa值=0.363,95%CI:0.288~0.438,P<0.001)。MRI对直肠癌术前N分期的总体准确率为51.5%(67/130)(Kappa值=0.160,95%CI:0.093~0.227,P=0.017)。ERUS对直肠癌术前N分期的总体准确率高于MRI(χ2=12.840,P<0.001)。见表2。
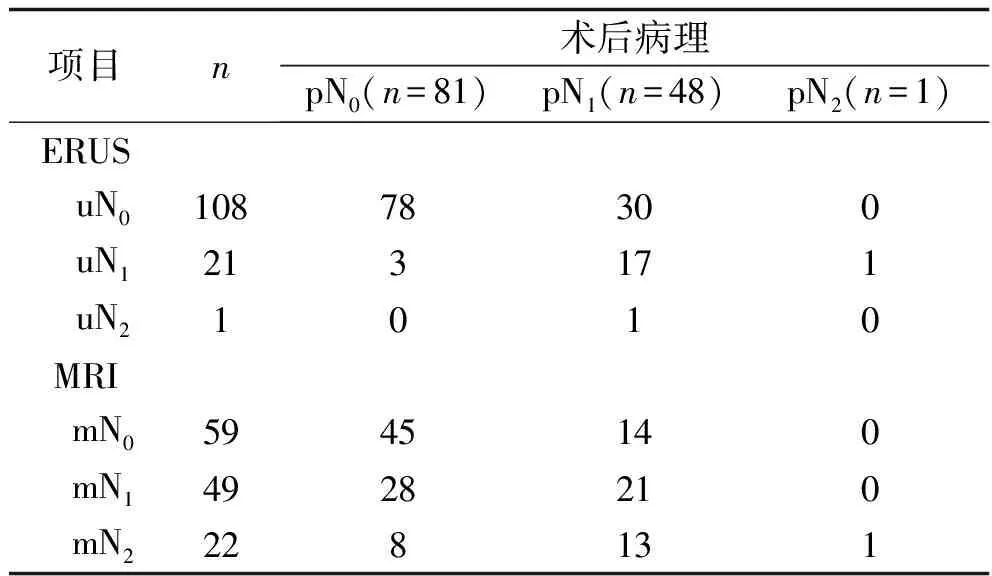
表2 ERUS和MRI对直肠癌术前N分期的结果
3 讨 论
在直肠癌的临床诊疗过程中,准确的术前分期对患者术前新辅助治疗或放疗的选择,手术方式及手术范围的确定,以及患者预后的判断均具有至关重要的作用[4]。由于不同的直肠壁层和周围组织其声阻抗不同,ERUS可以准确地区分被肿瘤破坏的直肠壁层的确切位置,并判断是否存在直肠周围淋巴结转移[5]。MRI通过磁场扫描能够提供良好的解剖和组织分辨能力,并能对肿瘤及直肠周围系膜做出准确的评估。因此,ERUS和MRI均是直肠癌局部分期的主要检查方法。
既往研究中,ERUS在直肠癌T分期中的准确率差异较大,其中一项研究显示ERUS判断T分期的准确率为69%[6],然而另一项研究则显示ERUS在直肠癌T分期评估中的准确率高达96%[7]。同样,MRI对直肠癌T分期的准确率差异也较大(55%~87%)[8-9]。本研究中,ERUS对直肠癌术前T分期的总体准确率为76.2%,高于MRI的准确率(46.9%)(P<0.05)。有学者认为,ERUS能够更加准确地区分肠壁层次,而MRI对直肠系膜筋膜的定义更加清晰,因此提出ERUS更适合于早期直肠癌(T1~T2期)的评估,而MRI对局部进展期的直肠癌(T3~T4期)的判断则更准确[10]。研究显示,临床中ERUS的准确率与操作者经验成正比,操作者实践时间更多、训练更细致可以使ERUS的准确率从58.0%提高到87.5%以上[11]。本研究中,ERUS对直肠癌术前T1~T4分期的准确性均高于MRI(均P<0.05),这可能与医院进行ERUS检查和判读的医师固定,而进行MRI检查评估的影像科医生相对不固定有关。
对直肠癌T2分期的准确率较低一直是ERUS和MRI共同存在的问题。本研究中,ERUS和MRI对40例T2期直肠癌的分期准确率分别为60%和30%,ERUS高分期16例(40%),MRI高分期28例(70.0%)。Akasu等[12]研究显示,2/3的T分期错误是由于高分期造成的,最常见的为T2期的直肠癌。Halefoglu等[13]研究也发现,ERUS和MRI的直肠癌高分期是造成分期错误的最主要因素,这些错误大多存在于T2期肿瘤中。造成T2期直肠癌高分期的原因可能在于影像学检查很难明确区分真正的肠系膜肿瘤侵犯和肿瘤周围的纤维化反应或炎症组织,而这些组织中可能并不存在肿瘤细胞[14]。
目前临床上尚无准确性令人满意的评估直肠癌局部淋巴转移的检查方法。一项Meta分析结果显示,在评估直肠癌局部淋巴结受累情况时,ERUS与MRI相比并没有显著差异[15]。本研究结果显示,ERUS对直肠癌术前N分期的准确率高于MRI(P<0.05)。ERUS判断淋巴结恶性转移的形态学特征包括:(1)低回声影;(2)形状圆形;(3)肿瘤周围的位置;(4)大小>5mm[9]。但是仅根据回声特征,可能会将炎症反应性淋巴结误认为恶性淋巴结,从而导致假阳性[16]。MRI检查也存在相似问题,最常用的评估淋巴结侵犯的标准是基于淋巴结的大小,但是淋巴结肿大可由炎症反应引起,仅仅依据结节大小并不能完全判定淋巴结是反应性的还是转移性的,而正常或体积小的淋巴结也有可能发生微转移[17]。有研究认为,直径<5 mm的淋巴结中约有20%含有肿瘤细胞,因此使用5 mm的大小标准或可预测淋巴结转移[18]。
综上所述,ERUS对直肠癌术前局部T分期和N分期的准确性高于MRI。但本研究为单中心研究,且样本量较少,结论还需要进行大样本、多中心研究验证。在临床实际中,ERUS检查费用较低,但患者的接受度较差,并且其对于狭窄性直肠肿瘤操作难度大,而MRI检查耗时长,费用相对昂贵,因此应根据患者实际情况选择合适的检查方法。

