高效液相色谱手性流动相添加剂法拆分愈创甘油醚对映体
翟明翚 韩 爽 王 颖 陈志伟 苏立强*
(齐齐哈尔大学化学与化学工程学院黑龙江齐齐哈尔 161006)
手性药物已广泛应用于心脑血管疾病、抗肿瘤、抗病毒及基因工程方面,因此手性药物是现在国际新药市场研究与开发的一个重要的方向。但是手性药物因其对映异构体与相应受体的相互作用能力不同,使手性药物表现出不同的生物活性,可能会给药物的疗效带来不利的影响。为了减少手性药物对人体产生的代谢负担或可能产生的毒副作用,对手性药物进行拆分研究是现在手性药物研究的重大课题和关注热点[1]。

图1 愈创甘油醚化学结构式Fig.1 Chemical structure of guaifenesin
愈创甘油醚(Guaifenesin),化学名称为3-(2-甲氧基苯氧基)丙烷-1,2-二醇,该药能祛痰镇咳,是多种止咳药的主要有效成分[2],可治疗急性呼吸道感染[3]、支气管炎、支气管哮喘、肺气肿、矽肺等病[4]。愈创甘油醚是一种手性药物,其结构式见图1。临床上该药以消旋体形式给药,关于此药的拆分方法仅见毛细管电色谱法[5-7]。
毛细管电色谱法拆分效果好,但是所使用电泳仪价格昂贵,不易普及。高效液相色谱手性流动相添加剂法,使用普通液相色谱仪和常规色谱柱,更容易普及。本文选用没有毒性的羧甲基-β-环糊精(CM-β-CD)作为手性添加剂,使用C18色谱柱,采用高效液相色谱法(HPLC)对愈创甘油醚对映体进行了拆分研究,在优化色谱条件下,对映体达到基线分离。
1 实验部分
1.1 主要仪器与试剂
P200Ⅱ高效液相色谱仪(大连依利特分析仪器有限公司),附Echrom98色谱工作站、UV200Ⅱ紫外检测器、P200Ⅱ高压恒流泵;SK1200超声波清洗器(上海科导超声仪器有限公司);HI 98128便携式酸度计(上海加惠仪器仪表有限公司)。
色谱纯甲醇、乙腈(天津市科密欧化学试剂开发中心);β-环糊精(β-CD)(中国医药集团上海化学试剂公司);羧甲基-β-环糊精(CM-β-CD)实验室制备;超纯水由GWB-2超纯水器(北京普析通用仪器有限责任公司)制备。
愈创甘油醚(武汉祥和化工有限公司)。
1.2 样品溶液的配制
准确称取愈创甘油醚0.0050 g,加水溶解后,转入10 mL容量瓶中并定容至刻度,经0.45 μm针筒过滤器过滤后备用,使用前超声脱气。
1.3 色谱条件
色谱柱:Hypersil ODS柱(200 mm×4.6 mm,5 μm);流动相:甲醇-乙腈-水(体积比为15∶70∶15)。CM-β-CD的浓度为0.5 g/L,pH=4.26;流速为0.2 mL/min;三乙胺浓度为0.1%(V/V);紫外检测波长:226 nm;进样量:4 μL。
2 结果与讨论
2.1 手性添加剂的选择
环糊精类添加剂具有内腔疏水、外腔亲水的特性,体积大小合适的药物对映体可进入空腔与其发生包合作用,又因其内部的手性识别能力[8],以及空腔边缘的极性基团的作用[9],药物对映体与其形成稳定性不同的非对映体包合物,产生的色谱行为差异使药物对映体得到分离。本文分别考察了添加剂为β-CD和CM-β-CD时愈创甘油醚对映体的拆分情况,结果见图2。从色谱图中可以看出:添加剂为CM-β-CD(图2(A))时,愈创甘油醚对映体没有分离,而添加剂为CM-β-CD(图2(B))时,愈创甘油醚对映体达到了基线分离。
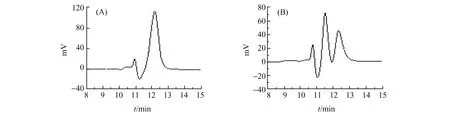
图2 愈创甘油醚对映体在添加剂β-CD(A)和CM-β-CD(B)中分离色谱图Fig.2 Guaifenesin separated by β-CD(A) and CM-β-CD(B) as mobile phase additivesdetection wavelength:226 nm;mobile phase:methanol∶acetonitrile∶water=15∶70∶15;pH=4.26;rate:0.2 mL/min.
2.2 流动相中CM-β -CD浓度对拆分的影响
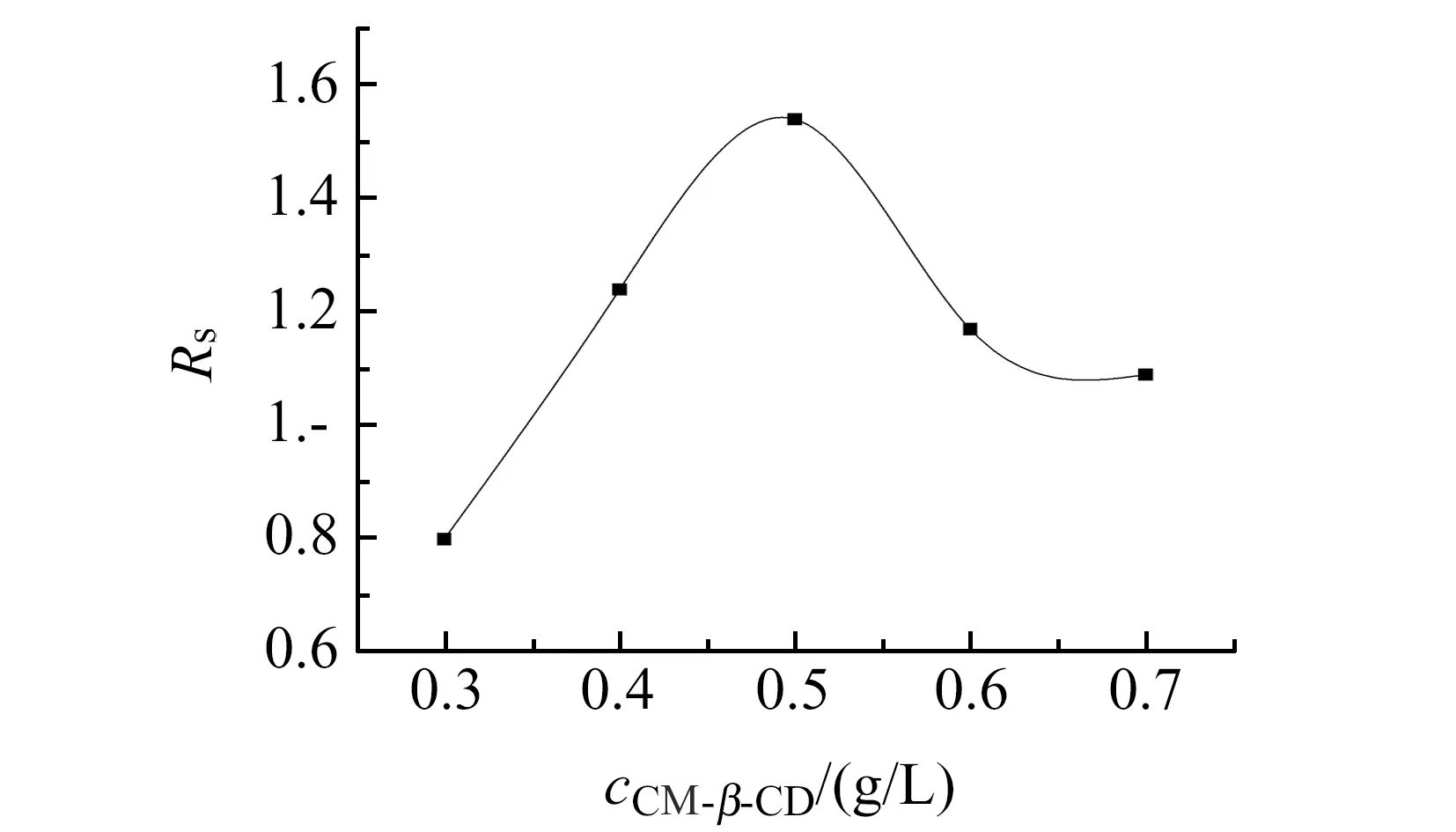
图3 CM-β-CD浓度对分离的影响Fig.3 Effect of concentrations of CM-β-CD on the resolution
一方面,药物对映体与吸附在固定相上的CM-β-CD发生包合作用;另一方面,药物对映体与游离的CM-β-CD发生包合作用,两方面作用均形成非对映体包合物,从而产生色谱行为差异使药物对映体得到拆分[10]。药物对映体与CM-β-CD的主-客体作用是立体选择性的,而且是可逆的。包合物的形成和扩散存在一种平衡,CM-β-CD的浓度可影响这种平衡,进而影响包合物稳定常数的差异及其在固定相表面作用的差异,影响对映体的拆分效果,从图3中可以看出CM-β-CD浓度的变化对分离度的影响。CM-β-CD浓度较低时,形成的对映体包合物的稳定性差,吸附作用弱,分离效果差;CM-β-CD浓度的增加,主客体之间的相互作用的机会增多,有利于增强它们之间的相互作用,立体选择性增强,形成的对映体包合物稳定性的差异及吸附作用的差异扩大,分离度Rs增大;当CM-β-CD的浓度过高时,游离的CM-β-CD吸附在固定相表面,与对映体包合物竞争作用位点,降低了包合物在固定相上的吸附作用,分离度下降。实验结果表明,CM-β-CD的最佳浓度为0.5 g/L。
2.3 有机修饰剂对分离的影响
有机修饰剂的极性影响CM-β-CD与对映体的包络平衡[11],因此可以通过添加合适的有机修饰剂改变包合物的形成常数,以改善分离。本实验选用甲醇和乙腈作为有机修饰剂,考察了不同配比的有机修饰剂对药物对映体的拆分情况,结果见表1。相同的条件下,在不同的有机修饰剂中的分离效果不同,可能的原因是:乙腈对愈创甘油醚的洗脱能力较弱,CM-β-CD与药物对映体形成的包合物的稳定性增强,色谱行为差异扩大,药物对映体分离效果好,但是CM-β-CD在乙腈含量较高的乙腈-水体系中的溶解度低,影响分离;甲醇的极性较强,在乙腈-水体系中加入适量的甲醇,可以增加CM-β-CD在体系中的溶解度,药物对映体与CM-β-CD发生包合作用的机会增多,并且保持流动相的极性,改变了流动相的洗脱能力[12],生成的非对映体络合物保留值差异增大,分离度提高;在甲醇含量较多时,甲醇进入CM-β-CD空腔降低了疏水作用,使愈创甘油醚对映体被置换到水相中,不能形成稳定的包合物,所以分离度较低;当甲醇、乙腈、水的体积比分别为15∶70∶15和20∶70∶10时,分离度Rs>1.5,拆分对映体药物效果良好。但当流动相比例为20∶70∶10时,对映体色谱峰出现严重的拖尾现象。综合考虑峰形和分离度,选择流动相中甲醇∶乙腈∶水=15∶70∶15进行拆分。

表1 流动相中有机修饰剂对分离的影响Table 1 Effect of organic modifier on the resolution
2.4 流动相pH值对分离的影响
pH值较低时,CM-β-CD带负电荷,愈创甘油醚含有可电离的羟基带正电荷,pH值的变化影响它们的电离状态。但是考虑到色谱柱的使用范围,考察pH值范围为3.50~4.50(图4)。实验结果表明,当pH值为4.26时,CM-β-CD的羧甲基发生电离作用带负电荷,愈创甘油醚的羟基带正电荷,两者产生强烈的静电作用,手性识别能力最强,形成的非对映体包合物的色谱行为差异最大,分离效果最好。
2.5 三乙胺对分离的影响
本实验使用三乙胺和冰HAc形成缓冲体系,调节流动相的pH值,以达到提高分离度的目的。同时,愈创甘油醚的醚键与C18柱上的硅羟基产生氢键,三乙胺作为改性剂,与C18柱上的硅羟基结合,可减少其拖尾[13],改善峰形,进而改善分离。但是三乙胺浓度的增加,又会降低对映体包合物在固定相上的吸附,使分离度下降。在优化的pH值条件下,考察了流动相中三乙胺体积浓度在0.04%~0.12%范围对于分离的影响(图5),结果表明当三乙胺含量为0.10%时,分离度Rs最大。

图4 pH值对分离度的影响Fig.4 Effect of pH on the resolution

图5 三乙胺体积浓度对分离的影响Fig.5 Effect of volume concentrations of triethylamine on the resolution
2.6 流速对分离的影响
药物对映体与手性添加剂CM-β-CD动态包合的过程相对较慢,当流速较快时,游离的CM-β-CD和所形成的非对映体包合物在固定相上的吸附作用弱,愈创甘油醚与CM-β-CD形成的包合物稳定性变差,导致分离效果不好;随着流速的降低,保留时间延长,稳定性增强,吸附作用增强,分离度提高,但速度过慢,扩散作用又会带来不利影响,使分离度降低。本文考察了0.1 mL/min至0.5 mL/min流速对分离的影响,结果表明当流速为0.2 mL/min时,分离效果最好。
2.7 方法的重现性
在优化色谱条件下,重复进样5次,两对映体保留时间的相对标准偏差分别为0.25%和0.27%,重现性好。
3 结论
本文通过优化色谱实验条件,实现了愈创甘油醚对映体基线分离,成功建立高效液相色谱手性流动相添加剂法拆分愈创甘油醚对映体的方法,为该药的进一步研究,提供了一种有效的分离手段。该方法选择性高,操作简单、经济,容易普及,可广泛应用于手性药物的拆分研究中。

