与草甘膦特异结合的核酸适配体筛选及应用
秦鸣蔚 张晓萌 靖 乐 宋玉竹 张金阳 夏雪山 韩芹芹
(昆明理工大学生命科学与技术学院云南昆明 650500)
草甘膦(Glyphosate)是由美国Monsanto公司在1970年初推荐的一种高效水溶性低毒除草剂[1]。草甘膦的抗性作物占全世界每年种植的1.2亿公顷转基因作物的80%以上,但是用于转基因抗除草剂作物的除草剂是否对这些作物和人类具有负面影响一直存在争议[2,3]。草甘膦主要抑制植物体内的胆碱酯酶,从而使其神经系统受到干扰,致使植物死亡[4]。它主要用来控制一年或者多年生的杂草,是一种世界上生产量最大的农药品种。自1996年以来,由于转基因大豆、玉米和油菜的生产,草甘膦使用量逐渐增加,所以其残留问题日益严重[5]。过多的草甘膦会通过径流、污水排放、大气挥发等方式进入到土壤、空气和水中,这会导致自然环境中各种生物的死亡,并且通过食物链的传递而引起人类食物中毒[6,7]。严重时,可直接进入到生物体内,导致人急性呕吐、慢性中毒和致畸[8]。
目前检测草甘膦的方法主要有分光光度法、酶联免疫分析法、气相色谱法与气相色谱-质谱联用法、液相色谱法与液相色谱-质谱联用法、离子色谱法、毛细管电泳法[9]等。但是这些方法存在容易受盐离子的影响、成本高、实验周期长、不易操作的缺点,对于草甘膦检测具有一定的局限性[10]。所以建立一种灵敏度高、特异性强、成本低的有效检测草甘膦的方法是非常有必要的。适配体相较于抗体而言有若干优点,如较强的稳定性、易于再生以及易于修饰,另外它们体积较小,可以在体外快速分离[11]。本文以草甘膦为靶标,运用体外指数富集配体系统进化(SELEX)技术,从ssDNA文库中筛选出特异性强、灵敏度高的核酸适配体[12,13]。这种核酸适配体可以初步检测植物中的草甘膦,促进基于核酸适配体快速检测方法的应用与发展,同时也为该试剂盒的开发奠定基础。
1 实验方法
1.1 主要仪器设备
TP600 PCR仪(日本,宝生物工程有限公司);Tanon、EPS300电泳仪(Tanon(中国));DelDocEz凝胶成像及分析系统(北京长流科学仪器公司);BXP-530恒温培养箱(上海博迅医疗生物仪器股份有限公司);BIOMATE3S分光光度计(Thermo);VB-10型pH计(美国,丹佛仪器有限公司);5424小型高速离心机(德国,Epperdorf);纯水仪(美国Millipore)。
1.2 实验材料
草甘膦(韦佰力扬化工集团);亲和填料Epoxy-activated Sepharose 6B(GE Healthcare,美国);ssDNA:5′-GACATATTCAGTCTGACAGCG(N40)GATGGACGAATATCGTCTAGC-3′;正向引物P1:5′-GACATATTCAGTCTGACAGCG-3′;反向引物P2:5′-GCTAGACGATATTCGTCCATC-3′;M13-47引物:5′-CGCCAGGG1TrrCCCAGTCACGAC-3′(上海生物工程公司合成);将随机ssDNA文库、P1、P2均用ddH2O配制成100 μmol/L溶液,贮存于-20 ℃冰箱中备用。NC膜(膜孔径0.45 μm)(美国PALL公司);pMD19-T、PCR所用试剂(日本TaKaRa公司)。偶联缓冲溶液,1 mol/L氨基乙醇,结合溶液(10 mmol/L KCl),洗脱溶液(不同浓度梯度)。
1.3 草甘膦的SELEX筛选
1.3.1 配基(草甘膦)与基质的偶联配基(草甘膦)与基质(Epoxy-activated Sepharose 6B)的偶联,方法参考GE Healthcare免疫亲和色谱说明书。
1.3.2 ssDNA文库纯化将ssDNA文库进行PCR扩增,文库扩增后的产物直接与胶回收试剂盒的溶胶液按1∶1 比例混合进行DNA片段回收。回收过后的DNA片段在金属浴中于95 ℃加热10 min,再冰浴10 min,使dsDNA变为ssDNA。
PCR的反应体系为3 μL ssDNA模板,2 μL正向引物(10 μmol/L),2 μL反向引物(10 μmol/L),5 μL 1×PCR Buffer,3 μL MgCl2,4 μL 脱氧核糖核苷三磷酸(dNTP),30.6 μL超纯水,0.4 μL Taq DNA聚合酶(最后加)。PCR反应条件:95 ℃变性5 min,95 ℃变性45 s,54 ℃退火30 s,72 ℃延伸30 s,进行32轮循环,然后72 ℃延伸7 min。
1.3.3 草甘膦核酸适配体的筛选将加入6 mL偶联缓冲液洗脱偶联过的基质(核酸适配体)混匀后离心,去掉上清液,重复3次。纯化好的100 μL ssDNA加到偶联过的基质中,在37 ℃(40 r/min)下孵育2 h。孵育后用2~3 mL超纯水冲洗柱子,再用5 mL的洗脱溶液(20 mmol/L KCl)进行线性梯度洗脱,收集洗脱液(每管1 mL)。最后将洗脱液与胶回收的溶胶液按照等比例进行混合,回收洗脱液,得到selex溶液。以胶回收产物作为模板,进行PCR扩增,用浓度2%的胶跑电泳进行验证。所得的ssDNA为下一轮的筛选文库,重复进行6轮筛选。
1.4 圆二色谱法对K+浓度与草甘膦核酸适配体A08关系的探究
将草甘膦核酸适配体A08用浓度为20 mmol/L Tris-HCl缓冲溶液(pH=7.2)稀释到20 μmol/L,在94 ℃变性30 min,以0.5 ℃/min的速度降至25 ℃。用含有不同浓度KCl溶液和20 mmol/L Tris-HCl缓冲溶液(pH为7.2)的混合溶液,将草甘膦核酸适配体A08稀释到2.5 μmol/L。于温度25 ℃下,在波长220~340 nm处用圆二色谱仪进行检测。
1.5 草甘膦核酸适配体A08最佳浓度的确定
将包被液与浓度为40 ng/μL的草甘膦溶液按照1∶1体积比,加入到有生物素标记的适配体的96孔板中,进行孵育、洗涤。用封闭液封闭非特异性结合的位点。再用1×磷酸盐缓冲液(PBS)将带有生物素标记的适配体稀释成不同浓度,向96孔板每孔中加入100 μL适配体溶液,进行孵育、洗涤。加入100 μL的HRP-Stretavidin(1∶1 000比例稀释),进行孵育、洗涤。往每孔中加入显色剂100 μL TMB溶液,在37 ℃条件下避光显色10 min。将25 μL的2 mol/L H2SO4加入到96孔板中,并且在反应结束前的10 min内,使用酶标仪测量每个孔在波长450 nm处的吸光度。
1.6 草甘膦核酸适配体A08亲和力和解离常数的测定
将20 ng/μL的草甘膦溶液与包被液按照1∶1的比例混合后,加入到96孔板中,每孔加入100 μL,用5%的脱脂奶进行封闭后,加入不同浓度带有生物素标记的草甘膦适配体A08,加带有链霉亲和素的HRP进行孵育,再加TMB进行显色,最终加入50 μL 2 mol/L H2SO4,在反应终止的10 min内,使用酶标仪在波长450 nm处测量吸光度。
2 结果与讨论
2.1 SELEX筛选和测序结果
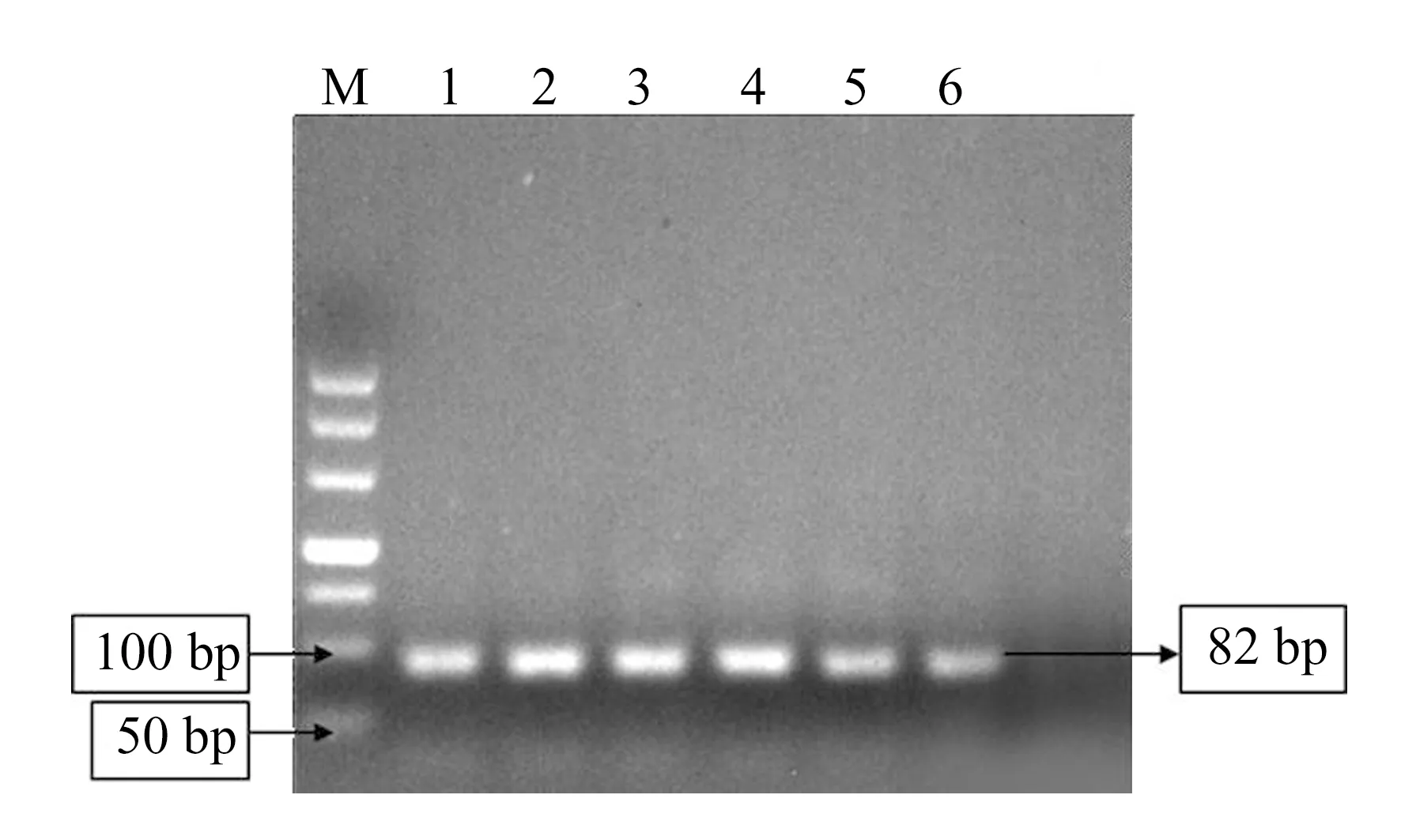
图1 草甘膦适配体通过SELEX技术经过6轮筛选结果Fig.1 Results of glyphosate aptamers passed 6 rounds of screening by SELEX technique1:SELEX-One;2:SELEX-Two;3:SELEX-Three;4:SELEX-Four;5:SELEX-Five;6:SELEX-Six.
由于PCR过程中有可能会发生突变或其他导致序列的改变,因此需要通过克隆测序来确认所扩增的条带是否为合适的序列,只有确认之后才能进行后续实验。首先将经第6轮筛选得到的ssDNA进行PCR,PCR过后进行跑胶实验,过后进行胶回收,收集目的片段。将目的片段与PMD19-T载体进行连接,从-20 ℃冰箱取出感受态细胞后放冰上15~20 min。取10 μL的PMD19-T加入到100 μL感受态细胞中,用枪头吹打混匀,冰上放置30 min。再将水浴锅调至42 ℃温育90 s后,放置冰上5 min,加入890 μL含有氨苄青霉素的LB培养基。37 ℃(100 r/min)摇菌1 h后,5 000 r/min离心3 min,舍弃500 μL上清液,然后吹打混匀。取200 μL进行涂板,培养14 h后挑单克隆进行菌液培养,将摇好的菌液进行测序。
将ssDNA从亲和层析柱Sepharose 6B洗脱下来,洗脱下来的溶液与胶回收溶液按照体积比1∶1混合,用TE溶液进行洗脱。以洗脱的溶液为模板进行PCR,然后对每一轮的PCR产物进行核酸电泳。图1为草甘膦适配体1~6轮筛选结果,从图中可知得到了特异性较好的草甘膦适配体,适配体的长度为82 bp。将筛选好的第6轮草甘膦适配体进行跑胶,跑胶后进行切胶,再与胶回收溶液1∶1进行混合,用PMD19-T载体进行单克隆过后进行测序,经筛选后得到测序出现频次高,且具有G-四链体结构的草甘膦核酸适配体A08(表1)。

表1 草甘膦核酸适配体A08的序列Table 1 Sequence of glyphosate nucleic acid aptamer A08

图2 草甘膦适配体二级结构预测图Fig.2 Prediction structure of glyphosate aptamer secondary structure
2.2 草甘膦适配体A08二级结构预测
测序后的一组核酸序列通过Align X软件进行序列比对,然后使用MFOLD(网址为http://mfold.rna.albany.edu/?q=mfold/DNA-Folding-Form),在26 ℃,Na+浓度为150 mmol/L,Mg2+浓度为1 mmol/L的条件下预测适配体的结构。再通过QGRS映射软件(http://bioinformatics.ramapo.edu/QGRS/analyze.php)确定草甘膦适配体A08是否具有G-四链体结构。
在MFOLD和QGRS平台上分析草甘膦适配体A08的二级结构,它的二级结构含有突出的环和茎,并且存在G-四链体结构,吉布斯自由能ΔG=-16.78(图2)。因此该结构具有较高的稳定性。
2.3 圆二色谱法测定K+对核酸适配体A08的影响

图3 核酸适配体A08在不同浓度K+条件下和在PBS中的圆二色谱图Fig.3 Circular dichroism of nucleic acid aptamer A08 at different concentrations of K+ and in PBS
为了证实K+对适配体的结合活性是否有影响,通过圆二色谱法(CD)研究了适配体在K+结合之前和之后的构象变化。图3显示K+具有极弱的CD信号,而适配体分别在约280 nm和245 nm处呈现正峰和负峰,这与报道的单链寡核苷酸的CD谱一致。当游离的K+与适配体结合形成ssDNA-K+复合物时,280 nm与245 nm处的特征峰仅略微改变。这表明K+与适配体嵌入形式的结合并不会影响适配体的结合活性。
2.4 草甘膦核酸适配体A08的特异性
为了确定筛选出来的适配体A08是否具有特异性,本文采用了ELONA法测定带有生物素标记的草甘膦适配体A08在波长450 nm处的吸光度。将包被液和草甘膦按照1∶1体积比进行混合,将混合液加入到96孔板上,使得每个孔的终浓度为40 ng/μL,每孔加100 μL,进行孵育、洗涤。同时设立空白对照和阴性对照(对照组将草甘膦换成其他的结构类似物)。在包被有草甘膦的96孔板上,每个孔加入100 μL封闭液,进行孵育、洗涤。将带有生物素标记的草甘膦适配体A08稀释至100 μL的工作浓度,进行孵育、洗涤。加入100 μL 的HRP-Stretavidin(1∶1 000比例稀释),进行孵育、洗涤。往每孔中加入显色剂TMB溶液100 μL,在37 ℃条件下,避光显色10 min。最后往每孔中加入25 μL 2 mol/L H2SO4,并且在反应结束前的10 min内,使用酶标仪测量每个孔在波长450 nm处的吸光度。如图4所示,以脱脂奶和生物素作为空白对照,防止出现假阳性,以鹅膏毒素等作为阴性对照,结果显示草甘膦适配体A08只和草甘膦产生特异性结合。
采用Dot Blot法测定草甘膦核酸适配体A08的特异性[14]。如图5所示,当加入5 μL 40 ng/μL的草甘膦和100 nmol/L的草甘膦适配体A08时,草甘膦适配体与草甘膦特异性结合。

图4 以脱脂奶、生物素作为空白对照和以其他毒素蛋白作为阴性对照的分析特异性Fig.4 Analytical specificity of glyphosate aptamers using skim milk,biotin as blank controls and other toxins and proteins as negative controls

图5 草甘膦核酸适配体的特异性分析Fig.5 Specificity analysis of glyphosate nucleic acid aptamer
2.5 确定草甘膦核酸适配体A08最佳浓度
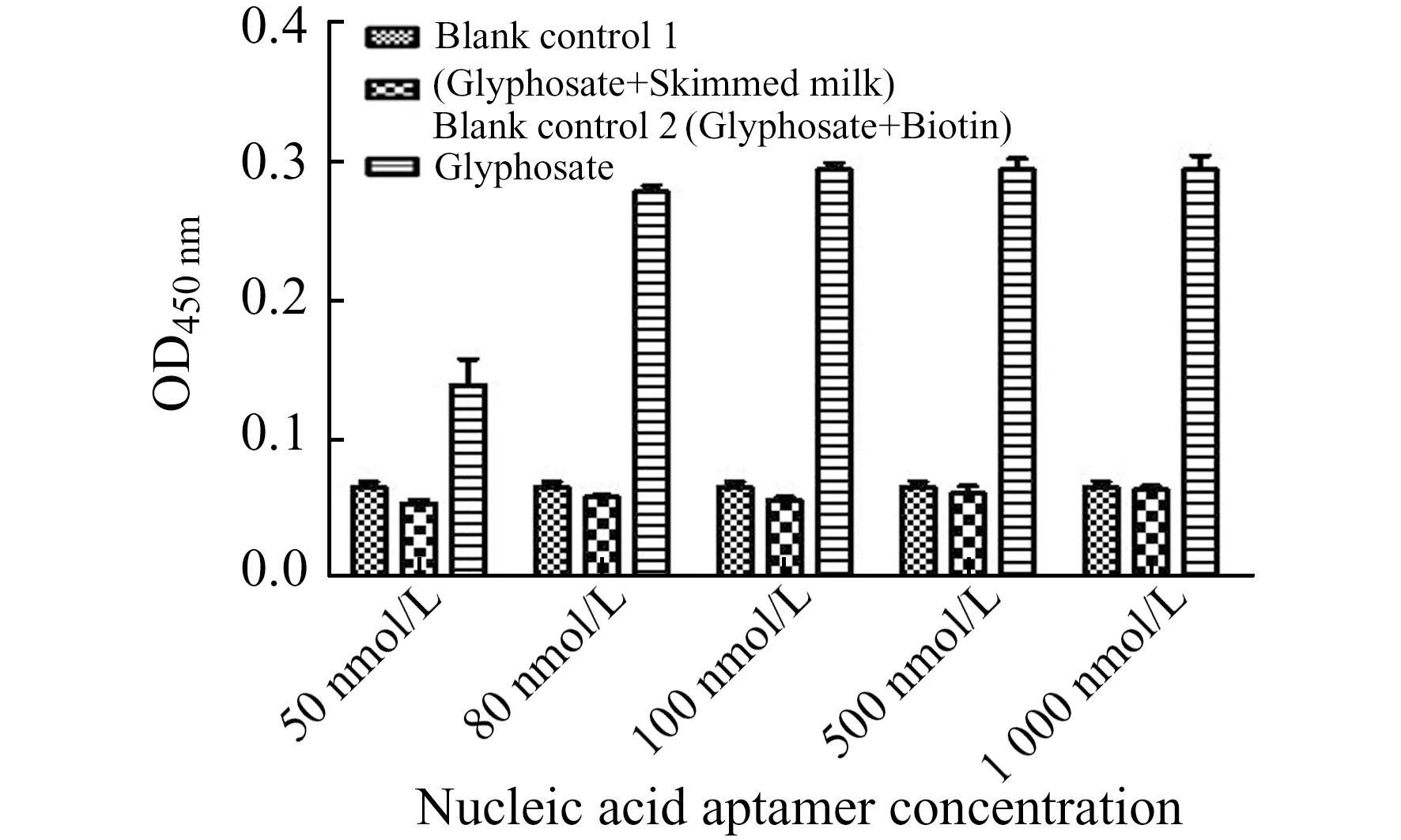
图6 以脱脂奶和生物素作为空白对照的草甘膦核酸适配体最佳浓度Fig.6 Optimal concentration of glyphosate nucleic acid aptamers using skim milk and biotin as blank controls
为了确定草甘膦核酸适配体A08最佳浓度,在加入一定浓度草甘膦后,加入不同浓度适配体溶液。如图6所示,当草甘膦浓度确定时,草甘膦核酸适配体A08浓度为100 nmol/L时特异性达到饱和,因此草甘膦核酸适配体A08的最佳浓度为100 nmol/L。
2.6 测定草甘膦的灵敏度
为了确定测定草甘膦灵敏度,在加入100 nmol/L核酸适配体A08后,加入不同浓度的草甘膦溶液。如图7所示,当核酸适配体A08浓度确定时,草甘膦浓度为4 ng/μL 时具有特异性,结果表明适配体A08能检测到草甘膦的检测限为4 ng/μL。
2.7 草甘膦核酸适配体A08对靶标亲和力的测定
为了确定草甘膦核酸适配体A08对其靶标的亲和力,确定了解离常数(Kd值)。图8显示草甘膦适配体A08的解离常数Kd=38.38±9.094 nmol/L,得到饱和标准曲线,证明筛选的核酸适配体A08具有高亲和力。

图7 方法的灵敏度分析Fig.7 The sensitive analysis of this method using skim milk as a blank control

图8 草甘膦核酸适配体与靶标之间的亲和力测定Fig.8 The determination of affinity between the nucleic acid aptamer and the target
2.8 检测实际食物样品中的草甘膦
为了证明ELONA法在检测实际样品中的准确性和可行性,分别从四个不同的杂货店购买了可能含有草甘膦的食物,包括玉米、大豆、白菜、菠菜、板栗。首先进行了亚硝化分光光度法测定,具体过程参照我国国家标准(GB 20686-2006),再通过ELONA法实验来检测样品。实验结果(表2)显示,ELONA法得到的回收率与国标法测定的回收率一致,因此用ELONA法检测食品中的草甘膦具有较高准确性。
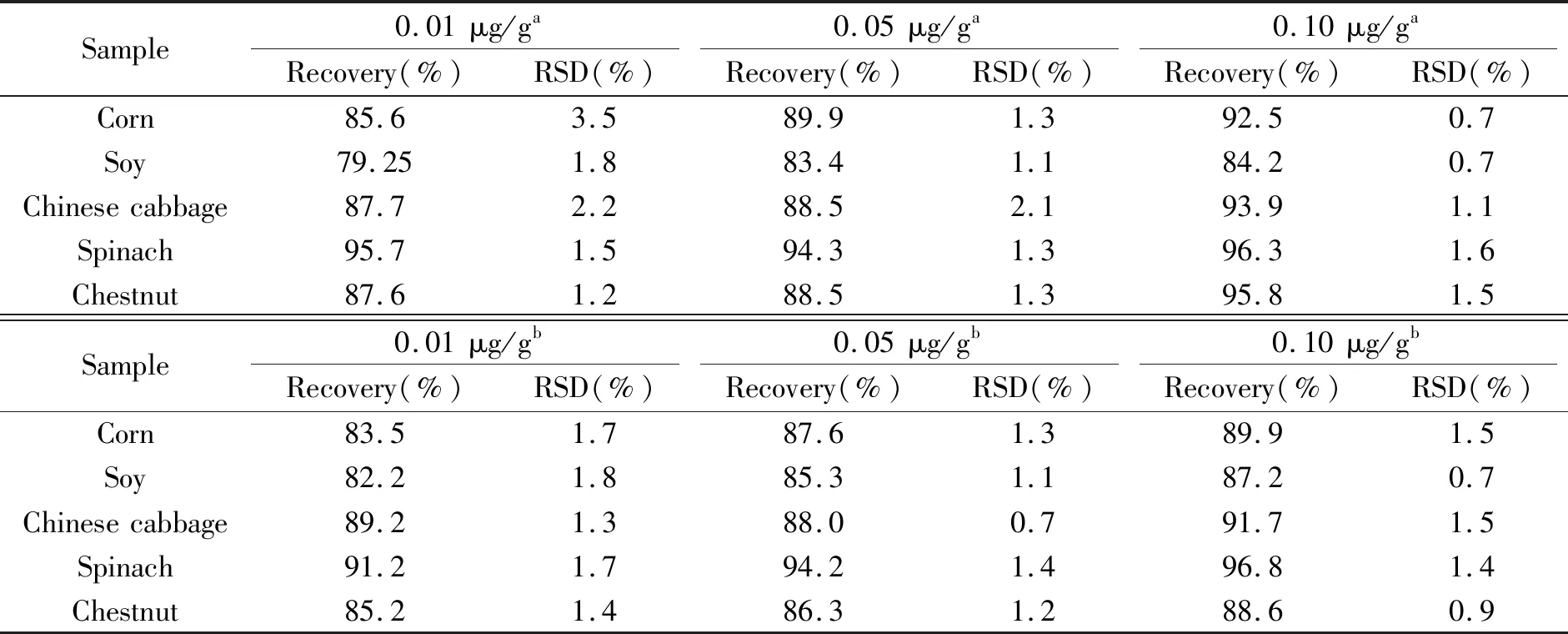
表2 食品中草甘膦含量测定方法的比较Table 2 Comparison of determination method of glyphosate in food
a:nitrosation spectrophotometry(national standard method);b:this method.
3 结论
本文通过SELEX技术筛选出一种具有高特异性、高亲和力、高灵敏度的草甘膦核酸适配体A08,并且对它的特异性和灵敏度进行了检测。经过多轮严苛条件下的筛选,确保适配体的特异性。通过ELONA试验证明筛选出来的适配体A08具有特异性。该技术为适配体的发展和应用提供了新的方法和思路。

