银纳米粒子信号放大检测天蚕素B的研究
苏秀霞 徐 佳 张 婧 杨 冬 刘 欢
(1.陕西科技大学教育部轻化工助剂化学与技术重点实验室陕西西安 710021;2.咸阳职业技术学院陕西咸阳 712000)
近年来,由于抗生素的滥用使得细菌产生抗药性,从而导致许多“超级细菌”出现[1]。由于抗菌肽的杀菌机制与抗生素不同[2],在杀死致病细菌的同时不会对正常细胞造成损伤,因此抗菌肽在一定程度上可以取代抗生素。天蚕素作为一种最早被发现抗菌肽,能够有效抑杀细菌[3,4]、病毒[5]、癌细胞[6,7]等,而且由于其良好的性能,已被广泛应用于动物饲料添加剂、抗病基因等领域。目前检测抗菌肽的主要方法有液晶生物传感器[8-10]、免疫分析法[11]、酶联免疫吸附法(ELISA)[12]等。但是上述检测手段存在操作复杂、耗时长、成本高且灵敏度较低等问题。因此,寻找一种具有灵敏度高、特异性好的检测方法迫在眉睫。
液晶生物传感器作为一种基于液晶垂直取向变化构建的新型生物传感器,由于其具有较高的灵敏度,良好的特异性,较低的检测限,已被广泛应用于核酸、氨基酸、蛋白质、重金属离子等领域的检测。张姣等[13]利用液晶所具有的双折射特性构建新型液晶免疫传感器,并采用竞争免疫法实现了对天蚕素B(CB)的检测;Shen等[14]基于单链DNA之间的互补配对会造成基底表面形貌发生较大变化的原理,构建了一种液晶生物传感器并用于单链DNA的检测;Yang等[15]利用液晶生物传感器的高灵敏性实现了对Hg2+的检测,其通过诱导靶向DNA作为信号放大,使得Hg2+的检测限低至0.1 nmol/L。
银纳米粒子(AgNPs)因为其良好的生物相容性,已被广泛应用于蛋白质[16,17]、核酸[18]、重金属离子[19]等的检测。Wei等[20]基于AgNPs的等离子共振原理,实现了利用AgNPs比色法对小牛肠碱性磷酸酶A(CIAP)和蛋白激酶A(PKA)的检测。当存在CIAP或者PKA时,基底表面的三磷酸腺苷(ATP)将会被分解,使其无法将溶液中的AgNO3还原为AgNPs,而当不存在CIAP或者PKA时,基底表面的ATP会将AgNO3还原为AgNPs,从而使溶液呈现浅黄色,CIAP的检测限为1 U/mL,PKA的检测限为0.02 U/mL。冯娟娟等[21]基于多巴胺可以还原AgNO3,发现多巴胺的浓度在0.05~16 μmol/L时,检出限可低至0.04 μmol/L。本文结合AgNPs与液晶生物传感器的优点,以AgNPs为信号放大器,构建了一种新型生物传感器并实现对微量CB的检测。构建的基于AgNPs信号放大的液晶生物传感器检测灵敏度高、特异性好,检测限可以低至1.02 ng/mL。
1 实验部分
1.1 仪器与试剂
XPL3230型透反两用数码偏光显微镜(上海光学仪器一厂);Lambda25型紫外-可见分光光度计(珀金埃尔默责任有限公司);SPI3800N/SPA400型原子力显微镜(日本,精工有限公司);OCA20视频光学接触角(德国,Dataphysics公司);载玻片(江苏飞舟玻塑有限公司);Mylar聚酯片(广州市斯朗特电子科技有限公司)。
N,N-二甲基十八烷基(3-三甲氧基硅丙基)氯化铵(DMOAP)、3-氨丙基三乙氧基硅烷(APTES)、N-(3-二甲基氨基丙基)-N′-乙基碳二亚胺盐酸盐(EDC)、N-羟基丁二酰亚胺(NHS)(分析纯,美国Sigma公司);天蚕素B(CB)、天蚕素B抗体(anti-CB)(分析纯,英国Abcam公司);4-氰基-4-戊基联苯(5CB)(分析纯,美国Instec公司);戊二醛(GA)、NaBH4、AgNO3(分析纯,国药集团化学试剂有限公司),其余试剂均为分析纯。实验用水为超纯水。
1.2 AgNPs的制备
在制备时所用的玻璃器皿及搅拌棒均需用新配制的王水浸泡。AgNPs的制备方法有很多,如化学还原法[22-25]、光催化法[26,27]、超声还原法[28]等。最常用的方法是化学还原法中的柠檬酸钠还原法[29,30]和NaBH4[25,31]还原法。本文采用Lee[25]的方法,以NaBH4作为还原剂,并在此基础上进行调整以制备出粒径较小的AgNPs。在冰浴的条件下,将150 mL的NaHB4溶液(2.0 mmol/L)加入到三口烧瓶中,再将50 mL的 AgNPs溶液(2.5 mmol/L)快速加入到NaBH4溶液中。剧烈搅拌0.5 h后,升温至80 ℃,反应1 h 以除去溶液中多余的NaBH4。将所得黄绿色溶液冷却至室温后,加入200 μL 6.7 mmol/L的3-巯基丙酸(MPA),搅拌12 h后,即可得到所需的AgNPs,移至储瓶中备用(低温避光储存)。
1.3 玻片的预处理
将清洗干净的玻片裁剪为2.5 cm×2.5 cm大小后,放入Piranha溶液(H2O2∶H2SO4=3∶7)浸泡 2 h,分别用超纯水和乙醇冲洗干净,并用氮气吹干,在110 ℃的条件下烘干3 h(注意防尘),待用。
上玻片处理:将上述烘干待用的玻片浸泡在1%(体积分数)的DMOAP溶液中,在常温下浸泡0.5 h后,用超纯水冲洗干净,氮气吹干,在110 ℃下烘干2 h(注意防尘)。
下玻片处理:将上述烘干待用的玻片浸泡在APTES∶DMOAP=5∶1(V/V)的乙醇溶液中,在80 ℃下浸泡2 h,分别用超纯水和乙醇冲洗干净,氮气吹干,在110 ℃下烘干2 h,然后将其浸泡在含有2%(体积分数)GA的磷酸盐缓冲溶液(PBS,pH=7.4)中,于37 ℃下浸泡1 h,分别用PBS和超纯水冲洗干净,氮气吹干(注意防尘)。
1.4 AgNPs修饰CB复合物的制备
由于AgNPs具有极高的吸光系数,因此当不同浓度的蛋白质与AgNPs复合后,导致AgNPs微粒间距的不同,会出现从黄色到灰褐色至无色的颜色变化。因此,利用AgNPs的颜色变化这一性质来确定anti-CB溶液的固定量[21]。蛋白质与AgNPs复合时有两种结合方式:共价结合和非共价结合。非共价结合主要有氢键、范德华力、静电作用等,共价结合一般是通过巯基实现蛋白质和AgNPs的共价偶联。由于anti-CB不含巯基,因此利用EDC/NHS使得AgNPs与anti-CB共价结合。
取1 mL的AgNPs,依次加入新配制的0.02 mmol/L的EDC溶液10 μL和0.1 mmol/L的NHS溶液5 μL,对AgNPs表面的羧基进行活化,0.5 h后加入10 μL的anti-CB溶液(0.33 mg/mL),混合摇匀后静置2 h,使anti-CB中的氨基与AgNPs表面的羧基充分反应,即AgNPs与anti-CB结合成功。
1.5 AgNPs修饰anti-CB复合物的固定
将100 μL不同浓度AgNPs修饰anti-CB的复合物溶液,滴加在经下玻片处理的玻片表面,在恒温摇床中于37 ℃下反应2 h,经PBS(pH=7.4)和超纯水冲洗以除去未固定的AgNPs修饰anti-CB的复合物,并用氮气吹干,冷藏保存。
1.6 CB的检测
在37 ℃下将经处理的下玻片浸入60 mmoL/L甘氨酸溶液中0.5 h,以封闭未反应完的醛基。然后将100 μL不同浓度的CB溶液滴加到经甘氨酸处理的玻片表面,在恒温摇床中于37 ℃下反应2 h后,使抗原抗体发生特异性结合,经PBS和超纯水冲洗以除去未固定的CB,氮气吹干,冷藏保存。
1.7 液晶池的制备
将经步骤1.3节处理的玻片面对面组装,两玻片之间采用Mylar聚酯片隔开,并将未开孔的三个方向用夹子固定。将液晶(5CB)加热至40 ℃,恒温10 min,当其从浑浊状态变为澄清状态后,取8 μL从开孔处加入到液晶池中。待液晶池自然冷却至室温后,利用偏光显微镜观察其光学成像。
1.8 接触角检测
采用OCA20视频光学接触角测试仪测试基底表面的接触角大小,用取样器吸5 μL的超纯水滴在基底表面,进行测试。
1.9 基底表面原子力显微镜的测定
使用原子力显微镜(AFM)对组装有AgNPs修饰CB的基底表面进行测试,AFM图像以接触模式获得,扫描速率为1.2 Hz,扫描范围为2 μm×2 μm。
2 结果与讨论
2.1 实验原理
液晶生物传感器的检测原理如图1所示。首先需对玻片表面进行酸处理(图a),使得基底表面产生大量羟基,再利用APTES/DMOAP对基底表面进行烷基化修饰(图b)。DMOAP作为有机长链可以对液晶分子的垂直取向形成有效诱导[32]。APTES+GA作为功能基团可以将AgNPs修饰的anti-CB固定到基底表面(图g)。CB可以与anti-CB发生特异性免疫,从而被固定到基底表面。与未使用信号放大的直接免疫法检测天蚕素相比(图f),AgNPs具有较大的比表面积,可以对液晶的垂直取向形成更大的扰乱,起到信号放大的作用(图j)。

图1 基于AgNPs信号放大的液晶生物传感器检测原理图Fig.1 Schematic diagram of liquid crystal biosensor detection based on AgNPs signal amplification
2.2 APTES/DMOAP/GA的比例优化
基底的修饰将直接影响到液晶分子的排列方式,从而影响最终的光学成像。因此,需对APTES/DMOAP/GA的比例进行优化。DMOAP作为n>12的硅烷长链,可以诱导液晶分子进行垂直排列。APTES+GA作为功能基团,用来将生物分子固定到基底表面。如图2所示,当APTES/DMOAP的比例(体积分数)较大时(图2d、2e),对液晶分子扰乱程度非常大,不利于下一步的观测。而当APTES/DMOAP的比例较小时(图2a、2b),虽然图像背景为黑色,但不利于下一步GA的固定。因此,选取5∶1为APTES/DMOAP的最佳比例。

图2 不同比例(体积分数)APTES/DMOAP的光学图像Fig.2 Optical images of different volume fractions of APTES/DMOAP (a)1∶1;(b)3∶1;(c)5∶1;(d)15∶1;(e)25∶1.
GA的一个醛基与APTES的氨基反应,而另一个醛基与anti-CB上的氨基反应,从而将Anti-CB固定到基底表面。当基底表面所固定GA越多,anti-CB被固定到基底表面的概率也将增大。因此,需对GA的含量进行优化。如图3所示,当GA含量过高(图3c~3e),液晶分子被极大地扰乱,影响下一步的检测,而当GA含量为2%时,此时光学背景呈现黑色(图3b)。因此,选择GA最佳含量为2%。

图3 不同GA含量的光学图像Fig.3 Optical images of different GA contentsGA content(volume fraction):(a) 0%;(b) 2%;(c) 4%;(d) 6%;(e) 8%.
2.3 基底接触角表征
利用水接触角测试仪对基底表面的接触角进行测试以确定APTES、DMOAP是否被固定到基底表面。如图4所示,与裸玻片(图4a)相比,加入DMOAP(图4b)和APTES(图4d)的接触角都明显增大,但是APTES的另一端为氨基,氨基作为亲水基团,使得其接触角与DMOAP相比较小。APTES/DMOAP为APTES、DMOAP的混合溶液,因此接触角应介于APTES、DMOAP之间,图4c与此相符。因此,可以进一步确定APTES、DMOAP被固定到基底表面。

图4 不同基底的接触角Fig.4 Contact angle of different substrates(a)Slides;(b)DMOAP;(c)APTES/DMOAP;(d)APTES.
2.4 AgNPs的紫外-可见光谱表征
如图5所示,在室温下对AgNPs和AgNPs修饰anti-CB进行紫外-可见光谱表征。AgNPs的特征吸收峰在波长390~440 nm之间,由于NaBH4作为还原剂,使得AgNPs的粒径较小[33],因此其特征吸收峰在394 nm处(图5a),即证明AgNPs制备成功。与图5a相比,图5b的吸收峰红移了9 nm,且吸光度明显下降,说明anti-CB与AgNPs成功结合[34]。
2.5 原子力显微镜表征
为了进一步观测AgNPs修饰anti-CB与待测物CB是否固定在传感器基底表面,我们对基底表面进行原子力显微镜表征。如图6所示,对比加入AgNPs修饰anti-CB复合溶液前后的图像,可以发现在加入AgNPs修饰anti-CB复合溶液后(图6b),基底表面最高点到最低点间距(LVPH)明显增大,为30 nm,且基底表面的粗糙度增大,表明AgNPs修饰anti-CB被固定在传感器基底表面。

图5 AgNPs与AgNPs修饰anti-CB的紫外-可见(UV-Vis)光谱Fig.5 UV-Vis spectra of AgNPs and AgNPs modified anti-CB

图6 不同基底表面原子力显微镜(AFM)图Fig.6 AFM diagrams of different substrate surfaces(a)GA;(b)AgNPs modify anti-CB.
2.6 AgNPs修饰anti-CB含量的优化
如图7所示,当AgNPs修饰anti-CB浓度过高时,液晶分子的垂直取向将会受到较大的干扰,在偏光显微镜下观察到的光学图像将会出现许多亮斑(图7d、7e),而当AgNPs修饰anti-CB浓度太低时,无法对液晶分子的垂直排列造成影响,背景将为黑色(图7a、7b)。因此,需要对AgNPs修饰anti-CB浓度进行优化。当AgNPs修饰anti-CB的浓度为60 ng/mL时,所观测的图像为黑色,有利于待检测CB的固定。因此,选择AgNPs修饰anti-CB的最佳浓度为60 ng/mL。

图7 固定不同浓度AgNPs修饰anti-CB的光学图像Fig.7 Optical images of modified anti-CB with different concentrations of AgNPs (a)20 ng/mL;(b)60 ng/mL;(c)100 ng/mL;(d)200 ng/mL;(e)500 ng/mL.
2.7 CB的检测
CB与anti-CB发生特异性免疫反应后,可以有效地固定在玻片表面,通过观测固定CB后的光学信号变化可以确定待检测CB的浓度。如图8所示,当待检测的CB浓度太高时(图8e)图像有大量的亮斑出现,当待检测的浓度过低时(图8a)所固定的CB不足以影响液晶的取向,背景为全黑色。因此,待检测CB的浓度为20 ng/mL以上,可以检测出CB。

图8 不同浓度CB的光学图像Fig.8 Optical images of different concentrations of CB(a)10 ng/mL;(b)20 ng/mL;(c)40 ng/mL;(d)100 ng/mL;(e)500 ng/mL.
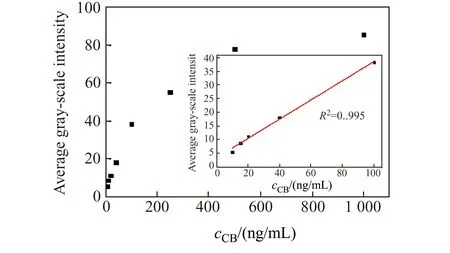
图9 不同浓度CB的光学图像及其所对应的灰度值之间的关系Fig.9 Relationship between optical images of different concentrations of CB and their corresponding gray values
2.8 线性范围和检出限
为了进一步对CB进行定量检测,探究了不同浓度CB的光学图像,及其图像与所对应的灰度值之间的相关性。如图9所示,随着CB浓度的增加,其图像所对应的的灰度值亦随之增大。结果表明:当CB的浓度在10~100 ng/mL之间时,浓度与对应图像灰度值呈线性相关:y=0.353x+3.32,相关系数R2=0.995,检出限为1.02 ng/mL。与其他方法相比检出限[8]降低了49倍。
3 结论
本文采用银纳米粒子作为信号放大器,利用化学偶联,成功修饰天蚕素B抗体,并用于对天蚕素B的检测,与未采用银纳米粒子信号放大的方法相比,本文所采用方法的检出限降低了49倍。

