金属与盐溶液反应后成分判断问题的探讨
杨文翠
(云南省普洱市景东县民族中学 676299)
要想知道金属活动性在强弱上的顺序,最为科学、合理、有效的方法就是看金属单质是否能和盐溶液发生反应,也就是根据金属活动性顺序表:“前金换后金”,即在盐溶液中活动性强的金属能置换活动性弱的金属.所以,根据金属与盐溶液的反应,尤其是牵涉到多种金属的置换反应,能够促使学生的思维能力和分析能力得到极大的提升,而这也成为了考试中考查学生能力的重要考题,在课堂教学中,也成为了教师和学生的一大重难点.下面就如何突破这一教学重难点谈谈笔者的做法.
一、认清反应本质,归纳两个原则
例1在AgNO3、Cu(NO3)2的混合溶液中加入一定量锌粉,充分反应后过滤,得滤渣和滤液.
①若滤液呈无色,则滤渣中一定含有的物质是____(填化学式);
②若向滤渣中滴加稀盐酸,无明显现象,则滤液中所含溶质的成分可能有____种情况.

1.优先原则.在溶液中加入金属,最为活泼的金属优先形成溶液,通过由强到弱的方式排列金属活动性,最不活泼的金属成为滤渣的概率会不断增长.就上面例题而言,首当其冲的溶质一定是Zn(NO3)2,其次是Cu(NO3)2,最后是AgNO3;而以滤渣成分来说,第一位的是Ag,然后是Cu,最后是Zn.具体如下,在溶液中如果存在溶质,那么非Zn(NO3)2莫属,如果存在两种溶质,那么非Zn(NO3)2与Cu(NO3)2莫属;如果存在三种溶质,那么Zn(NO3)2、Cu(NO3)2、AgNO3三者都会出现.滤液的成分只存在这三种可能性,不会出现其他的可能性.假设溶液中的溶质只有Cu(NO3)2因为[Cu(NO3)2的优先度不如Zn(NO3)2,所以这种假设是错误的];又假设溶液中的溶质只有Zn(NO3)2、AgNO3[因为AgNO3的优先度不如Cu(NO3)2,不可能出现只有AgNO3而没有Cu(NO3)2的情况,所以这种假设也是错误的].同理,Ag一定出现在滤渣的成分中,滤渣的成分就不在详细的叙述了.
2.不共存原则.在同一个容器中,不可能共存活泼金属与不活泼金属离子的盐溶液.比如例1中各物质充分反应后,如果锌粉出现在烧杯的底部,那么Cu(NO3)2或AgNO3绝对不会出现在溶液之中;反之,在溶液中如果还有AgNO3剩余,那么就一定不存在Zn或Cu单质.
二、运用两个原则,解决实际问题
例2将一定量的锌粉和铁粉加入到氯化铜溶液中,充分反应后过滤,得到滤液和滤渣,将少量稀盐酸加入到滤渣中,就会出现气体,那么下列说法正确的是( ).
①在固体中有锌的存在;②铜不会出现在固体中;③在固体中有铁的存在;④在溶质中有氯化锌的存在;⑤氯化亚铁不会出现在溶质中;⑥氯化铜不会出现在溶质中.
A.①③④⑤ B.②④⑥ C.③④⑥ D.③⑤⑥
分析在这一题中分别出现了锌、铁、铜三种金属.金属活动性为:Zn>Fe>H>Cu.则:

充分反应后的滤渣中,一定存在置换后的铜,也有可能存在未反应完的锌和铁.而滤液中,就一定会有ZnCl2,同时还可能存在FeCl2和CuCl2.在此题中还要注意一个实验现象,那就是将盐酸加入到滤渣中会出现气体,也就是说滤渣中除了Cu(Cu与盐酸不能发生反应),还会存在一种金属,能够与盐酸发生反应并形成气体(即Zn或Fe).故结合优先原则可得出:滤渣中除了Cu外,一定还有Fe,可能会有Zn;再根据不共存原则:滤液中一定有ZnCl2,可能会有FeCl2,一定没有CuCl2.故答案选C.
三、提升训练
下面以2017年云南省昆明市中考化学试卷为例:
练习将一定量镁粉、锌粉的混合物加入到适量硝酸亚铁和硝酸银的混合溶液中,充分反应后,过滤,得到滤渣和滤液,下列说法正确的是____(填序号).
A.滤液中一定有硝酸镁,滤渣中一定有银
B.若滤液为无色,则滤渣中一定有锌
C.取少量滤液,加入氯化钠溶液,无明显现象,则滤渣中一定有铁
D.取少量滤渣,加入过量稀盐酸,产生气泡,则滤渣的组成有3种情况分析
解题过程解决此类问题,学生应掌握一下知识点:

分析金属活动性为:Mg>Zn>Fe>H>Ag.
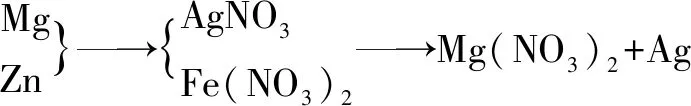
故选项A正确.
B项反应后的滤液是无色的,说明滤液中一定没有Fe(NO3)2,说明Fe在滤渣中,但Mg、Zn不能确定.因此,选项B是错误的.
C项取少量滤液,加入氯化钠溶液,无明显现象,说明滤液中一定不含AgNO3,而滤渣中含Ag.但Mg、Zn、Fe均不能确定.因此,选项C也是错误的.
D项取少量滤渣,加入过量稀盐酸,产生气泡.根据“优先原则”和“不共存原则”,滤渣中一定有Fe和Ag,可能有Mg或Zn,即可能有Fe、Ag;Fe、Ag、Mg;Fe、Ag、Mg、Zn三种组合,所以D选项正确.故该题的正确答案是A、D.
综上所述,金属与盐溶液反应后的成分判断问题,可以通过上述的两个原则,来具体分析其反应的发生过程,让学生明确反应过程的顺序和原理,从而使学生能够利用所学的知识来解决实际问题.

